猪繁殖和呼吸综合征病毒GP3蛋白糖基化位点突变株的构建及其生物学特性分析
刘欢欢,周艳君,姜一峰,张善瑞,童光志
(中国农业科学院上海兽医研究所,上海 200241)
猪繁殖与呼吸综合征是由猪繁殖与呼吸系统综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)引起的一种以母猪繁殖障碍、流产、死胎、木乃伊胎,仔猪发热、呼吸困难、腹泻、消瘦及高死亡率为特征的疾病[1]。2006年爆发的由猪繁殖与呼吸综合征病毒变异株引起的“猪高热综合症”更是对中国养猪业造成了巨大损失,至今仍是影响中国养猪业最重要的疾病之一[2-5]。
PRRSV 为有囊膜的单股正链RNA病毒,基因组全长约15 kb,含有9个开放阅读框。ORF2-ORF7 分别编码病毒的结构蛋白 GP2a、GP2b、GP3、GP4、GP5、M 和 N。其中 GP5、M、N 为主要结构蛋白[6];GP2a、GP3、GP4、GP5为糖基化的囊膜蛋白。GP3 是 PRRSV 中糖基化程度最高的蛋白, 欧洲型和北美洲型 PRRSV之间, GP3 的氨基酸同源性为54%~60%[7]。分析预测显示GP3蛋白含有7个糖基化位点,这些糖基化位点在不同毒株间均很保守[8]。GP3 与 GP2a 与 GP4 形成异源三聚体包装入病毒粒子,缺失这三种蛋白的病毒粒子会失去感染性[9]。
病毒的糖基化与病毒对细胞的吸附,病毒在细胞中的转运及免疫原性等密切相关。经过糖基化修饰的蛋白在病毒感染时能介导病毒与宿主细胞融合(如副粘病毒的F蛋白),而且某些特定位点的糖基化与副粘病毒蛋白的生物活性密切相关[10]。糖基化修饰还能使病毒某些重要的抗原表位被糖链遮盖,引起病毒的免疫逃逸现象,如人免疫缺陷病毒的 gp120 糖蛋白,因糖基化位点上的糖链遮盖中和抗原表位导致中和抗体不能将其识别[11]。
研究表明突变不同的糖基化位点,会对病毒的拯救以及病毒在细胞上的生长造成影响。关于GP3 蛋白糖基化的研究中,2007年有报道证实,PRRSV FL12株GP3蛋白中有5个位点(N-29、N-50、N-131、N-152、N-160)是被糖链修饰的,而 N42 和 N195 位不存在糖链,不是真正的糖基化位点[12]。 2010年,Das 等[13]研究指出 GP3 蛋白的 N195 位点没有糖链;N42A、N50A 或 N131A单个位点的突变都不能拯救出病毒,意味着这几个糖基化位点对病毒粒子的形成来说是必须的;N29A、N152A或N160A位点的突变不影响感染性病毒粒子的产生;对GP3糖基化位点进行多点突变显示,N29A/N152A、N29A/N160A、N152A/N160A、N29A/N152A/N160A多点突变后的 cDNA克隆都能拯救出病毒,但对生长速度有影响,其中N29A/N152A/N160A突变病毒与只含两点突变的毒株相比,生长更为缓慢并且滴度降低。 2011年Vu等[14]证实GP3的N131糖基化位点与GP5上的糖基化位点起着相同的作用,即保护病毒逃避宿主的中和抗体。
GP3蛋白的糖基化位点在不同亚型的毒株中均保守,因此对其糖基化位点的研究具有普遍意义。本实验选取高致病性 PRRSV 的致弱毒株HuN4-F112[15]GP3蛋白的5个N-糖基化位点进行单位点和多位点进行去糖基化改造,在全长感染性克隆的基础上拯救病毒,通过拯救病毒生物学特性的变化来探究这些糖基化位点的作用。
1 材料与方法
1.1 毒株、菌株与抗体 PRRSV HuN4-F112株、BHK和MARC-145细胞、大肠杆菌DH5α感受态细胞、PRRSV 的N蛋白单抗[16]均有本实验室保存;HuN4-F112株感染性分子克隆由本实验室构建及保存[17];FITC标记的羊抗鼠二抗购自中山金桥公司(北京)。
1.2 试剂 RNA提取试剂盒购于QIAGEN公司;体外转录试剂盒(Ambion) 反转录酶、TaqDNA聚合酶、T4 DNA连接酶、限制性内切酶Asc I和Swa I、dNTP混合物、DNA Marker等均购自大连宝生物有限公司;PFX高保真聚合酶购自Invitrogen公司。
1.3 引物设计与合成 根据HuN4-F112株GP3蛋白的基因序列,对其潜在糖基化位点进行在线分析(http://www.cbs.dtu.dk/services/NetNGlyc/),结果显示该株GP3蛋白存在7个糖基化位点。用Oligo6.0软件设计针对N29、N42、N50、N131位糖基化位点突变的引物,将预测位点中的氨基酸由N(AAT)突变为Q(CAG/CAA),同时设计ORF3片段鉴定引物(P3u/P3d)(见表1),所有引物均送由上海Invitrogen公司合成。
1.4 突变全长cDNA克隆的构建 引物中含有待突变的糖基化位点,以质粒为模板,采用环式定点PCR的方法进行突变以获得包含突变位点的双链质粒。将序列正确(已包含所需突变)的质粒及F-112株全长质粒经Asc I和Swa I双酶切,电泳后凝胶回收,用T4 DNA连接酶将两片段进行连接。连接好的重组质粒再经酶切和序列分析鉴定,鉴定正确的质粒进行线性化。本实验室构建的PRRSV HuN4-F112株感染性克隆在3'末端引入了SwaI酶切位点,经SwaI酶切后将包含全长的质粒由环状变为线性以备转染。

表1 糖基化位点突变引物及鉴定引物Table 1 Primers for mutation of glycosylation sites and sequence qualification
1.5 病毒的拯救
1.5.1 体外转录 按照体外转录试剂盒mMessage High Yield Capped RNA Taanscription kit 说明,对已线性化的质粒进行体外转录。
1.5.2 转染 转染前1 d预先准备好BHK细胞,将细胞铺入六孔板内。按照转染试剂说明,待细胞密度达到70%~90%,用DMRIE-C试剂进行转染。先将铺好的细胞用无血清培养基洗涤3次,取12 μL DMRIE-C试剂加入到1 mL OPTI-MEM的EP管中,混匀后加入2.5~5 μg转录好的RNA,混匀后立即加入到洗涤过的细胞中,然后置于37 ℃、5%CO2培养箱中培养4 h后吸出培养液,再加入2%~3%FBS的细胞维持液。24 h后收取细胞,-80℃保存。所有突变克隆均经3次转染。
1.5.3 病毒传代 病毒传代前1 d,预先将MARC-145细胞铺入六孔板内。待细胞长满单层,取冻溶后的BHK-21细胞离心取上清接入六孔板内。置于5%的CO2培养箱内,37 ℃孵育5 h后换2%~3%细胞的维持液。每5 d为一代次进行拯救病毒传代培养,传至第5代收取病毒。
1.6 拯救病毒的鉴定
1.6.1 间接免疫荧光 转染72 h后,弃去维持液培养基。用冰甲醇固定10 min,1%BSA室温封闭30 min,用PRRSV的N蛋白特异性单抗37 ℃孵育2 h,PBS洗3遍后再加入FITC标记羊抗鼠的二抗,37 ℃避光孵育1 h,用PBS洗5遍后,在倒置荧光显微镜下观察结果,并拍照。
1.6.2 重组病毒序列测定 将拯救的病毒提取RNA反转录后,用P3u/P3d引物扩增GP3蛋白相应片段,目的条带凝胶电泳后回收与T载体连接,挑取阳性克隆进行测序验证。
1.7 拯救病毒的生物学分析
1.7.1 拯救病毒TCID50的测定 将待检样品用培养液做10倍系列稀释后,将稀释度为10-1到10-10连续稀释的病毒接种到铺好并长至单层的Marc-145细胞96孔培养板内。每个稀释度接种8孔,即做8个重复,同时设两组阴性对照(用维持液代替病毒液)。置37℃、5% CO2培养箱内孵育,每隔12 h观察细胞,记录CPE情况。 结果依据Reed-Muench法计算TCID50。
1.7.2 细胞病变的观察 将拯救的病毒及亲本毒株以1MOI感染MARC-145细胞,48 h后观察细胞病变情况。
1.7.3 生长曲线的绘制 拯救病毒以0.1MOI感染MARC-145细胞,分别在感染后12、24、36、48、60、72、84、96 h收取100μL细胞上清液,用半数感染量(TCID50)计算病毒滴度,根据不同时间点病毒的滴度绘制病毒多步生长曲线。
2 结果
2.1 拯救PRRSV的鉴定 在构建HuN4-F112病毒感染性分子克隆时,曾将基因组第14 680位的A沉默突变为G,产生一个Mlu I酶切位点作为鉴定拯救病毒的分子标记。在本实验中,根据此酶切位点前后区域序列设计引物,以拯救出来的突变体病毒RNA作为模板进行RT-PCR扩增,扩增产物进行Mlu I酶切鉴定。结果显示拯救出来的PRRSV均为HuN4-F112病毒感染性分子克隆衍生的毒株,而非野毒感染(图1)。

2.2 拯救PRRSV特异性RT-PCR检测结果 用PRRSV ORF5和Nsp2基因特异性引物对拯救出的五代病毒进行RT-PCR检测。结果显示N29Q、N42Q、N50Q、N131Q、N29Q/N50Q、N29Q/N195Q突变体均为阳性,N29Q/N42Q、N29Q/N131Q、N29Q/N50Q/N131Q、N29Q/N42Q/N50Q/N131Q/N195Q均为阴性(图2)。

2.3 序列测定结果 通过对拯救病毒RT-PCR分析,PCR产物连接到T载体后获得单个克隆进行序列测定,所得的6株病毒序列中GP3蛋白相应位置糖基化位点均由N(AAT)变为Q(CAG),表明去糖基化突变成功(图3)。
2.4 间接免疫荧光检测结果 将上述PCR及酶切鉴定正确的6株病毒用PRRSV N蛋白单抗进行间接免疫荧光检测,结果显示在六株拯救病毒中均可见强烈荧光(图4)。
2.5 细胞病变 拯救病毒以1MOI接种MARC-145细胞,48 h后观察细胞病变,除N50Q外均可见细胞存在崩解、脱落、形态不规则等典型细胞病变(图5)。细胞病变结果与亲本HuN4-F112株引起的细胞病变基本一致。
2.6 拯救病毒的滴度 采用96孔组织培养板方法对第五代拯救病毒进行感染性滴度的测定。10倍梯度稀释病毒原液(10-1、10-2、10-3、10-4、10-5、10-6、10-7、10-8、10-9)后接种 MARC-145 细胞,结果用Reed-Muench法计算后如表2。

图4 PRRSV N蛋白间接免疫荧光检测拯救病毒结果Fig.4 Identification of the rescued viruses with monoclonal antibody against N protein of PRRSV
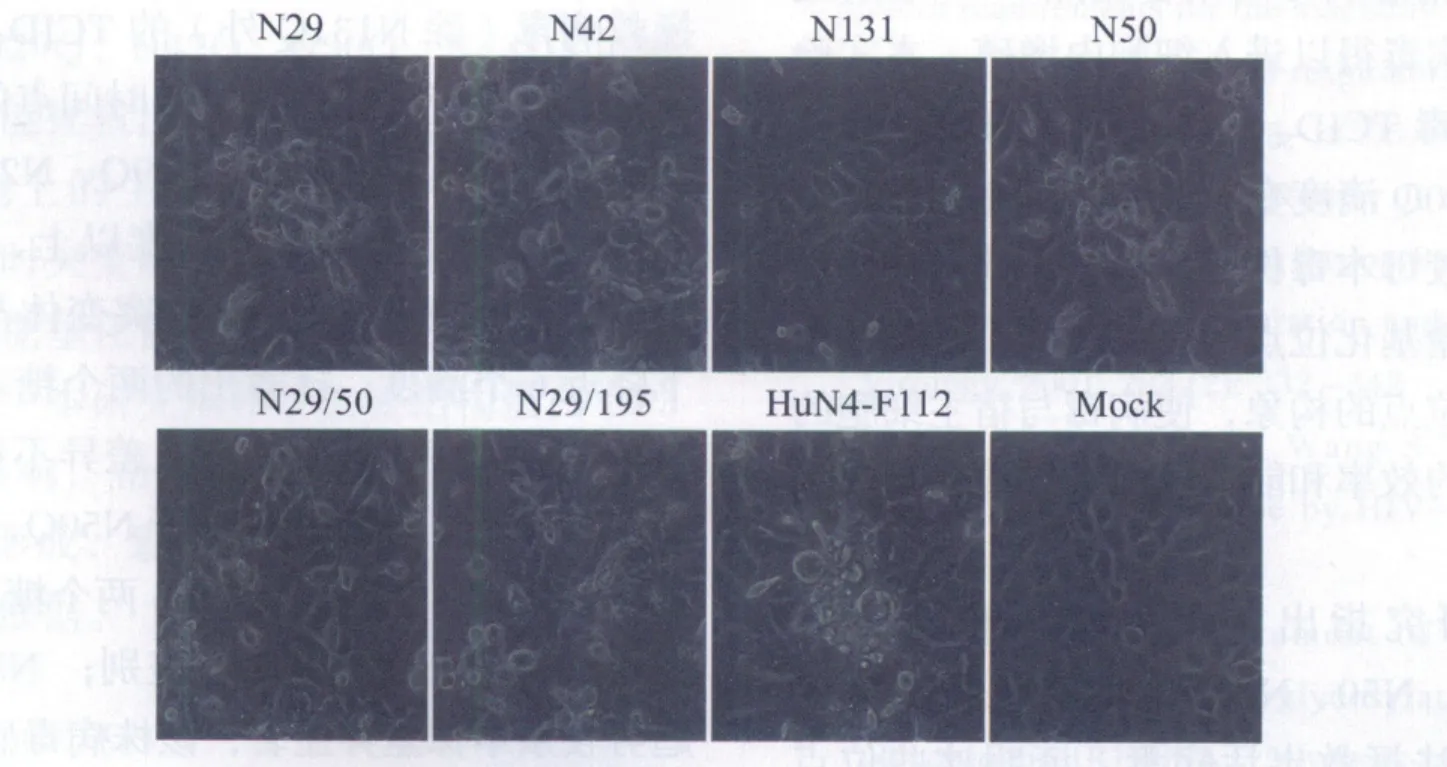
图5 拯救病毒接种MARC-145细胞48 h后出现细胞病变Fig.5 The CPE of MARC-145 cells 48 hours after infected with rescued viruses
表2 拯救病毒的TCID50Table 2 TCID50 of the rescued viruses
2.7 生长曲线的测定 96孔组织培养板方法进感染滴度的测定,取拯救毒株及HuN4-F112株不同时段的病毒上清液,测得的半数细胞感染量绘制成生长曲线(图7)。结果显示拯救的N42Q、N29Q、N29Q/N195Q在生长趋势上与HuN4-F112株存在一个多滴度的差别, 而N50Q株感染至48 h才出现病变,较亲本毒株生长明显延迟。

3 讨论
病毒的囊膜糖蛋白通常具有抗原性,可以选择性地识别宿主细胞受体并与之结合,使病毒囊膜与宿主细胞膜融合,进而侵入宿主细胞[18]。如流感病毒HA蛋白能识别宿主细胞表面的糖链受体,糖链末端的唾液酸是流感病毒的结合位点[19,20],通过这种识别和结合,病毒得以进入细胞内增殖。本实验中拯救的六株病毒TCID50均低于亲本毒株,并且以单点突变株N50Q滴度变化最大,所有拯救突变体病毒生长曲线较母本毒株也均有较大差异,一种可能的解释就是糖基化位点的消失改变了囊膜蛋白GP3上受体识别位点的构象,使病毒与宿主细胞的融合及进入细胞的效率和能力降低,导致病毒的滴度下降。
2007年有研究指出美洲型PRRSV FL12株GP3蛋白的N42、N50、N131位糖基化位点突变的cDNA克隆无法拯救出活病毒,证明这些位点对病毒粒子的形成至关重要,然而在本实验中这三个糖基化位点均可以拯救出病毒,与以往报道有所不同。GP3蛋白的7个糖基化位点在两种基因型的PRRSV之间均非常保守,但这三个位点在不同亚型的毒株间作用不尽相同,可见糖链在病毒蛋白的生物学功能的发挥中起着复杂而独特的作用。
从拯救病毒的滴度和生长趋势的分析中发现:拯救病毒(除N131Q外)的TCID50较亲本毒株有所降低,多步生长曲线中各时间点的生长趋势也呈下降趋势,其中N42Q、N29Q、N29Q/N195Q突变体比母源毒均下降1个滴度以上,N29Q/N50Q下降约2个多滴度,而N50Q突变体与亲本毒株相比下降近6个滴度;拯救出的两个糖基化位点突变体与单位点突变体病毒滴度上差异不显著,拯救病毒N29Q/N50Q的滴度反而高于N50Q,可见29、50两个单点突变与29/50、29/195两个糖基化位点同时突变相比病毒滴度没有明显差别; N50Q病毒的生长趋势较亲本株差异显著,该株病毒感染48 h后才开始出现细胞病变,与亲本株48 h后达到滴度高峰相比生长明显延迟,推测N50位糖基化位点在病毒对细胞的侵入及病毒粒子的形成中发挥着重要作用。
在本研究中一个值得注意的现象是针对单个位点的突变株均能拯救出病毒,但将多个位点同时突变有些则无法拯救出病毒。糖基化位点N29Q和N42Q单位点突变后病毒均能成功拯救,而N29Q/N42Q同时突变则不能拯救出病毒。同样,N29Q、N131Q位糖基化位点单个突变均能获得病毒,同时突变这两个位点则不能,这一现象也发生在将N29Q、N50Q、N131Q三个糖基化位点同时突变对病毒的拯救中。对无法拯救出病毒的质粒序列测定,除相应突变的糖基化位点存在改变外,其他序列与亲本株一致。一种可能的推测是在PRRSV中GP3蛋白中也可能存在一个糖基化位点的变化影响着另一个位点糖链的修饰,一个位点的改变通过空间位阻效应影响着其它位点的结构和被修饰的形式,从而导致整个蛋白糖基化种类的变异以致生物学功能发生改变。另一种可能是单个糖基化位点对病毒的影响是相对微弱的,改变这一位点的构象,其他位点会发挥代偿性作用,所以单个糖基化位点不具有决定性。但多个糖基化位点同时突变导致病毒的蛋白包装、折叠、修饰等加工过程改变,这种改变是多点同时变化造成的,没有其它位点代偿性机能的发挥。最终会使病毒无法识别和结合受体,不能将病毒囊膜与宿主细胞膜融合等,从而使病毒丧失了产生子代的能力。
本研究着眼于次要结构蛋白GP3,发现分别突变该蛋白上N29Q、N42Q、N50Q、N131Q位糖基化位点突变都能拯救出病毒,但是会影响病毒在MARC-145细胞上的生长,且N50Q位突变对病毒影响最大。同时突变两个以上位点则不能拯救出病毒,可见多个糖基化位点的同时存在对产生子代病毒粒至关重要。本研究阐释了次要结构蛋白GP3糖基化对病毒影响,希望能为后续研究糖基化对PRRS病毒粒子形成、致病性及免疫逃逸等方面的影响提供思路和依据。
[1]Dea S, Gagnon C A, Mardassi H, et al. Current knowledge on the structural proteins of porcine reproductive and respiratory syndrome ( PRRS)virus: Comparison of the North American and European isolates[J]. Arch Virol ,2000, 145(4): 659-688.
[2]Tong G Z, Zhou Y J, Hao X F, et al. Highly pathogenic porcine reproductive and respiratory syndrome, China[J].Emerg Infect Dis, 2007,13(9):1434-1436.
[3]童光志, 周艳君, 郝晓芳, 等. 高致病性猪繁殖与呼吸综合征病毒的分离鉴定及其分子流行病学分析[J].中国预防兽医学报, 2007, 29(5): 323-327.
[4]Tian K G, Yu X L, Zhao T Z, et al. Emergence of Fatal PRRSV Variants: Unparalleled Outbreaks of Atypical PRRS in China and Molecular Dissection of the Unique Hallmark [J]. PLoS One, 2007, 2(6): e526.
[5]Zhou Y J, Hao X F, Tong G Z, et al. Highly Virulent Porcine Reproductive and Respiratory Syndrome Virus Emerged in China[J].Transbound Emerg Dis, 2008, 55(3-4): 152-164.
[6]Snijder E J, van Tol H, Pedersen K W, et al. Identification of a novel structural protein of arteriviruses [J]. J Virol,1999, 73(8): 6335-6345.
[7]Meng X J, Paul P S, Halbur P G , et al. Sequence comparison of open reading frames 2 to 5 of low and high virulence United States isolates of porcine reproductive and respiratory syndrome virus[J]. J Gen Virol, 1995, 76(Pt12): 3181-3188.
[8]Gonin P, Pirzadeh B, Gagnon C A , et al. Sero neutralization of porcine reproductive and respiratory syndrome virus correlates with antibody response to the GP5 major envelope glycoprotein[J]. J Vet Diag Invest, 1999, 11(1): 20-26.
[9]Wissink E H, Kroese M V, van Wijk H A, et al. Envelope protein requirements for the assembly of infectious virions of porcine reproductive and respiratory syndrome virus[J].J Virol, 2005, 79(19): 12495-12506.
[10]MeGinnes L, Sergel T, Reitter J, et al. Carbohydrate Modifications of the NDV Fusion Protein Heptad Repeat Domains Influence Maturation and FusionActivity [J].Virology, 2001, 283 (2): 332 -342.
[11]Wei X P, Decker J M, Wang S Y, et al. Antibody neutralization and escape by HIV-1[J]. Nature, 2003,422(6929):307-313.
[12]Pattnaik A K. Enhancement of efficacy of PRRS vaccines by altering the glycosylation pattern of viral glycoproteins[R]. USA: University of Nebraska-Lincoln,2007.
[13]Das P B, Vu H L X, Dinh P X, et al. Glycosylation of minor envelope glycoproteins of porcine reproductive and respiratory syndrome virus in infectious virus recovery,receptor interaction, and immune response[J]. Virology,2011, 410(2): 385-394.
[14]Vu H L, Kwon B, Yoon K J, et al. Immune evasion of porcine reproductive and respiratory syndrome virus through glycan shielding involves both glycoprotein 5 as well as glycoprotein 3 [J]. J Virol, 2011, 85(11): 5555-5564.
[15]Tian Z J, An T Q, Zhou Y J, et al. An attenuated live vaccine based on highly pathogenic porcine reproductive and respiratory syndrome virus (HP-PRRSV)protects piglets against HP-PRRS [J]. Vet Microbiol, 2009,138(1-2): 34-40.
[16]周艳君. 猪繁殖与呼吸综合征病毒结构蛋白单克隆抗体的制备及其抗原表位的鉴定[D]. 哈尔滨: 东北农业大学, 2005.
[17]张善瑞.高致病性猪繁殖与呼吸系统综合征病毒及其弱毒株感染性克隆的构建和应用[D]. 北京: 中国农业科学院, 2010.
[18]潘浩, 周迎会, 吴士良. 糖基化与病毒[J]. 生命的化学,2005(25): 26-29.
[19]Suzuki Y, Kato H, Naeve C, et al. Single-aminoacid substitution in an antigenic site of influenza virus hemagglutinin can alter the specificity of binding to cell membrane-associated gangliosides[J]. J Virol, 1989,63(10): 4298 - 4302.
[20]Ito T, Suzuki Y, Takada A, et al. Differences in sialic acid-galactose linkages in the chicken egg amnion and allantois influence human influenza virus receptor specificity and variant selection [J]. J Virol, 1997, 71(4):3357-3362.

