Tn5转座子介导表达猪瘟E2蛋白和EGFP重组伪狂犬病毒的构建
高 博, 范志强,韩乃君,张 念,张锦霞,王 颖,白安斌,黄红梅,扈荣良, 吴健敏
(1. 广西大学, 南宁530005;2. 军事医学科学院军事兽医研究所, 长春 130122;3. 广西兽医研究所, 南宁 530001)
猪瘟是由猪瘟病毒(Classical swine fever virus,CSFV)引起的严重危害世界养猪业的一类高度接触性传染病,因其危害巨大,国际兽医局(OIE)将其列为须报告的16种动物传染病之一[1,2]。CSFV属黄病毒科、瘟病毒属,基因组为单股正链RNA病毒,全长为12.3 kb,编码3989个氨基酸[3]。研究表明,编码370个氨基酸的E2囊膜糖蛋白是其主要的保护性抗原蛋白,可以诱导机体产生保护性免疫反应[4]。因此,新型猪瘟疫苗的研制主要是围绕E2蛋白展开的。
伪狂犬病毒(Pseudorabies virus,PRV)是疱疹病毒的一员,可引起多种家畜和野生动物发热、奇痒和脑脊髓炎[5]。PRV病毒基因组为线性双链DNA分子,约150 kb。因PRV具有基因背景清楚,遗传稳定性强;含有许多病毒复制的非必需基因,外源基因容量大(30 kb);宿主范围广泛,且不感染人,安全性好等优点,因此本研究将其作为首选的病毒载体。
转座子(Transponson,Tn),又称易位子,是指存在于染色体DNA上可以自主复制和位移的一段DNA顺序。1951年,Barbara Mclintock 首先在玉米中发现了控制元件,后来被命名为转座元件或转座子[6]。转座子可以在不同复制子之间转移,以非正常重组方式从一个位点插入到另一个位点,对新位点基因的结构与表达产生多种遗传效应。本研究所用的Tn5转座子是一种细菌的转座子,两端分别带有转座元件IS50R和IS50L ,可在Tn5转座酶催化下随机插入、整合到目标DNA序列中,同时带入两端转座元件以内的DNA 序列,从而使外源基因可以随机地插入靶基因[7]。
本研究利用Tn5转座子可以携带外源基因的功能,将猪瘟E2基因和报告基因EGFP(增强绿色荧光蛋白基因,enhanced green fluoresce protein)随机地插入伪狂犬病毒的基因组中,构建了可以表达猪瘟E2蛋白和荧光蛋白的重组病毒。
1 材料和方法
1.1 病毒、质粒、细胞、菌种 猪瘟疫苗购自杭州荐量兽用生物制品有限公司;pEGFP-N1、pIRESneo质 粒、BHK-21细 胞、PRV Bartha-K61株、DH5α菌种均为本实验室保存;pMD18-T购自TaKaRa公司;EZ-Tn5 pMOD-2购自EPICENTRE公司。
1. 2 试剂 AMV Reverse Transcriptase、RNase Inhibitor、dNTP、Ex-Taq DNA 聚 合 酶、CAIP、T4 DNA连接酶及限制性内切酶ApaI、BamH I、Bst1107 I、EcoR V、Hind III、NruI、SmaI、XhoI、PvuII均购自TaKaRa公司;Klenow购自Biolabs公司;DNA凝胶回收试剂盒、质粒小量提取试剂盒购自Axygen公司。
1.3 设计与合成 参考GenBank关于C株的全基因序列,利用primer5.0设计并合成两对针对猪瘟病毒E2基因全长的特异性引物和一对E2基因的鉴定引物(划线部分为引入的酶切位点EcoR V和BamH I),由南京金斯瑞生物科技有限公司合成。

表1 PCR引物序列Table 1 Primer sequences for PCR
1.4 载体的构建 以猪瘟疫苗为模板,提取总RNA,进行RT-PCR后,采用巢式PCR扩增出E2全基因序列,连接至pMD18-T载体并测序。将测序正确的E2基因经EcoR V和BamH I酶切之后定向克隆至pIRESneor真核质粒的多克隆位上,得到真核表达质粒pIRESneor-E2。ApaI和PvuII双酶切pEGFP-N1;SmaI和XhoI双酶切 pIRESneor-E2,klenow和dNTP补平之后,用EGFP表达盒替换pIRESneor-E2的neor基因,构建包含有E2基因和EGFP串联表达盒的质粒pIRES-E2-GFP。Mlu I和Bst1107I酶切pIRES-E2-GFP,将含有从CMV启动子到Poly(A)尾之间的表达盒定向克隆至经Sma I酶切的TNTMpMOD-2的多克隆位点处,构建转座质粒TNTMpMOD-E2-GFP。
1.5 转座片段的回收 Pvu II单酶切转座质粒TNTMpMOD-E2-GFP,凝胶试剂盒纯化含有转座序列和目的基因的线性化转座片段Line-TNTMpMOD-E2-GFP。
1.6 PRV基因组的提取 将PRV接种于长满单层的BHK-21细胞,37℃、5% CO2条件下培养,待其80%的细胞病变并脱落时,回收脱落的细胞,未脱落的细胞使用细胞刮子刮下。4 ℃、4500×g离心10 min,弃去上清,沉淀下来的细胞使用PBS(pH 7.4)重新悬浮。其余的提取 PRV 基因组DNA 的实验步骤按参考文献[8]介绍的方法进行
1.7 体外转座 将线性化的TNTMpMODTM-E2-GFP与伪狂犬病毒基因组在Tn5转座酶介导下进行体外转座。体系如下:1μL EZ-Tn5 10X Reaction Buffer、2μL(0.2μg)PRV genome、6μL Line-TNTMpMODTM-E2-GFP、1μL EZ-Tn5 Transposase,37 ℃水浴120 min,随后加入终止液,70 ℃水浴10 min,终止反应。
1.8 转染 转染前,用不含青链霉素和胎牛血清的MEM培养基洗涤六孔板中长满单层的BHK细胞2次,加入1.5 mL的双无培养基培养。取转座产物4μL,无菌加入200μL双无MEM,涡旋混匀,室温静止放置5 min。加入FuGENERHD Transfection Reagent的转染试剂6μL,涡旋混匀后室温放置15 min。将混合物逐滴加入六孔板中,并轻微晃动,使其混合均匀。
1.9 重组病毒的拯救 转染后6 h换正常MEM培养基,37 ℃、5%CO2培养48 h。将其反复冻融2次,接BHK-21细胞。8~12 h后,荧光显微镜下观察,若有荧光出现,则认为重组病毒已成功被拯救。
1.10 重组病毒的PCR鉴定 取重组病毒的细胞冻融物少许,煮沸5 min,离心取上清,进行PCR鉴定。1.11 病毒的纯化 将转染后出现荧光的细胞反复冻融2次,100陪稀释后接种BHK-21细胞,37 ℃、5%CO2培养48 h。反复冻融2次,再次100倍稀释后接种BHK-21细胞,如此反复稀释3次后,利用显微操作技术,荧光显微镜下用显微注射针(末端为平头,直径为25~30μm)挑取出现荧光的单个细胞,接种BHK-21,37℃、5%CO2培养48 h。待出现大面积的荧光灶之后,再次挑选单个荧光细胞,接种BHK-21细胞。如此反复3次之后,可以初步认为病毒纯化完全。
1.12 间接免疫荧光试验 将BHK细胞铺于六孔板中,待其长满单层,接种纯化后的重组病毒,37 ℃、5%CO2培养24 h;然后丙酮固定10 min,加入抗CSFV E2的抗体,37 ℃作用2 h,PBS洗涤3次;加入荧光标记的羊抗猪IgG,37 ℃作用30 min,PBS洗涤3次,吹干,加入缓冲甘油,荧光显微镜下观察。
2 结果
2.1 E2基因的PCR鉴定结果 以猪瘟疫苗为模板,RT-PCR扩增猪瘟病毒E2基因全长,获得大小为1110 bp的片段,结果如图1。
图1 猪瘟病毒E2基因的PCR扩增Fig.1 PCR amplificetion of E2 gene of CSFV
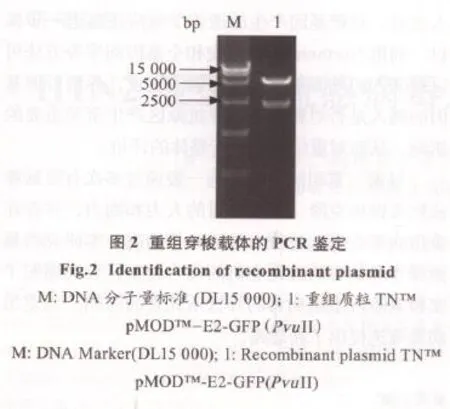
2.2 重组穿梭载体的酶切鉴定 以Pvu II酶切TNTMpMODTM-E2-GFP重组质粒,获得大小2367 bp和5355 bp两个片段,结果如图2。
2.3 重组病毒的包装 将初次转染的BHK-21反复冻融2次,100倍稀释接种BHK-21细胞,为F1代;将F1代反复冻融2次,100倍稀释接种BHK-21细胞,为F2代,如图3。
2.4 重组病毒的纯化 利用显微操作技术,挑取单个荧光细胞接种BHK细胞。连续纯化3代,分别命名为一代重组病毒、二代重病毒、三代重组病毒,如图4。
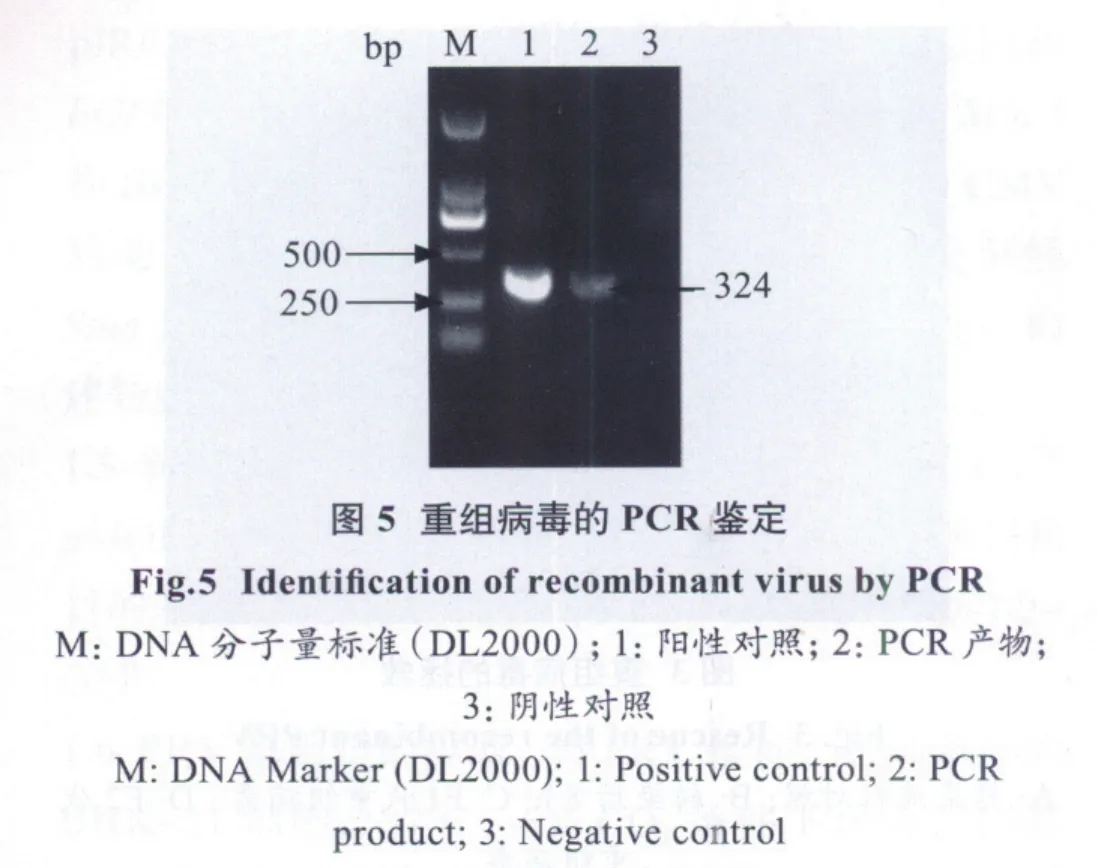
2.5 重组病毒的PCR鉴定 取病变的细胞上清,煮沸5 min,10 303×g离心5 min,作为模板,用设计的鉴定引物进行PCR鉴定,获得324 bp的片段,如图5。

2.6 间接免疫荧光(Indirect immuno fl uorescence)取第3代纯化的病毒100倍稀释接种BHK细胞,37 ℃、5%CO2培养12 h,丙酮和甲醛1:1固定之后,以CSFV鼠源高免血清为一抗,以荧光标记的羊抗鼠的IgG为二抗,进行间接免疫荧光试验,结果如图6。
3 讨论
猪瘟每年对全世界范围内的养猪业都造成了巨大的经济损失,疫苗接种是目前防控猪瘟的主要手段。长期以来,中国兔化弱毒疫苗在猪瘟的预防中起到了巨大作用,然而近年来隐形感染、周期性、波浪型及非典型猪瘟等新疫情的出现,对弱毒疫苗的使用提出了新的挑战。同时,目前血清学方法检测很难区别疫苗免疫与野毒感染,为猪以及其相关产品的贸易带来了不便,因此新型标记疫苗的研制成为当前研究的热点[9]。基因工程亚单位疫苗、病毒活载体疫苗、DNA疫苗等新型疫苗的研制为猪瘟的预防提供了新的工具和手段。其中活载体疫苗因其免疫动物时向宿主免疫系统提交免疫原性蛋白的方式与自然感染时的真实情况很接近,可诱导产生的免疫比较广泛,包括体液免疫和细胞免疫,甚至黏膜免疫等优点,为众多研究者所青睐。猪瘟病毒E2蛋白是诱导产生保护性中和抗体的主要抗原结构蛋白,针对E2 囊膜糖蛋白的研究成为攻克猪瘟的热点。本研究构建了针对猪瘟病毒E2蛋白的重组活载体疫苗,并通过间接免疫荧光定性的鉴定E2的表达,为疫苗的研制进一步打下了基础。

本研究将CSFV E2基因作为外源基因通过转座子介导,随机插入靶基因PRV病毒基因组中并获得了表达,此方法为活载体疫苗的构建提供了新的思路。但转座子介导外源基因在靶基因的随机插入之后,对靶基因产生的遗传学效应还需进一步探讨。利用Northern印迹杂交和全基因测序等方法可以对插入的外源基因进行准确的定位,弄清外源基因的插入是否对靶基因主要抗原区产生至关重要的影响,从而对重组疫苗进行整体的评价。
目前,重组病毒的筛选一般通过多次有限稀释或病毒蚀斑克隆,需要大量的人力和物力,并存在重组病毒在筛选过程大量丢失等情况。本研究将显微操作和病毒的纯化有机的结合起来,大大缩短了实验室阶段重组病毒的筛选所耗费的时间,为重组病毒筛选提供了新思路。
[1]Moennig V, Floegel-Niesmann G, Greiser-Wilke I.Clinical signs and epidemiology of classical swine fever: a review of new knowledge [J].Vet J, 2003,165(1): 11-20.
[2]Terpstra C. Hog cholera: an update of present knowledge[J].Br Vet J, 1991, 147(5): 397-406.
[3]Rümenapf T, Unger G, Strauss J H, et al. Processing of the envelope glycoproteins of pestiviruses[J]. J Virol, 1993,67(6): 3288-3294.
[4]Bouma A, de Smit A J, de Kluijver EP, et al. Efficacy and stability of a subunit vaccine based on glycoprotein E2 of classical swine fevervirus[J]. Vet Microbiol,1999, 66(2):101-114.
[5]殷震, 刘景华. 动物病毒学[M]. 北京: 科学出版社,1998: 625-670.
[6]Gierl A, Saedler H. Plant-transposable elements and gene tagging [J]. Plant Mol Biol, 1992, 19(1): 39-49.
[7]李惠, 赵明磊, 尹隽, 等. 利用Tn5转座子构建杆状病毒AcMNPV随机突变体的初步研究[J]. 复旦学报(自然科学版), 2005, 44(4): 498-502.
[8]Smith G A, Enquist L W. Construction and transposon mutagenesis in Escherichia coli of a full-length infectious clone of pseudorabies virus, an alphaherpesvirus[J]. J Virol,1999, 73: 6405-6414.
[9]de Smit A J. Laboratory diagnosis, epizootiology, and efficacy of marker vaccines in classical swine fever:areview [J]. Vet Q, 2000, 22(4): 182-188.
[10]赵启祖, 谢庆阁. 抗猪瘟基因工程研究[J]. 兰州大学学报(自然科学版), 1994, 30(增刊): 169-170.

