血氧饱和度引导下供氧对心搏骤停复苏自主循环恢复患者神经功能的影响
余益民,曾淑芳,陆维娣
广东省深圳市急救中心,广东深圳 518035
1953年世界上第一个多中心研究报道672例心博骤停患者心跳恢复后院内病死率为50%。半个多世纪过去了,心博骤停复苏后自主循环恢复(restoration of spontaneous circulation,ROSC)患者病死率并未明显改善。2004年英国开展的一项24 132例收入重症监护病房(ICU)心搏骤停患者的调查结果表明,住院病死率仍为71%[1]。2006年美国国家心肺复苏登记处(NRCPR)发表报道在恢复自主循环的心博骤停患者中,19 819例成人和524例儿童院内病死率分别是67%和55%。此外,ROSC存活的患者依然存在不同程度的神经功能障碍,包括记忆缺失或认知功能障碍,重者出现意识障碍,甚至植物状态。本研究通过前瞻性随机对照试验对比心脏骤停患者复苏后自主循环恢复早期给予纯氧和根据脉冲血氧饱和度调整吸氧浓度使血氧饱和度达到94%~96%供氧两种供氧方式对神经系统预后的影响,目的在于理论上为纯氧所致的氧化应激对ROSC后早期神经元的损伤作用提供佐证,在实践上,可以为“心搏骤停后综合征”患者脑保护治疗策略提供临床循证依据。现报道如下:
1 资料与方法
1.1 一般资料
选取2009年1月~2011年1月3家深圳市急救网络医院ICU收治CPR自主循环恢复(ROSC)并昏迷住院的患者为研究对象。纳入标准:心搏骤停后自主循环恢复但出现脑损伤的患者。排除标准:①体温<37℃或>39℃;②平均动脉压在复苏后任何时刻<60mmHg(1mmHg=0.133kPa)或<80mm Hg超过 10 min;③PaO2不能维持在 80~100 mm Hg;④PaCO2不能维持在35~45 mm Hg;⑤原无脑、肺、肾等重要器官的慢性疾病史。符合条件的患者102例,其中,男58例,女44例;年龄 35~72 岁,平均(58.5±10.7)岁;基础疾病中有明确心脏病史者49例(40.5%),无明确心脏病史者53例(59.5%)。主要病种包括急性心肌梗死、风心病、心肌病心衰、心肌炎、心律失常、脑血管意外、慢阻肺、肺癌、尿毒症、低钾血症、内分泌危象、白血病、中毒、过敏性休克、溺水、电击伤、麻醉意外等。将102例患者按随机数字表法分为试验组和对照组,各51例。两组患者年龄、性别、病程、合并症、神经功能缺损评分等一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 治疗方法
在ROSC后,对两组患者进行气管插管下机械通气,复苏后10 min内两组均给予100%吸入氧浓度(FiO2),随后的1 h内,分别对对照组和试验组实施纯氧供氧和根据脉冲血氧饱和度调整吸入氧浓度,每2分钟将血氧饱和度降低5%至94~96%供氧,然后两组患者均送入ICU(急诊ICU或综合ICU)进行重症监护,继续机械通气,PaO2维持在80~100mmHg,PaCO2维持在35~45mm Hg;给予循环支持、亚低温等复苏后处理。
1.3 观察指标
于复苏后第1、2周采空腹静脉血测定血清超氧化物歧化酶(SOD)、丙二醛(MDA)水平,采用比色法进行测定。于复苏后第3天进行APACHEⅡ评分;记录复苏后第28天的临床转归。
1.4 统计学处理
采用SPSS 16.0统计软件包进行数据处理,计量资料数据以均数±标准差(x±s)表示,组间比较采用t检验,两组率的比较用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 复苏后两组患者SOD、MDA水平比较
在复苏后第1、2周,试验组与对照组比较,SOD较高,血清MAD较低,差异有统计学意义(P<0.05)。见表1。
2.2 复苏后第3天两组患者APACHEⅡ评分比较
复苏后第3天,对照组和试验组APACHEⅡ评分分别是(16.34±5.12)分和(12.26±4.98)分,两组比较,差异有统计学意义(P<0.05)。

表1 治疗前后两组病例SOD、MDA水平比较(x±s)
2.3 复苏后第28天临床转归
复苏后第28天两组的临床转归中,试验组中,神经功能恢复正常或轻度障碍的患者较对照组显著增加(P<0.05),而植物状态和死亡的患者较对照组显著减少(P<0.05),神经功能重度障碍患者在两组间例数相同。见表2。
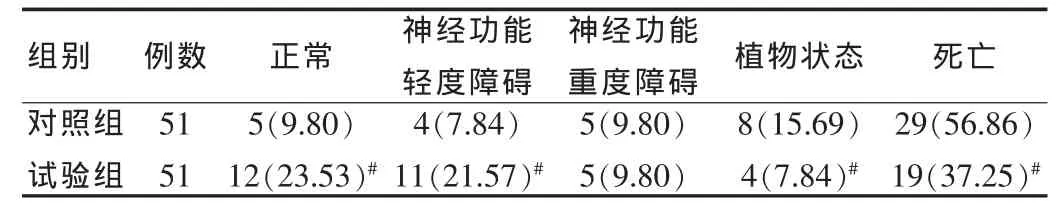
表2 复苏后第28天临床转归[n(%)]
3 讨论
2008年国际复苏联盟、美国心脏协会及相关机构在《循环》杂志上联合发表了“心搏骤停后综合征(post-cardiac arrest syndrome,PCAS)”的专家共识(下简称“2008 共识”),提出了PCAS的概念:经历心搏骤停的幸存者,由于全身性缺血与再灌注的影响,在自主循环恢复后极易发生广泛的组织器官损伤。此即所谓“心搏骤停后综合征”[2]。
PCAS患者预后较差主要是由于四种病理生理过程:①心搏骤停后脑损伤;②心搏骤停后心肌功能障碍;③全身性缺血再灌注反应;④持续诱因性病变。其中心搏骤停后脑损伤是PCAS常见的死亡原因,一份研究报道院前发生心脏停搏的患者被送到医院后最终死于脑损伤的高达68%[1]。造成死亡的原因是神经元的过激反应,以及细胞死亡信号通道的激活,使选择性易损神经元在ROSC后数小时或数日内出现变性、退化,以至坏死。在ROSC的最初数分钟内会出现脑灌注压升高和脑血管自动调节障碍,从而导致脑水肿与缺血性神经变性。而在再灌注的初始阶段,过度氧供也会加剧脑损伤。
复苏后干预时机的选择对患者预后很重要。在“2008共识”中,复苏后时间阶段被定义为:①即刻,为ROSC<20 min,此阶段可在现场、转运途中或急诊期间。②早期阶段,为ROSC 20 min至6~12 h,早期阶段组织器官损伤有限,实施干预措施可能最为有效,此阶段主要集中在器官支持方面。③中间阶段,为6~12 h至72 h,此时期组织器官损害仍在继续,应采取积极的特殊治疗。④超过3 d则为恢复期,此阶段对预后能获得更可靠的预测性[2]。因此,如能把握不同时机进行有效的干预治疗,对降低病死率、改善临床预后是必要的。
目前PCAS的治疗策略强调以脑复苏为目标进行系统性重症监护和综合性治疗[3],而针对脑损伤的干预策略主要包括:①亚低温治疗;②增加脑血流量;③适当通气;④氧合。目前,ROSC后患者最佳的吸氧浓度仍是一个有争议的问题。2005国际心肺复苏指南[4]指出,为了改善氧合功能,只要具备供氧条件,治疗者应该在基础生命支持和高级生命支持过程中均应给予100%的吸入氧浓度。高吸入氧浓度往往会使动脉血氧饱和度达到最大值,从而达到最佳的动脉血氧含量。当心输出量受到限制时,这将有助于氧的输送(心输出量×动脉血氧含量)。这种短期的氧疗方案不会造成氧中毒。诚然,保证患者在ROSC后不至于低氧是很重要的,但是已经有越来越多的临床前期证据表明缺血再灌注早期高浓度供氧将致氧化应激而损害缺血后神经元[5-8]。Balan等[9]在狗的CA模型中,对比了ROSC后1 h内给予100%的纯氧和ROSC后立即将狗血氧饱和度调整为94%~96%并维持1 h,两者接受23 h的重症监护和治疗后用纳洛酮催醒,发现前者比后者的神经系统预后更差。 后者的狗能感知周围情况,而前者的狗处于昏睡状态,后者神经系统缺损评分显著低于前者,体视学分析后者海马CA1区受损神经元比前者明显少,后者氟乙玉染色CA1区退化神经元也比前者少。氧化应激是指体内活性氧的生成增加和(或)清除活性氧的能力降低,导致活性氧的生成和清除失衡,过量的活性氧引起分子、细胞和机体的损伤。氧化应激在ROSC后大脑缺血再灌注损伤中扮演很重要的角色,已有证据揭示了大脑缺血后氧化应激和神经元的死亡关系以及抗氧化剂对神经元的保护作用[10-12]。鉴于此,2010国际心肺复苏新指南[13]已经有所修改,它指出,如果相关设备齐全,ROSC患者调整吸氧浓度使血氧饱和度至不低于94%可能是合理的。但是,这个结论是建立在动物实验基础上的,目前关于ROSC早期供氧的临床研究证据是不足的,特别是随机对照试验。近3年有3个较大样本的临床研究,但都是回顾性的,而且对于是否应该针对ROSC患者推荐降低吸氧浓度的结论并不统一[14-15]。在国内,大多数临床医师仍然对ROSC患者给予高浓度氧(一般高于60%),目前仍缺乏ROSC早期纯氧和较低的吸氧浓度供氧对患者神经系统预后影响的对比研究。
MDA是脂质过氧化物的最终代谢产物之一,是自由基的一种,它的上升能引起蛋白质交联变性、DNA断裂,在颅内则表现为神经元的损伤;SOD在体内自由基清除系统起关键作用,不断解除超氧阴离子(O2-)及H2O2所引起的连锁反应,保护细胞免受氧自由基损伤。本研究中,在复苏后第1、2周,试验组与对照组比较,SOD较高,血清MAD较低,反映试验组因氧化应激而产生的自由基较少,因而提示血氧饱和度引导下供氧相对纯氧而言,对神经元损伤较小。
APACHEⅡ评分是目前ICU常用的病情评价及预后预测方法,对危重患者的预后预测有较大的临床应用价值。它既包括患者既往的身体健康状况,也包括患者住院期间的急性生理学指标,还考虑到患者的年龄因素等对预后的影响。在急性生理学指标中既包括多种临床生化、动脉血气等指标,也包括反映患者神经功能的GCS评分,理论上应对ROSC患者的预后有较好的预测价值,但目前相关报道很有限。孟新科等[16]研究表明APACHEⅡ13分是区别ROSC预后良好的最佳截断点。本研究尝试用APACHEⅡ评分对ROSC患者预后进行评价,结果发现试验组平均评分在13分以下,而对照组在13分以上,且差异有统计学意义,结合复苏后第28天临床转归对比,发现试验组中,神经功能恢复正常或轻度障碍的患者较对照组显著增加,而植物状态和死亡的患者较对照组显著减少,因此可以认为,根据脉冲血氧饱和度调整吸入氧浓度相对于纯氧而言可改善神经系统预后。此外,本试验也存在一些缺陷,如:样本量较小、未对神经系统检查进行观察、未对患者进行生活活动能力和生活质量指标的观察,有待于在以后的临床试验中进一步完善。
[1]Laver S,Farrow C,Turner D,et al.Mode of death after admission to an intensive care unit following cardiac arrest [J].Intensive Care Med,2004,30(3):2126-2128.
[2]Neumar RW,Nolan JP,Adrie C,et al.Post-cardiac arrest syndrome:epidemiology, pathophysiology, treatment,and prognostication, a consensus statement from the International Liaison Committee on Resuscitation(American Heart Association,Australian and New Zealand Council on Resuscitation,European Resuscitation Council.Heart and StrokeFoundation ofCanada,InterAmerican HeartFoundation,Resuscitation Council of Asia,and the Resuscitation Council of Southern Africa), the American Heart Association Emergency Cardiovascular Care Committee l the Council on Cardiovascular Surgery and Anesthesia;the Council on Cardiopulmonary,Perioperative.and Critical Care the Council on Clinical Cardiology;and the Stroke Council[J].Circulation,2008,118(23):2452-2483.
[3]廖晓星.心搏骤停后的脑保护策略[J].中华急诊医学杂志,2010,19(1):7-10.
[4]International Liaison Committee on Resuscitation.2005 International Consensus on cardiopulmonary resuscitation and emergency cardiovascularcare science with treatmentrecommendations [J].Resuscitation,2005,112:111-119.
[5]Vereczki V,Martin E,Rosenthal RE,et al.Normoxic resuscitation after cardiac arrest protects against hippocampal oxidative stress,metabolic dysfunction,and neuronal death [J].J CerebBlood Flow Metab,2006,26(6):821-835.
[6]Richards EM,Fiskum G,Rosenthal RE,et al.Hyperoxic reperfusion after global ischemia decreases hippocampal energy metabolism[J].Stroke,2007,38(5):1578-1584.
[7]Zwemer CF,Whitesall SE,D′Alecy LG.Cardiopulmonary-cerebral resuscitation with 100%oxygen exacerbates neurological dysfunction following nine minutes of normothermic cardiac arrest in dogs[J].Resuscitation,1994,27(2):159-170.
[8]Liu Y,Rosenthal RE,Haywood Y,et al.Normoxic ventilation after cardiac arrestreduces oxidation ofbrain lipids and improves neurological outcome[J].Stroke,1998,29(8):1679-1686.
[9]Balan IS,Fiskum G,Hazelton J,et al.Oximetry-guided reoxygenation improves neurological outcome after experimental cardiac arrest[J].Stroke,2006,37(12):3008-3013.
[10]Nakai A,Kuroda S,Kristian T,et al.The immunosuppressant drug FK506 ameliorates secondarymitochondrialdysfunction following transient focal cerebral ischemia in the rat[J].Neurobiol Dis,1997,4(3-4):288-300.
[11]Rosenthal RE,Chanderbhan R,Marshall G,et al.Prevention of postischemic brain lipid conjugated diene production and neurological injury by hydroxyethyl starch-conjugated deferoxamine[J].Free Radic Biol Med,1993,14(1):96-97.
[12]Peberdy MA,Callaway CW,Neumar RW,et al.Part 9:post-cardiac arrestcare:2010 American HeartAssociation Guidelines for cardiopulmonary resuscitation and emergency cardiovascular care[J].Circulation,2010,122(suppl 3):S768-S786.
[13] de Jonge E,Peelen L,Keijzers P,et al.Association between administered oxygen,arterial partial oxygen pressure and mortality in mechanically ventilated intensive care unit patients[J].Critical Care,2008,12(6):R156.
[14] Kilgannon JH,Jones AE,Shapiro NI,et al.Association between arterial hyperoxia following resuscitation from cardiac arrest and inhospital mortality[J].JAMA,2010,303(21):2165-2171.
[15]Bellomo R,Bailey M,Eastwood GM,et al.Arterial hyperoxia and inhospital mortality after resuscitation from cardiac arrest[J].Critical Care,2011,15(2):R90.
[16]孟新科,石少权,赵志刚,等.APACHEⅡ评分对心肺复苏自主循环恢复昏迷患者预后预测的研究[J].中国急救医学,2009,29(4):293-295.

