肝移植术后胆道狭窄经皮肝穿刺胆管造影的并发症及其预防
肝移植术后胆道并发症已成为影响患者长期生存及移植肝功能的重要因素,其发生率高达7%~34%[1]。介入技术作为一种非外科途径处理胆道并发症已得到了肯定[2~4]。本研究采用经皮肝穿刺胆道介入方法,包括经皮肝穿刺胆管造影(percutaneous transhepatic cholangiography, PTC)、置管引流、球囊扩张、胆道支架置入,对30例原位肝移植术后发生胆道狭窄患者进行治疗,分析介入治疗中出现的并发症的类型及预防措施。
1 资料与方法
1.1 一般资料 2002-04~2009-02解放军第309医院施行292例肝移植,其中,男性248例,女性44例;年龄 19~79岁,平均 47.1±31.9岁。原发性疾病:原发性肝癌132例,急性或慢性重型乙型肝炎57例,乙型肝炎肝硬化89例,酒精性肝硬化14例。供肝选择:均为尸体供肝,供受体ABO血型均相同。冷缺血时间为 3.0~11.5h,平均 6.18h,热缺血时间为3~7min,平均4min。本组经典式肝移植236例,背驮式肝移植56例。30例(10.27%)术后出现渐进性黄疸,临床表现为皮肤、巩膜黄染伴全身瘙痒。实验室检查:丙氨酸转氨酶(alanine aminotransferase, ALT)11~623U/L,天冬氨酸转氨酶(aspartate aminotransferase, AST)17~523U/L,总胆红素(total bilirubin, TB)79.2~648.3μmol/L,直接胆红素(direct bilirubin, DB)59.6~473.3μmol/L。胆管造影证实存在胆道狭窄[5],包括吻合口狭窄合并胆瘘 3例(10.0%)、单纯吻合口狭窄 3例(10.0%)、肝内胆管和胆总管多发狭窄8例(26.7%)、肝内胆管和胆总管多发狭窄合并胆泥形成14例(46.7%)、T形管引流口段狭窄2例(6.7%)。对2例T形管引流口段狭窄患者采用经皮经肝胆管引流术(percutaneous transhepatic cholangial drainage, PTCD)的原因:1例球囊扩张困难,考虑易造成胆漏;另1例合并胆道十二指肠瘘,行T形管引流口引流后效果不佳。30例患者确诊时间为肝移植术后96d至5年4个月,平均为814.3±516.5d,发生在术后1年以上24例,占80.0%。患者随访14~96个月,平均41±55个月。
1.2 治疗方法 经皮胆道穿刺成功后造影了解狭窄部位,导入超滑导丝至肠腔,在超滑导丝引导下插入Cobra导管后,交换超硬导丝,沿导丝导入4~8mm的球囊导管,在X线监视下将球囊置于狭窄部位,连接压力泵进行加压,球囊压力保持在8个大气压,完全扩张5min后,放出气体,间歇5min后再扩张5min,反复扩张至狭窄消失。然后置入8F或10F内外引流管,用50ml生理盐水加入16万U庆大霉素反复冲洗胆道以使大量胆泥随冲洗液排出。2例T形管胆总管引流口段狭窄患者,经窦道球囊扩张治疗困难,行经皮肝穿刺胆道内置入10F内外引流管进行治疗。术后常规给予补液、抗生素治疗。用地塞米松10mg加入100ml生理盐水缓慢冲洗胆道,每日2次。加用消炎利胆片以增加胆汁分泌量。1周后再次造影观察胆道狭窄纠正情况,如仍存在狭窄,则重复上述治疗。
1.3 疗效判断标准 治愈:治疗后胆红素和转氨酶降至正常范围,临床症状和体征消失,维持1个月以上。好转:治疗后胆红素和转氨酶下降,但不能降至正常范围,临床症状和体征好转。无效:治疗后胆红素继续升高,临床症状继续加重。
1.4 并发症的评价 观察内容包括PTCD的术中反应、术后临床经过、实验室检查结果、经皮经肝胆管引流术超声和复查胆道造影表现,计算并发症发生率(并发症发生率=并发症发生例数/治疗例数);计算不同类型并发症的发生频次(某一类型并发症发生频次=某一并发症出现例次/治疗总人次数)。患者出现1种以上并发症或同一患者在数次治疗均出现相同并发症时仍按1例计算。
2 结果
2.1 介入技术 30例患者共行胆道造影和球囊扩张成形术94次,并置入引流管给予引流治疗,其中1例行胆道支架置入术。单例最多行胆道造影和气囊扩张成形术11次。13例(43.3%)治愈,包括3例单纯吻合口狭窄(图1)、3例吻合口狭窄合并胆瘘和7例肝内胆管和胆总管多发狭窄患者。胆瘘患者充分引流治疗2~3周后胆瘘自行闭合而获得痊愈。13例患者复查B超和胆道造影均显示胆道形态基本恢复正常,无胆管狭窄征象,胆红素和转氨酶降至正常范围,临床症状和体征消失。14例(46.7%)好转,包括12例肝内胆管和胆总管多发狭窄合并胆泥形成(图2)、2例T形管引流口段狭窄。黄疸明显减轻,复查肝功:ALT15~127U/L,AST45~96U/L,TB24.3 ~ 54.3μmol/L,DB10.9 ~34.5μmol/L。 复 查造影显示狭窄明显减轻。
2.2 术中并发症 30例患者局麻前均常规应用杜非合剂半量[哌替啶(杜冷丁)注射液50mg+异丙嗪(非那根)25mg,肌注)]。但所有患者行气囊扩张成形术时均感疼痛(100.0%)。12例(40.0%)疼痛剧烈,给予吗啡30mg后疼痛减轻,其中1例为肝内胆管和胆总管多发狭窄患者,其余11例均为胆管和胆总管多发狭窄合并胆泥形成患者。1例肝内胆管和胆总管多发狭窄合并胆泥形成患者由于穿刺位置低,置管后引起大出血,钢圈栓堵引流道后,再次穿刺胆道分支行PTC(图3)。术后反复充分冲洗引流。10d后患者血胆红素水平明显下降,复查造影狭窄明显减轻。
2.3 术后并发症 30例患者仅有3例(10.0%)为球囊扩张成形术1次成功,分别为T形管引流口段狭窄2例,胆道狭窄合并胆瘘1例。其余病例均出现再狭窄,需反复多次成形。2例肝内胆管和胆总管多发狭窄合并胆泥形成患者介入治疗失败,行二次行肝移植。1例虽经8次球囊扩张治疗,狭窄及胆泥仍无改善,遂于狭窄明显的肝总管内置入金属内支架。由于大量胆泥淤积造成支架堵塞,患者黄疸加重。再经2次冲洗引流后仍无改善,遂再次行肝移植(图4)(此为我院早期病例)。另1例经反复多次球囊扩张治疗后(6次)狭窄仍存在,黄疸无缓解,亦再次行肝移植。1例肝内胆管和胆总管多发狭窄患者,行球囊扩张治疗后出现肝内血肿,经保守治疗无效而再次行肝移植。另外,16例患者(53.3%)内外引流管曾引流出肠液。
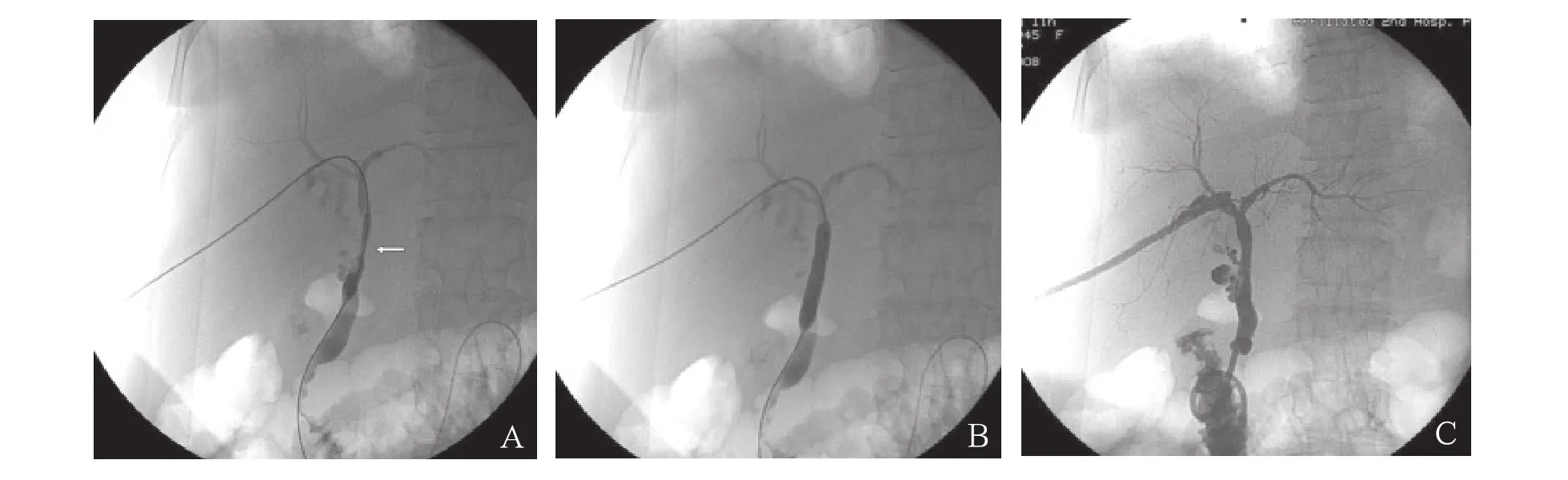
图1 患者女性,65岁,肝移植术后2个月,黑便1个月,复查发现贫血、肝功能异常2周。A、B.经皮肝穿刺胆道造影显示单纯吻合口狭窄(←),行球囊扩张术。C.置入引流管造影显示胆道形态正常。20d后夹闭引流管,40d后复查胆红素和转氨酶降至正常,临床症状和体征消失,遂拔出引流管
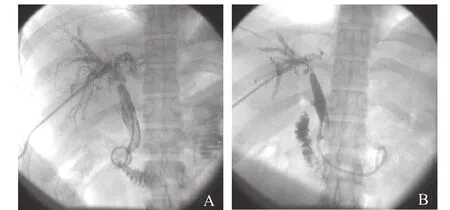
图2 患者男性,24岁,肝移植术后4年余,发现皮肤黄染、肝功能异常1周。A.经皮肝穿刺胆道造影显示吻合口狭窄,可见肝内外胆管大量充盈缺损(胆泥生成),肝内胆管扩张。B.反复冲洗引流7个月后复查,胆泥消失,肝内胆管扩张程度明显减轻
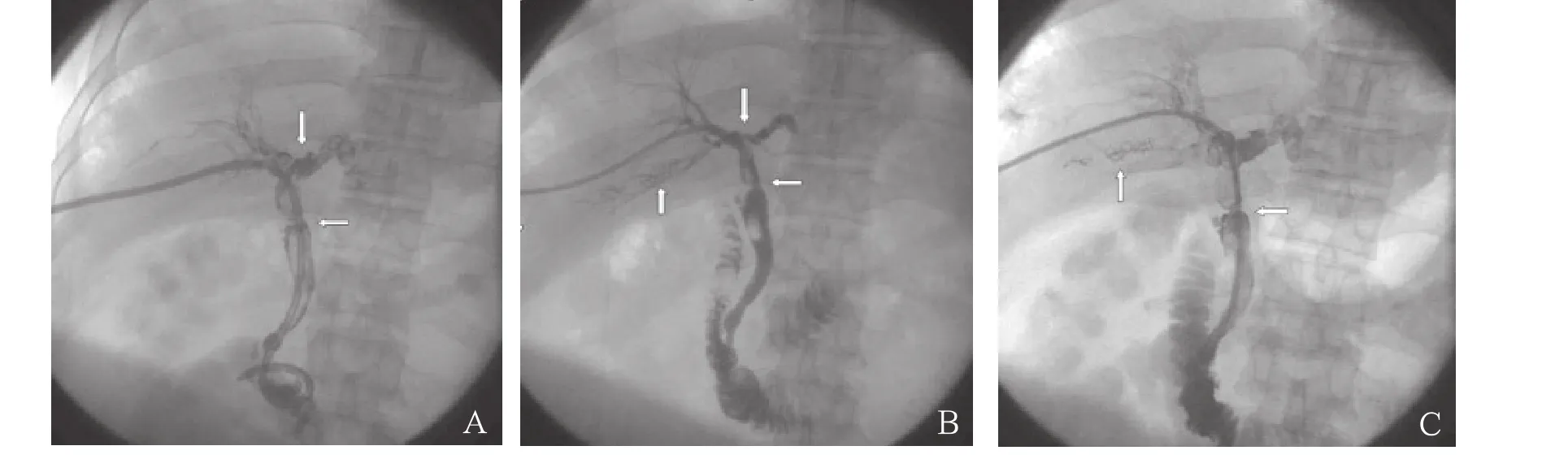
图3 患者男性,59岁,肝移植术后4年余,复查肝功能异常40d。A.PTCD后经引流管造影显示左右肝管汇合部狭窄(↓),胆总管吻合口处狭窄(←),肝内胆管明显扩张,其内见大量充盈缺损影(胆泥形成)。B.由于穿刺位置较低,造成“穿糖葫芦”,沿引流管出血,钢圈(↑)封堵引流道成功后再次穿刺行PTCD。C.每日2次缓慢冲洗胆道,10d后复查造影,显示胆管内胆泥基本消失,左侧肝内胆管仅轻微扩张

图4 患者女性,54岁,肝移植术后2个月余,术后黄疸指数下降不明显。胆管造影显示:A.近段胆总管非吻合口狭窄,肝内胆管不规则扩张,肝内胆管大量充盈缺损(胆泥)形成。B.反复球囊扩张及胆道冲洗后,造影显示肝内胆管扩张及胆泥无明显好转。C.胆道支架(←)置入后造影显示肝总管狭窄消失,肝内胆管扩张较前有所好转,肝内胆管充盈缺损明显减少。同时保留引流管于胆管内以便引流、冲洗。D.支架置入1个月后复查:右肝管扩张明显减轻,左肝管仍扩张,内有充盈缺损(↓)。肝总管支架处大量充盈缺损(←)
3 讨论
3.1 经PTC途径介入的效果及安全性 肝移植术后胆道狭窄可分为吻合口狭窄和非吻合口狭窄。如不及时处理会影响术后存活率,甚至造成肝移植失败。Roumilhac等[6]报道,球囊扩张和内支架治疗发生于3个月以内的吻合口狭窄,1年有效率达71.0%,2年有效率为61.2%,病死率只有1.5%~6.5%。本组30例采用单纯球囊扩张治疗,仅1例联合放置支架,13例(43.3%)治愈,14例(46.7%)好转。对单纯吻合口狭窄、肝内胆管和胆总管多发狭窄,反复多次球囊扩张介入治疗可达到比较满意的疗效。尤其对于单纯吻合口狭窄和胆总管狭窄的患者,1~3次球囊扩张就可以基本纠正狭窄。即使伴有胆瘘,这种介入治疗也有不错的临床疗效。肝内胆管和胆总管多发狭窄合并胆泥形成治疗上比较棘手。主要因为尽管进行了球囊扩张,由于狭窄未完全纠正,胆泥可以在数日内再次淤积。本研究采用反复球囊扩张治疗后,双侧肝管同时用粗引流管(≥10F)引流。引流管本身起到支撑作用,可有效治疗狭窄。但是对于肝移植术后近期的、引流管能过去的狭窄则暂不进行球囊扩张,保持引流通畅即可。本组病例确诊发生狭窄的时间较晚(肝移植术后96d至5年4个月),因此全部行球囊扩张。
介入治疗后进行有效的胆道引流、盐水冲洗等对防止胆泥形成及预后也有较大的影响。本研究采用地塞米松10mg加入100ml生理盐水缓慢冲洗胆道,每日2次。冲洗过程中观察到大量絮状物和胆泥随冲洗液排出,同时加用消炎利胆片以增加胆汁分泌量。口服鹅脱氧胆酸可使约40%的胆泥被溶解[4]。
3.2 术中出血及预防 移植肝胆管壁增厚、变硬,目前认为与胆道缺血、慢性排斥反应、胆道感染、胆管炎及放置引流管的反复刺激等有关[3]。移植肝穿刺时常不易穿刺到胆管分支,而易穿刺到门静脉分支,尽管胆道有扩张,这与非移植肝行PTC的情况恰恰相反。
传统PTC方法腋中线入路为沿第8~9肋间进针,水平刺向第11或第12椎体右缘约2cm处,穿刺成功后分别交换微导丝、扩张管、导丝、外套管或导管、超硬导丝,再置入引流管。此方法穿刺易成功,但由于肝门部门静脉与肝管并行,可能会损伤门静脉。穿刺针外套管较细,出血量不多且血液遇胆汁后凝固,不会造成危险。若沿此道进引流管,则可能会发生大出血及肝内胆管内大量血块形成。图3所示为放置引流管后大量出血,在钢圈成功封堵引流道后,再次穿刺外周胆管行PTCD。若穿向胆管分支,穿刺难度加大,而且移植肝脆弱、耐受性差,尽管现在常用的为22G无创针,也应减少穿刺次数。本研究的经验是先按传统方法穿刺,成功后注入造影剂,至外周胆管显影,再穿刺外周2、3级胆管实施PTCD术。这样既避免了穿刺次数过多对移植肝造成的损害,又保证了安全性。能在X线透视和超声双重引导下穿刺,是最佳的选择。
本组另1例球囊扩张后出现肝内血肿,是由于胆管狭窄处极其坚硬,为使其扩张成形,使用压力较大,致使破裂出血。因此,扩张胆管时需注意压力,控制扩张程度。笔者认为球囊扩张胆管时间以5min合适,时间长,患者难以忍受;时间短,效果不明显。
3.3 胆道支架置入 本组早期1例曾置入金属内支架治疗,支架内很快出现再狭窄,后虽反复多次行球囊扩张治疗,疗效不佳,黄疸无明显缓解,只能再次行肝移植。肝移植患者预期生存期可能较长,多数是良性病变,即使因肝癌行肝移植者,理论上也认为肝移植可以达到治愈的效果。胆道支架放置后常发生严重的慢性炎症反应和广泛的黏膜破坏等改变,造成管壁明显增厚,而且大量脱落的上皮组织和胆泥附挂于支架内。胆道支架内再堵塞处理起来很困难,也增加了患者的经济负担。而狭窄病变的球囊扩张和引流管引流可以很好地解决梗阻性黄疸,并且可重复治疗,费用低廉,所以不主张使用胆道支架。
[1]黄志强. 胆道的解剖生理学与肝移植后胆道并发症. 中华外科杂志, 2006, 44(5): 289-291.
[2]Lee SH, Ryu JK, Woo SM, et al. Optimal interventional treatment and long-term outcomes for biliary stricture after liver transplantation. Clin Transplant, 2008, 22(4): 484-493.
[3]Weber A, Prinz C, Gerngross C, et al. Long-term outcome of endoscopic and/or percutaneous transhepatic therapy in patients with biliary stricture after orthotopic liver transplantation. J Gastroenterol, 2009, 44(12): 1195-1202.
[4]朱楠, 杨宁. 肝移植术后胆道并发症的病因与防治进展.中华器官移植杂志, 2006, 27(12): 765-767.
[5]丁绍省, 梁峰, 叶叔文, 等. 肝移植术后并发症的影像学评价. 中国医学影像学杂志, 2006, 14(2): 94-97.
[6]Roumilhac D, Poyet G, Sergent G, et al. Long-term results of percutaneous management for anastomotic biliary stricture after orthotopic liver transplantation. Liver Transpl, 2003, 9(4): 394-400.

