姜黄素对脓毒症大鼠器官的保护作用
李晶菁,沈雁波
(南通大学附属医院急诊科,江苏 南通 226001)
脓毒症是各种严重创伤、烧伤、缺氧、再灌注损伤及外科大手术常见并发症[1]。据统计,美国每年约有75万人发生脓毒症休克,病死率达50%以上[2]。脓毒症是由感染因素引起的全身炎症反应综合征(SIRS),是一个涉及大量局部和全身性反应的复杂病理过程,其病程较凶险,一旦演变为脓毒性休克或多器官功能障碍综合征(MODS)则治疗困难,预后恶劣[3]。急性肝损伤作为脓毒症的常见并发症,对于判断脓毒症病情及预后具有重要意义。目前尚缺乏特效药物治疗脓毒症,这也是国内外的研究热点。姜黄素(curcumin)是从姜科植物的根茎中提取的一种天然化合物,具有抗炎、抗氧化、抗肿瘤、抑菌等多种药理活性。姜黄素是否在脓毒症急性肝损伤中有保护作用及其机制如何,相关报道尚不多见。本实验通过姜黄素干预脓毒症大鼠并测定肝功能、抗氧化能力等表达变化,探讨姜黄素脓毒症急性肝损伤保护作用,以期为临床防治脓毒症提供理论依据。
1 材料与方法
1.1 动物模型的建立
采用盲肠结扎穿孔法(CLP法)制模,CLP模型的标准步骤主要参考Rittirsch等[4]的报道。
72只健康雄性SD大鼠,清洁级,体重(260±20)g,由南通大学实验动物中心提供。随机平分为3组,即对照组、实验组、干预组,每组各24只,3组按术后6、12、24、48h时间点分成不同亚组。实验组、干预组在以3%的戊巴比妥钠(45mg/kg)腹腔注入麻醉后,采用CLP法建立脓毒症模型,对照组为假手术组,以同样方法开腹,但盲肠不结扎也不穿孔。干预组在CLP术后1h按100mg/kg剂量腹腔内注射姜黄素,实验组、假手术组予以等量生理盐水。
1.2 标本采集
分别于制模后6、12、24、48将72只大鼠麻醉(方法同前),打开胸腹腔,心脏采血,分离肝脏组织,一部分液氮冻存,检测总抗氧化能力(T-AOC)、谷胱甘肽过氧化酶(GPx);另外一部分10%中性甲醛固定,石蜡包埋、切片,行苏木精-伊红(HE)染色,在光学显微镜下观察组织学改变。
1.3 组织匀浆制备
制备10%组织匀浆:取组织块0.2~1g在冰冷生理盐水中漂洗,滤纸拭干,称重,放入小烧杯内,移取组织块9倍的0.86%的冰冷生理盐水2/3于烧杯内,剪碎组织块,组织倒入匀浆管中,再将剩余的1/3冰冷生理盐水冲洗残留在烧杯中的碎组织块一起倒入匀浆管,充分匀浆6~8min。将制备好的匀浆用离心机2000r/min离心15min,离心半径13.5cm,留上清去沉淀,-80℃冰箱保存。
1.4 各项指标检测
1.4.1 丙氨酸氨基转移酶(ALT)采血、分离血清,全自动生化仪测定ALT。
1.4.2 T-AOC 用南京建成生物工程研究所提供T-AOC测定盒,采用化学比色法检测T-AOC。
1.4.3 GPx 用南京建成生物工程研究所提供GPx测定盒,采用化学比色法检测GPx。
1.5 统计学方法
所有计量数据采用均数±标准差表示,数据分析的统计学方法为具有一个重复测量因素的两因素方差分析,分析软件采用STATA V10.0软件包,以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠不同时相ALT比较
实验组ALT随时间的变化而逐渐增高,实验组与对照组ALT在各个时间段的差异有统计学意义(χ2=3981.54,P=0.0000)。两者在6h比较,Z=7.18,P=0.000;两者在12h比较,Z=34.27,P=0.000;两者在24h比较,Z=11.96,P=0.000;两者在48h比较,Z=3.08,P=0.002。干预组ALT随时间亦有增高趋势,但增高幅度较实验组小,干预组与实验组ALT在各个时间段的差异有统计学意义(χ2=2430.56,P=0.000)。两 者 在 6h 比 较,Z=-4.85,P=0.000;两者在12h比较,Z=-20.15,P=0.000;两者在24h比较,Z=-4.63,P=0.000;两者在48h比较,Z=0.44,P=0.660。干预组与对照组ALT在各个时间段的差异均无统计学意义(P>0.05),详见表1。
表1 各组大鼠不同时相ALT的比较(mmol/l,±s)Tab.1 The comparison of ALT of the rats in different time points(mmol/l,±s)
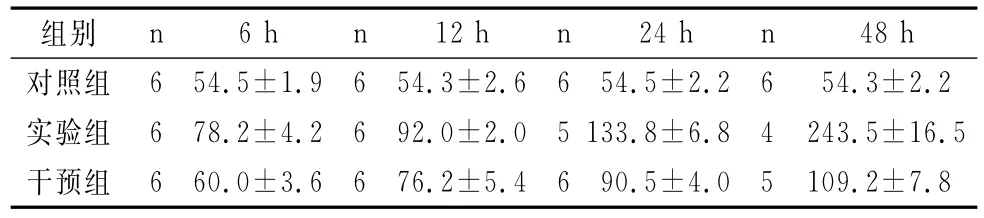
表1 各组大鼠不同时相ALT的比较(mmol/l,±s)Tab.1 The comparison of ALT of the rats in different time points(mmol/l,±s)
?
2.2 各组大鼠不同时相T-AOC比较
实验组T-AOC先升高后降低,其趋势与干预组相仿,但T-AOC较干预组及对照组低。实验组与对照组T-AOC在各个时间段的差异有统计学意义(χ2=1919.07,P=0.0000)。两者在6h比较,Z=-26.84,P=0.000;两者在12h比较,Z=0.77,P=0.438;两者在24h比较,Z=4.07,P=0.000;两者在48h比较,Z=9.75,P=0.000。干预组与实验组T-AOC在各个时间段的差异有统计学意义(χ2=683.89,P=0.0000)。两者在6h比较,Z=8.13,P=0.000;两者在12h比较,Z=-0.478,P=0.000;两者在24h比较,Z=-2.30,P=0.021;两者在48h比较,Z=0.66,P=0.508。详见表2。
表2 各组大鼠不同时相T-AOC的比较(U/ml,±s)Tab.2 The comparison of T-AOC of the rats in different time points(U/ml,±s)

表2 各组大鼠不同时相T-AOC的比较(U/ml,±s)Tab.2 The comparison of T-AOC of the rats in different time points(U/ml,±s)
?
2.3 各组大鼠不同时相GPx比较
实验组随时间的变化GPx逐渐升高,而干预组先升高后下降,实验组GPx较干预及对照组低。实验组与对照组GPx在各个时间段的差异有统计学意义(χ2=2119.12,P=0.0000)。两者在6h比较,Z=-29.88,P=0.000;两者在12 h比较,Z=10.93,P=0.000;两者在24h比较,Z=7.61,P=0.000;两者在48h比较,Z=4.08,P=0.000。干预组与实验组GPx在各个时间段的差异有统计学意义(χ2=1014.63,P=0.0000)。两者在6h比较,Z=6.30,P=0.000;两者在12h比较,Z=-5.36,P=0.000;两者在24h比较,Z=6.13,P=0.000;两者在48h比较,Z=2.04,P=0.041。详见表3。
表3 各组大鼠不同时相GPx的比较(活力单位,±s)Tab.3 The comparison of GPx of the rats in different time points(active unite,±s)
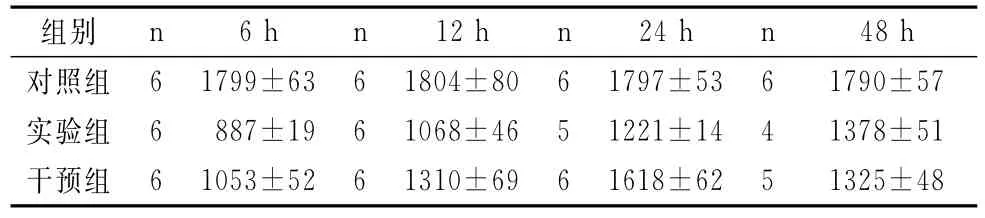
表3 各组大鼠不同时相GPx的比较(活力单位,±s)Tab.3 The comparison of GPx of the rats in different time points(active unite,±s)
?
2.4 肝脏病理改变
光学显微镜下,对照组各时间点无明显变化,实验组6h镜下见肝细胞水肿、肝血窦充血、炎症细胞浸润,6h后随时间的延长,呈进行性加重,肝组织大量炎症细胞浸润,细胞变性,结构紊乱,干预组内组织水肿、充血、炎细胞浸润及组织结构紊乱等表现较实验组减轻。取各组12h点病理切片进行比较(图1~3)。
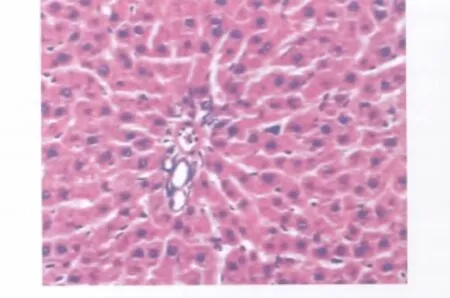
图1 对照组12h肝脏病理切片。光镜下见肝组织结构基本正常,肝细胞排列整齐,肝窦内无明显炎性细胞浸润。HE染色,×100Fig.1 The liver tissue section of control group 12hours afrer mold.The basic structure of liver tissue is normal,liver cells is arranged in neat rows and sinusoidal has no obvious infiltration of inflammatory cells under the light microscope.HE staining,×100
3 讨论
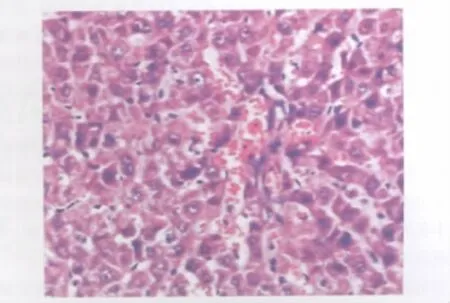
图2 实验组12h肝脏病理切片。光镜下见肝细胞肿胀、肝窦内充血、炎症细胞浸润。HE染色,×100Fig.2 The liver tissue section of experimental group 12hours ofter mold.The liver cells is swelling,sinusoidal has obvious infiltration of inflammatory cells and blood cells under the light microscope.HE staining,×100
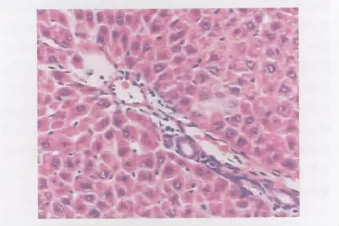
图3 干预组12h肝脏病理切片。光镜下见肝细胞肿胀、肝窦内充血、炎症细胞浸润,但较实验组轻。HE染色,×100Fig.3 The liver tissue section of intervention group 12hours after mold.The liver cells are swelling,sinusoidal has obvious infiltration of inflammatory cells and blood cells under the light microscope but the changs are better than experimental group.HE staining,×100
CLP法是脓毒症研究动物模型的“金标准”,CLP模型不仅易于标准化,还可以引入多种不同变量,因此在实验室被广泛应用,其原理是腹腔内感染形成腹膜炎,多重病原体感染导致SIRS、脓毒症、脓毒症休克甚至死亡。脓毒症是由感染因素引起的SIRS,是各种严重创伤、烧伤、缺氧、再灌注损伤及外科大手术常见并发症,也是引起脓毒性休克和多脏器功能障碍综合症的重要原因,它多伴有显著的氧化应激并与器官损伤和死亡率相关[5,6]。氧化应激是由氧化性化学物质的释放超过机体抗氧化系统防御能力所引起的一种状态,T-AOC和GPx反映机体抗氧化能力;T-AOC的高低可以反映机体清除氧自由基的能力;GPx是机体内广泛存在的一种重要的催化过氧化物分解的酶,它特异的催化还原性谷胱甘肽(GSH)对过氧化物的还原反应,可以起到保护细胞膜结构和功能完整的作用。近年的研究表明氧化应激能够损伤肝细胞,是一种重要病理生理过程,因此通过加强机体抗炎抗氧化作用改善脓毒症预后,不失为脓毒症治疗的一条有效途径[7,8]。姜黄素是从姜科植物的根茎中提取的一种天然化合物,具有抗炎、抗氧化、清除自由基、抗肿瘤、抑菌等多种药理活性。姜黄素是一个由两个酚羟基,两个不饱和酮双键,一个β-二酮和一个中性活性亚甲基组成的对称分子结构,其中酚羟基和β-二酮是其抗氧化活性部位[9]。目前研究发现姜黄素可通过提供质子直接清除氧自由基,还可抑制活性氧族/活 性 氮 族 (reactive oxygen species/reactive nitrogene species,ROS/RNS)的产生,诱导抗氧化酶表达或增强其活性[10]。Sompamit等研究表明,姜黄素可通过降低内毒素血症小鼠心血管组织中的氧化应激,改善血管功能并保持血流动力学稳定性[11]。亦有报道姜黄素能增加机体血液和组织中各种抗氧化物酶的活性如GPx、过氧化氢酶等的活性,总抗氧化能力提高,从而清除自由基,减轻氧化应激反应[12]。目前脓毒症居高不下,且缺乏有效的治疗措施,特别是中成药的治疗,相关报道尚不多见,本实验旨在探讨姜黄素通过抗炎、抗氧化作用对脓毒症急性肝损伤的保护作用,从而为其治疗脓毒症提供依据,为临床提供新方法。本实验中随着肝功能的恶化,T-AOC、GPx的变化,在姜黄素的干预下机体的抗氧化能力明显提高,预后改善,从而证明姜黄素在脓毒症中具有提高机体抗氧化能力,对脓毒症具有治疗作用。实验还表明通过提高机体的抗氧化能力,可以增加脓毒症的疗效,从而为居高不下的脓毒症提供新的治疗措施,改善预后。但由于实验中观察样本量小,观察指标设定较少,且姜黄素的用药剂量主要参考相关文献,而对于最佳治疗剂量未进一步确定,此外不同给药时间、单次给药与多次或连续给药方式的治疗作用有无差别尚需进一步研究,还有待进一步实验的论证及实践的检验。针对脓毒症的单一治疗都没取得预期的效果,而中西医结合治疗对于提高脓毒症治疗效果具有重要意义,将为攻克脓毒症防治难题开启新的途径。
[1]盛志勇,姚咏明.近年来国内有关创伤后脓毒症研究的一些进展.中国工程院医药卫生工程学部2002年医学科学前沿“炎症与修复”高级学术研讨会、第三届全国创伤修复(愈合)与组织再生学术交流会,广州,2002.1-8.
[2]李春盛.关于脓毒症的几个问题[J].中国危重病急救医学,2002,14:323-328.
[3]姚咏明,盛志勇.脓毒症研究的若干新动态[J].中国危重病急救学,2000,12:323-325.
[4]Rittirsch D,Huber-Lang MS,Flier MA,et al.Immunodesign of experimental sepsis by cecal ligation and puncture.Nat Protoc,2009,4(1):31-36.
[5]Ritter C,Andrades M,Frota Júnior ML,et al.Oxidative parameters and mortality in sepsis induced by cecal ligation and perforation[J].Intensive Care Med,2003,29(10):1782-1789.
[6]Ward PA.Oxidative stress:acute and progressive lung injury[J].Ann N Y Acad Sci,2010,1203:53-59.
[7]Matsuzawa-Nagata N,Takamura T,Ando H,et al.Increased oxidative stress precedes the onset of high-fat diet-induced insulin resistance and obesity[J].Metabolism,2008,57(8):1071-1077.
[8]Sakaguchi S,Furusawa S.Oxidative stress and septic shock:metabolic aspects of oxygen-derived free radicals generated in the liver during endotoxemia[J].FEMS Immunol Med Microbiol,2006,47(2):167-177.
[9]薛海鹏,李湘洲,旷春桃,等.姜黄素的抗氧化机制及以其为先导物的抗氧化化合物研究进展[J].食品科学,2010,31(7):302-307.
[10]于冬青,邓华聪.姜黄素的药理作用研究[J].山东医药,2005,45(2):72-73.
[11]Sompamit K,Kukongviriyapan U,Nakmareong S,et al.Curcumin improves vascular function and alleviates oxidative stress in non-lethal lipopolysaccharide-induced endotoxaemia in mice[J].Eur J Pharmacol,2009,616(1-3):192-199.
[12]Okada K,Wangpoengtrakul C,Tanaka T,et al.Curcumin and especially tetrahydrocurcumin ameliorate oxidative stressinduced renal injury in mice[J].J Nutr,2001,131(8):2090-2095.