MR乳腺容积成像技术诊断乳腺肿块性病变的价值研究
张丽娜,王绍武,苗延巍,宋清伟,徐 斌
(大连医科大学 附属第一医院 放射科,辽宁 大连 116011)
传统的乳腺动态增强方法多为单侧乳腺矢状面或双侧横断面检查,不能兼顾乳腺动态增强检查的三要素即高信噪比、高空间和时间分辨率[1,2]。近年来针对乳腺MR快速动态增强新开发的乳腺容积成像(Volume Imaging for Breast Assessment, VIBRANT)技术可以弥补上述不足,实现双侧乳腺同时矢状面成像,其临床应用潜力很大。根据2003年美国放射学会(ACR)提出的乳腺影像报告和数据系统(BI-RADS)[3]的分类标准,乳腺病变可以分为肿块、非肿块及点状病灶三类。本文通过采用优化MR乳腺扫描序列,研究寻找针对MRI上强化形态表现为肿块的病变鉴别诊断的定性、定量参数,旨在评价MR VIBRANT技术对乳腺肿块性病变的诊断价值。
1 资料与方法
1.1 研究对象
收集2007年1月~2011年1月在大连医科大学附属第一医院行MR检查并表现为肿块型强化形态的女性患者52例,年龄22~70岁,中位年龄47.5岁。其中,31例为绝经期妇女,21例MRI检查时间为月经来潮后9~11 d。52例均经手术或穿刺病理证实。其中,乳腺恶性病变共21例23灶,浸润性导管癌15灶(2例多中心灶),浸润性小叶癌5灶(1例多中心3灶),粘液癌2灶,导管内乳头状癌1灶;良性病变31例共34灶,乳腺纤维囊性改变9灶,纤维腺瘤16灶,腺病4灶,导管内乳头状瘤3灶,乳腺炎2灶。所有患者MR检查前均签署知情同意书。本研究的设计和方法经医学伦理委员会审核通过。
1.2 MRI检查方法
采用GE Signa EXCITE 1.5T超导MR仪,8通道乳腺专用相控阵线圈。检查时患者取俯卧位,双侧乳腺自然悬垂于乳腺线圈凹形孔内,行双侧乳腺同时扫描。平扫采用横断面、矢状面脂肪抑制SPGR序列T1WI和FSE序列T2WI。成像参数:SPGR T1W1:TR 155~200 ms,TE 1.6~3.8 ms,FA 80°,NEX 1。层厚3~4 mm,层间距1 mm,层数根据病变大小而定,FOV 32 cm×32 cm~36 cm×36 cm。动态增强扫描采用GE公司的软件技术VIBRANT行双侧乳腺多时相矢状面3D-FSPGR序列成像。成像参数:TR 3 ms,TE 1.2 ms,TI 7 ms,FA 10°,层厚2.6 mm,层间距1 mm,NEX 1,矩阵448×350。动态增强扫描采用肘正中静脉建立通道,经静脉注射顺磁性对比剂Gd-DTPA,用量0.1 mmol/kg,流速2 mL/s。设定8个FSPGR扫描序列,注药后25 s开始第1次采集,每次采集时间57 s,连续动态扫描时间约8 min。
1.3 图像分析与处理
利用ADW 4.4型图像工作站unctool功能软件进行图像分析。根据BI-RADS的标准,观察所有病例VIBRANT动态增强形态学表现,包括形态及边缘。绘制伪彩图,在病灶显示最大、强化最显著部位选定感兴趣区(ROI),面积稍小于病变范围(<10 mm2),获得时间-信号强度曲线(Time-signal Intensity Curves,TIC)。本组TIC归纳为四型。I型:呈缓慢持续上升(3~8时相之间信号强度升高>10%);II型:呈早期明显强化,中后期维持平台水平(3~8时相之间信号强度升高或降低在±10%之间);III型:早期明显强化,中后期信号强度明显降低(3~8时相之间信号强度降低>10%);IV型:无明显强化(峰值增强百分比≤10%)。半定量参数按照以下公式计算:①早期强化率(Ee)= (SIe-SIpre) ×100 %/ SIpre;②信号增强比率(Signal Enhancement Ratio,SER)=(SImax-SIpre)/(SIwash out-SIpre),其中SIpre为增强前的信号值;SIe为增强后第2个序列即114 s的信号值;SImax为增强后TIC达最高峰值的信号值;SIwash out为第8个序列的信号值。
病变VIBRANT动态增强形态学表现、TIC类型由两名影像医师分别进行分析。
1.4 诊断方法及统计学方法
参考Fischer评分[4],将VIBRANT动态增强形态学表现中圆形、卵圆形、分叶状和边缘光滑定为0分,不规则形、边缘不规则和毛刺定为1分;TIC类型中I型或IV型为0分,II型为1分,III型为2分。形态(0,1)+TIC类型(0,1,2)≥2分诊断为恶性,<2分诊断为良性。
采用SPSS16.0软件进行统计学分析,TIC类型比较应用χ2检验,乳腺病变良恶性间半定量参数应用t检验,P<0.01为差异有统计学意义。利用将差异有显著性意义的半定量参数值判断为恶性定为1分,判断为良性定为0分。
结合VIBRANT动态增强形态学表现、TIC类型和半定量参数值判断的良恶性结果,界定总积分≥3分诊断为恶性,<3分诊断为良性。见表1。
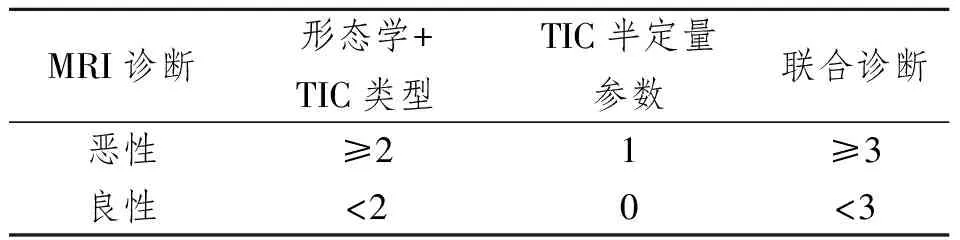
表1 联合VIBRANT动态增强MRI形态学和TIC表现对乳腺病变评分标准
2 结 果
2.1 52例良恶性乳腺病变的VIBRANT动态增强形态学表现
依据毛刺鉴别乳腺良恶性病变的敏感度56.5%(13/23),特异度97.1%(33/34);依据不规则形鉴别乳腺良恶性病变的敏感度78.2%(18/23),特异度82.3%(28/34)。见表2。
2.2 52例良恶性乳腺病变的TIC类型比较
恶性病变的TIC类型多为III型(60.9%),良性病变的TIC类型多为I型(55.9%)。见表3。
2.3 34灶良性和23灶恶性乳腺病变VIBRANT动态增强形态学和TIC类型综合诊断乳腺病变良恶性与病理结果对照分析

表2 52例乳腺良恶性病灶VIBRANT动态增强形态学表现

表3 52例乳腺良恶性病灶TIC类型统计表
通过对乳腺病变VIBRANT动态增强形态学和TIC类型综合的评分诊断乳腺病变的敏感度、特异度和阳性似然比、阴性似然比分别为86.96%(20/23)、85.29%(29/34)和5.913、0.153,诊断符合率为86.0%。见表4。
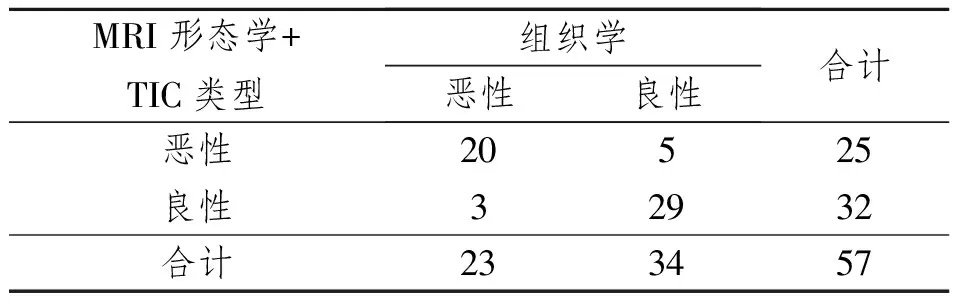
表4 乳腺病变VIBRANT动态增强形态学和TIC类型与病理结果对照分析
2.4 34灶良性和23灶恶性乳腺病变半定量强化参数比较
乳腺良恶性病变的早期强化率(Ee)差异无显著性意义(P>0.01),而信号增强比率(SER)差异有显著性意义(P<0.01),以恶性病变的95%CI上界作为SER的阈值,即1.33,见表5。34灶良性和23灶恶性乳腺病变SER诊断乳腺病变良恶性与病理结果对照发现SER诊断乳腺病变的敏感度、特异度和阳性似然比、阴性似然比分别为82.6%(19/23)、82.4%(28/34)和4.681、0.211,诊断符合率为82.5%。见表6。

表5 乳腺良恶性病变VIBRANT强化参数对比
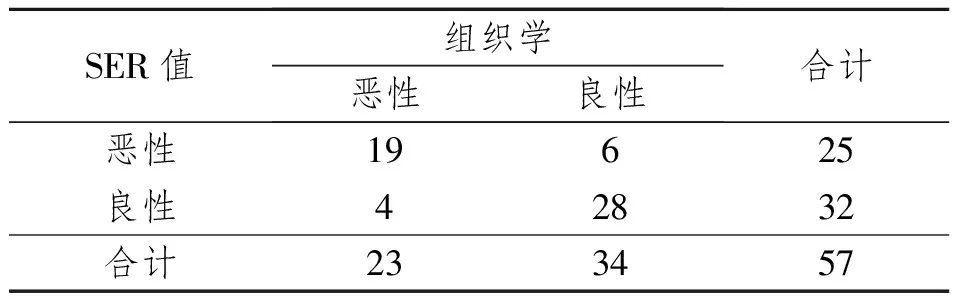
表6 乳腺病变SER值与病理结果对照分析
2.5 联合VIBRANT动态增强形态学、TIC的分型和半定量参数值诊断乳腺病变良恶性与病理结果对照分析
联合诊断乳腺病变良恶性的敏感度、特异度和阳性似然比、阴性似然比分别为91.3%(21/23)、88.2%(30/34)和7.761、0.099,诊断符合率为89.5%。见表7、图1、2。

表7 乳腺病变联合诊断与病理结果对照分析
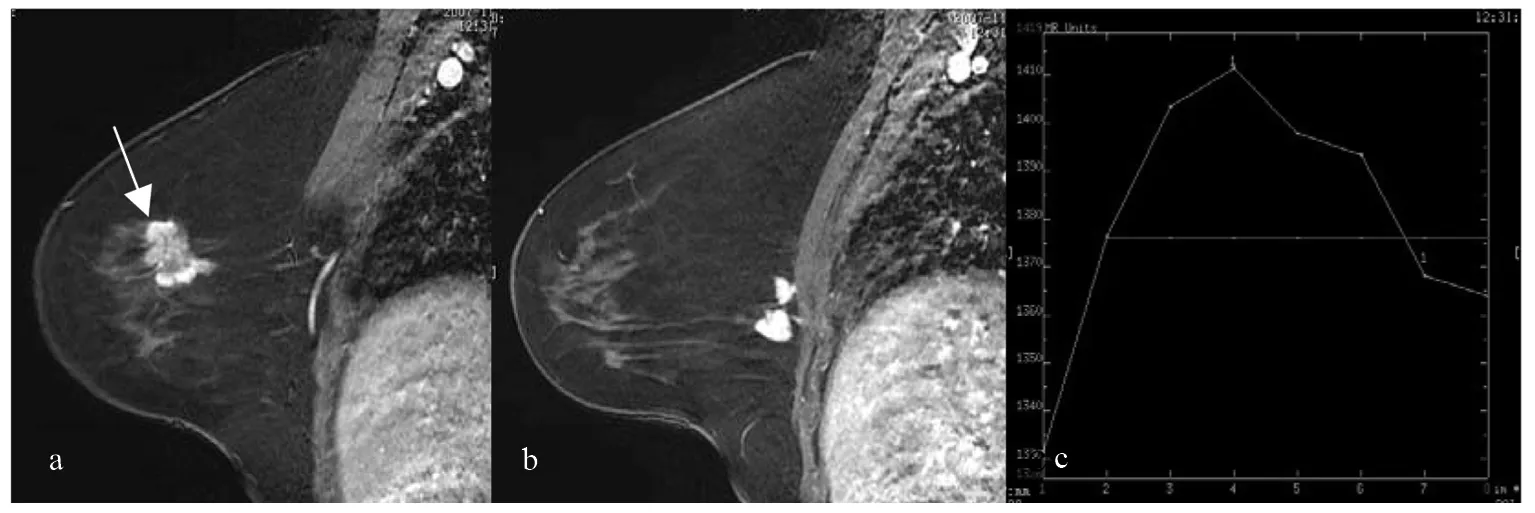
图1 多灶性浸润性导管癌
本组病例中联合诊断假阴性2例,1例病灶VIBRANT动态增强形态学和TIC类型综合判断良性、SER判断良性,联合判断良性病变,病理为浸润性导管癌(图3);1例病灶VIBRANT动态增强形态学和TIC类型综合判断良性、SER判断恶性,联合判断良性病变,病理为粘液癌。2例病灶VIBRANT动态增强形态学和TIC类型综合判断恶性、SER判断良性,联合判断良性病变,病理分别为纤维腺瘤和导管内乳头状瘤。
3 讨 论
目前,以能够反映病灶血流灌注、扩散及血管渗透等血流动力学情况为优势的乳腺动态增强MRI研究是乳腺疾病研究的热点之一,国内外报道较多[2,4-6]。传统的乳腺动态增强MRI检查除存在无法双侧乳腺同时大视野扫描、脂肪抑制不完全,从而影响对病变诊断外,特异性不高也是其难点[7]。作者采用乳腺动态增强的最新软件VIBRANT动态增强技术,寻找出特异性较高的诊断指标,以期更客观地评价VIBRANT技术在鉴别乳腺良恶性病变中的诊断价值。
3.1 乳腺VIBRANT动态增强技术
乳腺MR动态增强扫描对时间分辨率、空间分辨率及抑制脂肪的效果等方面都有很高的要求,目前关于时间和空间分辨率如何取舍尚无定论。Kuhl[8]等认为可以牺牲一定的时间分辨率而保证较高的空间分辨率,以利于病变形态的显示,建议采用矩阵400×512、每时相采集时间116 s的MRI增强序列。作者应用VIBRANT优化组合序列,与Kuhl建议的成像方式相比,在不降低空间分辨率的前提下,采用注药后10 s即刻开始扫描,每个时相采集时间更短(为57 s),采用分辨率较横断面更高的矢状面成像,连续采集8个时相,获得的52例患者乳腺脂肪抑制均满意,病变显示更清晰;获得的TIC更平滑,更接近病灶真实的动态增强表现,II、III型曲线形式在良恶性病变中出现的重叠率也较文献报道低[5,9]。
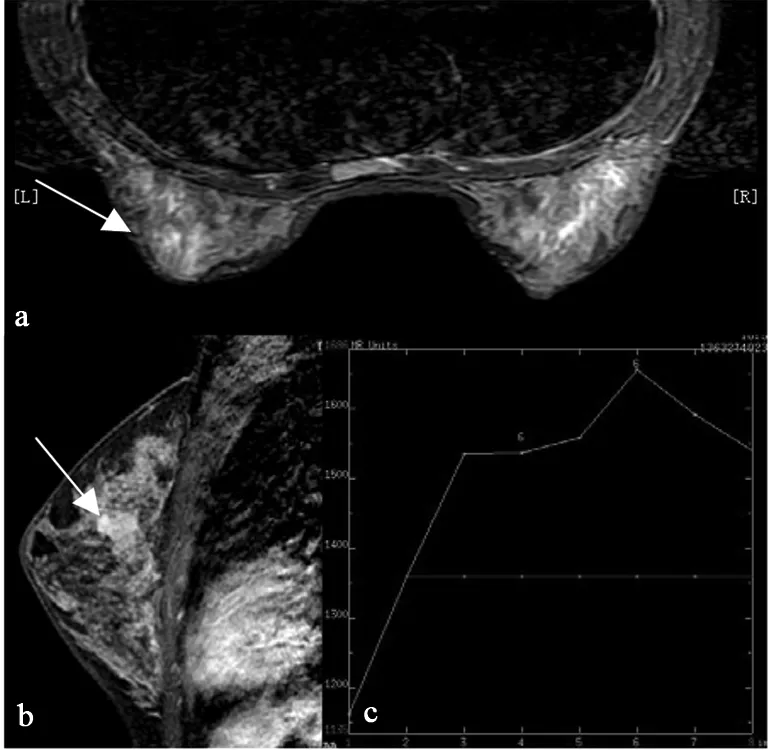
图2 左乳纤维腺瘤
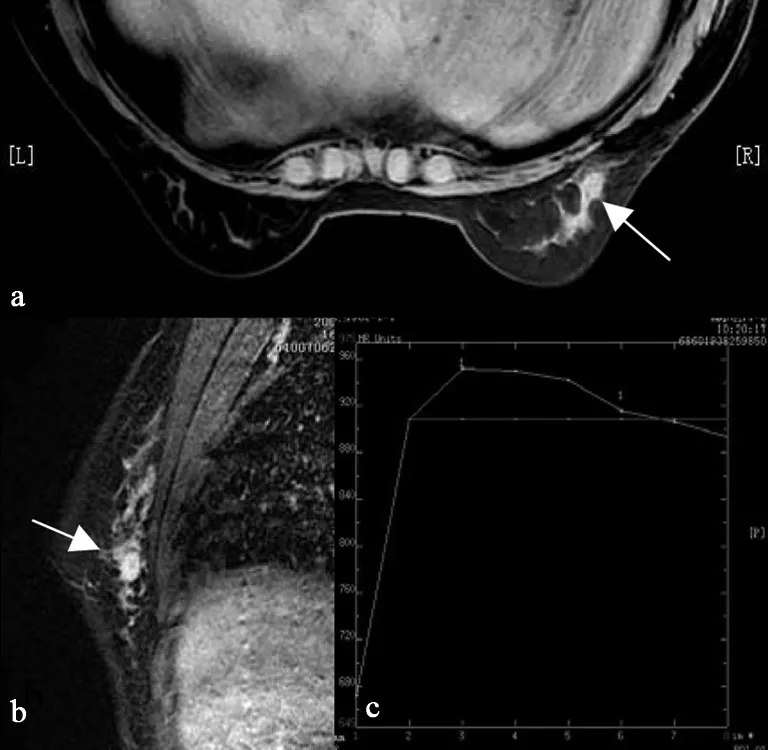
图3 右乳浸润性导管癌
3.2 VIBRANT动态增强MRI形态学改变对乳腺肿块性病变的鉴别诊断价值
以往的乳腺动态增强MRI研究表明,形态不规则或毛刺是恶性肿瘤的征象[10]。本组中利用形态不规则鉴别乳腺良恶性病变的敏感度较高,为78.2%(18/23),而利用边缘毛刺鉴别乳腺良恶性病变的特异度则明显高于其他形态学表现,为97.1%(33/34),良性病灶中仅1例导管内乳头状瘤出现毛刺征。本组结果表明,病灶的边缘毛刺是鉴别乳腺良恶性病变特异性较高的征象。恶性组中仅2例边缘光滑者病灶体积均较小,直径≤1 cm;良性组中边缘多表现为光滑,形态多为圆形、卵圆形或分叶状。良性组中2例乳腺炎病灶边缘均不规则,此时结合其他动态增强MRI征象及临床表现即可进行鉴别。
3.3 VIBRANT动态增强TIC类型对乳腺肿块性病变的鉴别诊断价值
目前,TIC类型对于乳腺病变的鉴别诊断价值各家报道的结论不一致[11-13]。作者通过对VIBRANT动态增强TIC中3~8时相之间信号强度的变化幅度大小将TIC分为四型,以期能够更准确地反映TIC的上升段、峰值点和下降段的不同特征。本组恶性病变TIC多为III型(60.9%),良性病变TIC多为I型(55.9%),但I、II型和III型在良、恶性病变中仍有部分重叠。1例导管内癌TIC为I型,分析其原因可能与其特殊的组织学表现有关。导管内癌属非浸润性癌,癌细胞对周围血管破坏相对较轻,病灶局部动静脉瘘相对不明显,造影剂进入间质的量多,经静脉流出的量少,从而使病灶的TIC呈持续上升型。良性组中8例(23.5%)TIC为II型,4例(11.8%)TIC为III型,表明良性病灶特别是乳头状瘤、乳腺炎也可以表现为血供丰富。作者认为,TIC类型在鉴别快速增强的乳腺良恶性肿块性病变方面仍需结合病灶形态学表现及临床特征综合判断,才不致造成诊断的偏差。
3.4 VIBRANT动态增强半定量强化参数对乳腺病变的鉴别诊断价值
早期强化率(Ee)是代表病灶对顺磁性对比剂的摄取过程的量化参数。周丽娟等[14]认为,早期强化率受肿瘤增强前的T1值、肿瘤的灌注、肿瘤间质和毛细血管通透性等多种因素影响。本组对绝经前期妇女MR检查时间为月经来潮后9~11 d,此时雌激素对乳腺的影响最小,也就排除了月经周期对早期强化率的影响;所选择的时间窗为增强后114 s,这也与文献中所取的早期强化率的2 min之内的时间窗接近[8,11]。本组早期强化率在良恶性乳腺病变中差异并无显著性意义,2例腺病及3例纤维腺瘤表现为早期的对比强化。笔者认为注入造影剂后组织MR信号强度的增加与组织的血管化程度有关,反映的是血管增生活动而并不一定提示为恶性。
信号增强比率(SER)是代表病灶对顺磁性对比剂的摄取和排泄两方面过程的量化参数,反映的是同一个体中病灶相对于正常组织微血管密度和渗透性水平,去除了不同个体间的脂肪含量、乳腺血供等差异性,能更接近真实的反映病灶的血供变化情况[15,16]。本组SER在良恶性乳腺病变中差异有显著性意义,SER以1.33为阈值诊断恶性的敏感度为82.6%(19/23),特异度为82.4%(28/34)。作者认为SER是乳腺病变鉴别诊断很有价值的线索,SER>1.33提示恶性病变的可能性大,该类病变应积极活检或手术切除。
3.5 VIBRANT动态增强形态学、TIC类型和半定量参数值联合应用的价值
本组研究发现,动态增强形态学、TIC类型和半定量参数值三项指标联合诊断乳腺良恶性病变的敏感度、特异度、阳性似然比和诊断符合率均高于单独诊断。1例多灶性浸润性导管癌呈不规则形,边缘毛刺,TIC类型为III型,SER为2.16(图1),病灶形态学和TIC类型综合判断恶性、SER值判断恶性,联合判断符合恶性病变。1例纤维腺瘤呈分叶形,边缘光滑,TIC类型为II型,SER为1.31(图2),病灶形态学和TIC类型综合判断良性,SER判断良性,联合判断符合良性病变。
VIBRANT技术克服了以往乳腺动态增强扫描的成像缺陷,对乳腺肿块性病变的诊断提供更有价值和更接近真实的信息。病灶边缘的毛刺征是VIBRANT动态增强鉴别乳腺良恶性肿块性病变特异性较高的征象;当病灶形态学、TIC类型可疑恶性时,SER能提供更有价值的信息。相信随着研究的深入,乳腺VIBRANT动态增强技术在乳腺病变诊断方面会发挥更大的优势。
参考文献:
[1] Hulka CA,Edmister WB,Smith BL,et al.Dynamic echo-planar imaging of the breast:experience in diagnosing breast carcinoma and correlation with tumor angiogenesis[J].Radiology,1997,205:837-842.
[2] Schelfout K,Van Goethem M,Kersschot E,et al.Contrast-enhanced MR imaging of breast lesions and effect on treatment[J].Eur J Surg Oncol,2004,30:501-507.
[3] American College of Radiology.Breast imaging reporting and data system atlas(BI-RADS atlas)[S].Am Coll Radiol,2003.1.
[4] Fischer U,KopkaL,GrabbeE.Breast carcinoma:effect of preoperative contrast enhanced MR imaging on the therapeutic approach[J].Radiology,1999,213:881-888.
[5] 欧阳翼,谢传淼,伍尧泮,等.动态增强MRI定量参数及最大线性斜率比值对鉴别乳腺良恶性疾病的价值[J].中华放射学杂志,2008,42:569-572.
[6] Medeiros LR, Duarte CS, Rosa DD,et al.Accuracy of magnetic resonance in suspicious breast lesions: a systematic quantitative review and meta-analysis[J].Breast Cancer Res Treat,2011,126:273-285.
[7] Schnall MD,Blume J,Bluemke DA,et al.Diagnostic architectural and dynamicfeatures at breast MR imaging:multicenter study[J].Radiology,2006,238:42-53.
[8] Kuhl CK,Schild HH,Morakkabati N.Dynamic bilateral contrast enhanced MR imaging of the breast:trade-off between spatial and temporal resolution[J].Radiology,2005,236:789-800.
[9] Leinsinger G,Schlossbauer T,Scherr M,et al.Cluster analysis of signal-intensity time course in dynamic breast MRI:does unsupervised vector quantization help to evaluate small mammographic lesions? [J].Eur Radiol,2006,16:1138-1146.
[10] Nagashima T,Suzuki M,Yagata H,et al.Dynamic-enhanced MRI predicts metastatic potential of invasive ductal breast cancer[J].Breast Cancer,2002,9:226-230.
[11] Narisada H,Aoki T, Sasaguri T,et al.Correlation between numeric gadolinium-enhanced dynamic MRI ratios and prognostic factors and histologic type of breast carcinoma[J].Am J Roentgenol,2006,187:297-306.
[12] Jansen SA,Fan X,Karczmar GS, et al.Differentiation between benign and malignant breast lesions detected by bilateral dynamic contrast-enhanced MRI: a sensitivity and specificity study[J]. Magn Reson Med,2008,59:747-754.
[13] Adluru G, Tasdizen T, Schabel MC, et al.Reconstruction of 3D dynamic contrast-enhanced magnetic resonance imaging using nonlocal means[J].J Magn Reson Imaging,2010,32:1217-1227.
[14] 周丽娟,陆之安,沈钧康,等.乳腺疾病的动态增强MRI研究[J].实用放射学杂志,2002,18:418-421.
[15] Veltman J,Stoutjesdijk M,Mann R,et al.Contrast-enhanced magnetic resonance imaging of the breast: the value of pharmacokinetic parameters derived from fast dynamic imaging during initial enhancement in classifying lesions[J].Eur Radiol,2008,18:1123-1133.
[16] Schouten van der Velden AP,Boetes C,Bult P,et al.Magnetic resonance imaging in size assessment of invasive breast carcinoma with an extensive intraductal component[J].BMC Med Imaging,2009,9:5-12.

