新生猪缺氧缺血性脑损伤早期DWI影像学研究
李洪杰,边 杰,沙 琳,孙 闯,孙传恕,刘书峰,翟方兵
(大连医科大学 附属第二医院 放射科,辽宁 大连 116027)
近年来弥散加权成像(diffusion weighted imaging,DWI)已在新生儿缺氧缺血性脑病(hypoxic-ischemic encephalopathy,HIE)的诊断中得到初步应用[1,2],但HIE早期DWI演变规律的研究尚未见报道。本研究通过对新生猪缺氧缺血性脑损伤(hypoxicschemic brain damage,HIBD)动物模型的DWI成像研究,探讨其早期DWI、表观弥散系数(apparent diffuse coefficient,ADC)图的影像特点及ADC值的变化规律,为HIE早期临床诊断及治疗转归提供影像学指导。
1 材料和方法
1.1 缺氧箱设置
用透明有机玻璃制作六面体密闭容器,顶壁设置1个工作窗,2个相对侧面部分别设置2个直径约0.8 cm小孔,分别为进气孔和出气孔。容器内放置20 mg的氧化钙,室温(25±3)℃。
1.2 动物模型的制作
选择日龄3 d健康的约克猪(由大连华侨种猪场提供),雌雄不限,体重1300~1500 g,随机分成对照组(假手术组)和实验组,每组8只。先将动物用3%的戊巴比妥钠(30 mg/Kg)腹腔注射麻醉,固定四肢、头部于实验台上,暴露颈部,医用碘酊消毒后,颈正中纵切口长约2.0 cm,分离双侧颈总动脉。实验组用4.0的外科手术线给予双侧颈总动脉永久结扎,用无菌2号外科手术线逐层缝合切口。然后将动物放入缺氧箱内,封闭工作窗,给予持续4%氧气和96%氮气的混合气体2 L/min(测氧仪:RS5100型 上海雷磁),持续30 min。对照组仅行假手术,不做双侧颈总动脉结扎及缺氧处理。
1.3 动物一般情况观察
记录两组实验动物呼吸情况、皮肤黏膜颜色的改变及神经系统症状等。
1.4 MRI检查
采用GE Signa 1.5T MR/磁共振扫描仪,正交头线圈。冠状位扫描,常规扫描序列包括T1加权像(T1WI)和T2加权像(T2WI)及T2 FLAIR。扫描参数:T1WI TR shortest,TE15 ms;T2WI TR shortest,TE 100 ms。3次采集,视野23 cm,矩阵256×256,层厚4 mm,扫描时间共约10 min。
扩散加权像(diffusion weighted imaging,DWI),冠状扫描,层厚4 mm,视野22 cm,TR shortest,TE 84 ms,3次采集,矩阵110×256,b值1000 s/mm2。DWI扫描结束后,图像资料传送到GE advantage workstation AW4.4工作站,用functool软件后处理得到相应ADC图并测量感兴趣区(Regions of interest,ROI)得到ADC值。选择每侧大脑白质区与侧脑室旁区及海马区的典型层面1~2层,于各采集时间点数据,实验组在ADC图上选取DWI明显高信号区域、对照组在相应层面随机选定同一部位的3个ROI进行测量,分别得到ADC值,并做均值得到最终ADC值。
1.5 统计学方法
采用社会科学统计软件包SPSS 16.0进行数据分析。各组数据均以mean±SD表示,采用重复测量方差分析及t检验方法,以P<0.05为差异有统计学意义。
2 结 果
2.1 新生猪缺氧缺血后的行为观察
实验组在缺氧10 min后即出现颜面部发紫、呼吸急促、烦躁不安、尖叫、四肢抽动;缺氧20 min后出现皮肤苍白、站立不稳、尾巴上翘;缺氧20~30 min呼吸逐渐变慢,出现叹息样呼吸、不能站立、竖尾、角弓反张,甚至死亡等改变。动物模型制作的成功率为62%(8/13)。实验动物缺氧缺血30 min后3~4 h内处于昏睡状态,4 h后动物逐渐苏醒,缺氧缺血后12 h动物完全清醒,并处于躁动状态。
2.2 MRI扫描结果
对照组在不同时间的脑常规MR图像及DWI图像均未见异常信号改变。实验组动物在缺氧缺血后1 h DWI图像额叶即可见高信号影,边界较模糊;3 h可见双侧额叶高信号区范围扩大,呈斑点状,双侧海马区可见点状、斑点状高信号影出现,边界模糊不清,双侧脑室周围可见点状高信号;6 h双侧海马区高信号范围进一步扩大,呈条片状;随着缺氧缺血时间的延长,12 h病灶区域进一步扩大,呈弥漫性高信号改变,边界模糊不清(图1)。
2.3 ADC图及ADC值变化
对照组在不同时间的ADC图上未见异常信号,实验组缺氧缺血后1 h可见点状低信号灶,3 h呈斑点状低信号灶,6 h呈片状低信号灶。随缺氧时间延长,12 h病灶呈弥漫性信号减低区(图2)。ADC值1 h内下降明显,随缺氧缺血时间延长,逐渐降低,3 h最低,6 h以后ADC值开始回升,12 h接近正常。表1为不同部位不同时间点的ADC值。
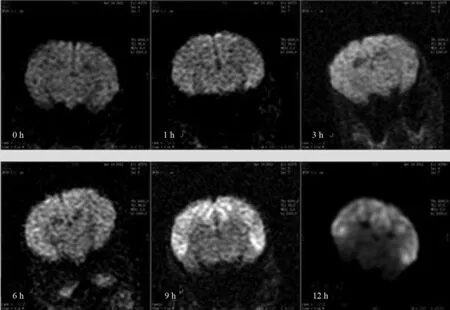
图1 HIBD后不同时间点脑冠状DWI图像
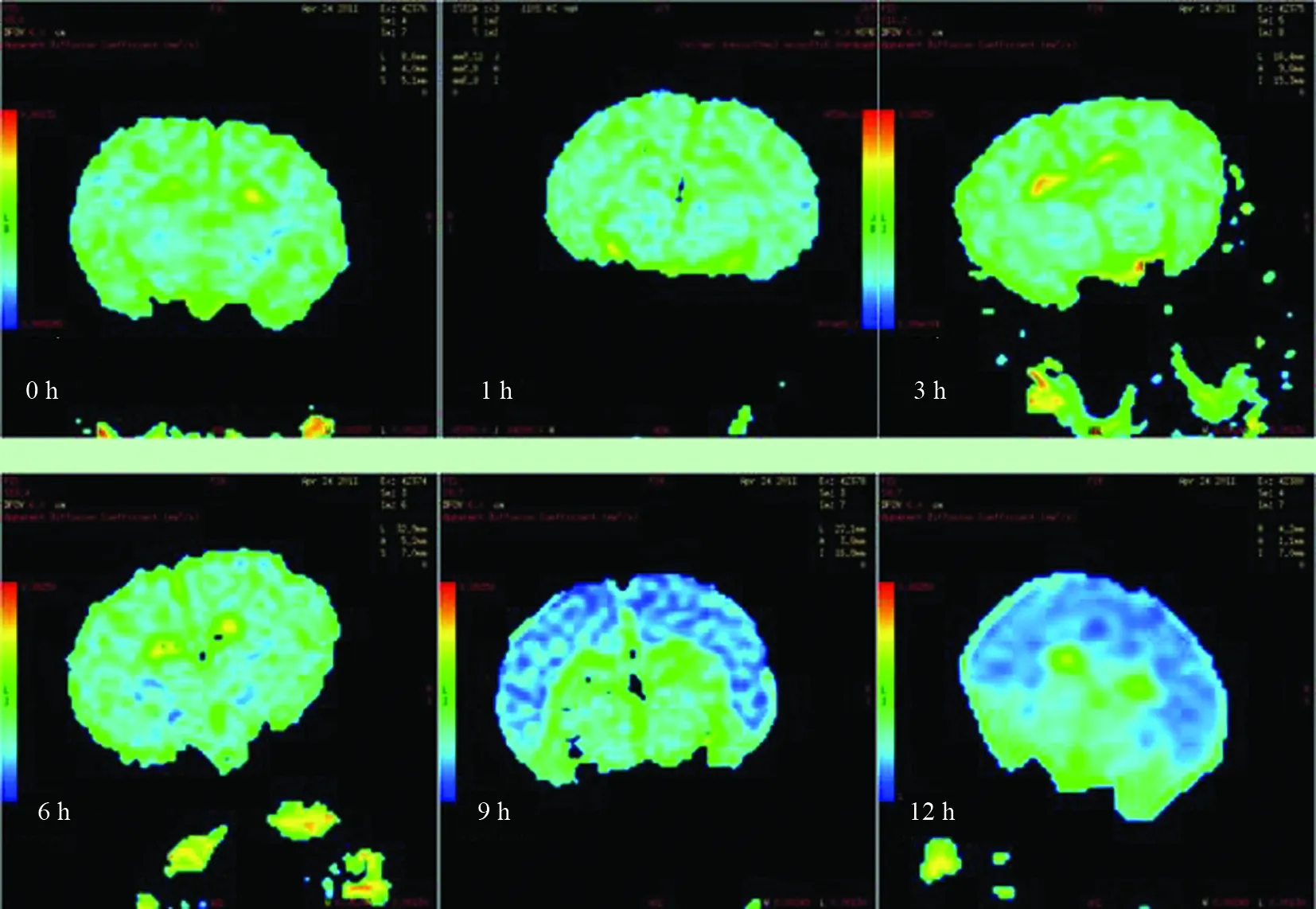
图2 HIBD后不同时间脑冠状ADC图
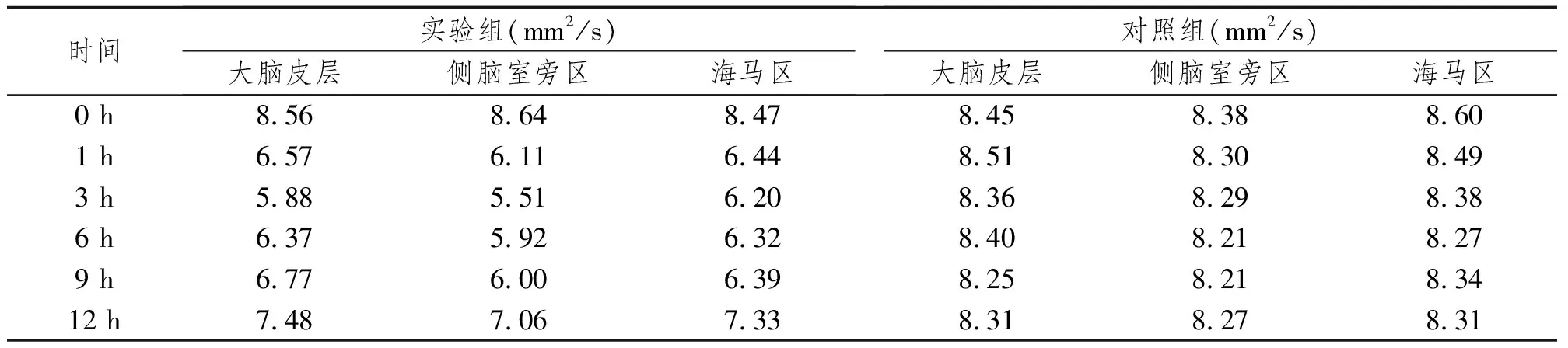
表1 对照组及实验组不同时间点大脑皮层、侧脑室旁区及海马区ADC值
由表1可得在1 h 、3 h、6 h、9 h及12 h 实验组及对照组ADC值差异均有显著性意义(P<0.05);实验组ADC值1 h内下降明显,3 h最低,6 h以后开始回升,12 h接近正常;对照组无变化趋势。
3 讨 论
磁共振弥散加权成像(diffusion weighted imaging,DWI)是目前在活体上进行水分子扩散测量与成像的唯一方法,可使疾病的影像研究深入到微观的分子水平[3,4]。在DWI上弥散快的结构信号衰减大,表现为低信号;弥散慢的结构信号衰减少,表现为高信号。应用DWI可以获得DWI图像和由ADC值重建的ADC图。细胞内、外水扩散的降低,ADC值就会降低,在DWI图像上表现为高信号。由于DWI图像含有T2加权图像成分,而高含水区T2加权信号也增高,因此对于体现水分子的扩散受限,ADC值的降低更准确些。在缺血缺氧性脑损伤的早期,细胞外液中的Na+、Ca2+和水流入细胞内,形成细胞毒性水肿,细胞肿胀同时会造成细胞外间隙变小即细胞外水分子减少。这时整个缺血区的含水量并没有增加,只是细胞内、外的含水量发生了变化。由于水分子在细胞内的Brown运动慢于细胞外,其在细胞内的表观弥散系数ADC值小于细胞外,使缺血区水分子整体Brown运动减低,ADC值变小,ADC图显示为低信号区,DWI显示为高信号区[5]。DWI能从分子水平上反映人体各组织中水分子的功能变化、可检测出与组织的含水量改变有关的形态学与病理生理学的早期改变[6]。本研究发现:在缺血缺氧后1~3 h内,即细胞内水肿期,ADC值下降明显,DWI图像上表现为高信号;3~6 h,随着脑水肿不断加重,ADC值下降较缓,DWI图像上表现为明显高信号,主要分布于大脑皮层区域、侧脑室旁区及海马区。此结果与 Kim等[7]人的研究结果相一致,提示DWI 、ADC值/图能够早期诊断缺氧缺血性脑水肿。
新生儿缺氧缺血性脑病(HIE)是新生儿期危害最大、最常见的疾病之一。由于其复杂的发病机制和病理生理过程,致使虽然目前国内外治疗HIE的方法繁多,但无公认、有效的措施。HIE早期临床表现缺乏特异性,常规MRI又很难早期发现病变,因此建立稳定可靠的实验动物模型,探讨DWI在缺氧缺血性脑病早期的影像变化特点,对早期HIE的临床诊断具有重要意义。由于新生猪有明显的脑沟、脑回,与人脑结构相近,而且在基因组序列和染色体结构上也有很高的同源性[8],因此,本研究以新生约克猪为动物模型,参照和改良Gregory A等[9,10]的研究,建立缺氧缺血动物模型。
脑水肿是脑细胞死亡的早期病理改变。近几年,国内外研究发现,缺氧缺血性脑损伤时,神经细胞的死亡是以凋亡为主。而凋亡是一个可逆的过程,若找到阻止或中断凋亡过程的干预因素,便可减轻神经细胞损伤,甚至可以避免细胞死亡。而DWI是目前在活体进行水分子扩散测量与成像的有效方法,被公认是诊断超早期缺血性脑梗死的可靠手段,其在揭示HIE微观病理生理学演变规律方面有明显优势。DWI不但探测早期脑缺血病灶敏感度高,更有意义的是经过适当的临床治疗后,DWI还能监测到原病灶的复原或消失,这对临床具有重要的指导作用。通过应用磁共振DWI技术,临床对HIE患儿早期做出准确的诊断,及早给予合理有效的治疗以减轻或控制脑水肿的发生,对促进受损神经细胞恢复、避免神经细胞死亡及减少神经后遗症的发生都有重要意义。
参考文献:
[1] Twomey E,Twomey A,Ryan S,et al.MR imaging of term infants with hypoxic-ischaemic encephalopathy as a predictor of neurodevelopmental outcome and late MRI appearances[J].Pediatr Radiol,2010,40(9):1526-1535.
[2] Giselle DeVetten,Shelagh B.Coutts,Michael D.Hill,et al.Acute Corticospinal Tract Wallerian Degeneration Is Associated With Stroke Outcome[J].Stroke,2010,41(4):751-756.
[3] Menezes NM,Connolly SA,Shapiro F,et al.Early ischemia in growing piglet skeleton:MR diffusion and perfusion imaging[J].Radiology,2007,242(1):129-136.
[4] Schaefer PW,Copen WA,Lev MH,et al.Diffusion-weighted imaging in acute stroke[J].Magn Reson Imaging Clin N Am,2006,14(2):141-168.
[5] Cheng Y,Liu GR,Guan JT,et al.Early diffusion weighted imaging and expression of heat shock protein 70 in newborn pigs with hypoxic ischaemic encephalopathy[J].Postgrad Med J,2005,81(959):589-593.
[6] Kaur C,Sivakumar V,Zhang Y,et al.Hypoxia-induced astrocytic reaction and increased vascular permeability in the rat cerebellum[J].Glia,2006,54(8):826-839.
[7] Kim EY,Ryoo JW,Roh HG,et al.Reversed discrepancy between CT and diffusion-weighted MR imaging in acute ischemic stroke[J].Am J Neuroradiol,2006,27(9):1990-1995.
[8] 王芳,牛冬,余旭平,等.猪生物医学研究进展[J].动物医学进展,2009,30(4):99-102.
[9] Gregory A,Lodygensky,Terrie E,et al.Application of magnetic resonance imaging in animal models of perinatal hypoxic-ischemic cerebral injury[J].Int J Develop Neurosci,2008,26(1):13-25.
[10] Alexander Drobyshevsky,Matthew Derrick,P.V.Prasad,et al.Fetal brain magnetic resonance imaging response acutely to hypoxia-ischemia predicts postnatal outcome[J].Ann Neurol,2007,61(4):307-314.

