双氯芬酸诱导雏鸡痛风的病理学观察
杨彩然,董淑珍,刘玉芹,马吉飞,王金峰,杨宗泽
(1.河北科技师范学院动物科学系河北省预防兽医学重点实验室,河北昌黎066600;2.天津农学院动物科学系,天津西青300384;3.河北省永清县畜牧兽医局,河北永清065600)
双氯芬酸为一种强效消炎镇痛药,是感冒症状缓解剂,通过抑制前列腺素合成而起到解热镇痛的作用。其解热镇痛作用较强,消炎作用比消炎镇痛强2~2.5倍,比阿斯匹林强20~50倍。口服吸收迅速,服药后1~2 h血药浓度达高峰。该药在人的临床应用中不良反应报道较多[1-2]。
近年来,随着家禽呼吸道疾病的增多,一些养殖户误认为鸡患了感冒而擅自选用该药,将大量感冒通(主要成分为双氯芬酸、人工牛黄、扑尔敏,其中双氯芬酸是主要成分)混饲于鸡饲料中,造成鸡的中毒和死亡,死亡率高达68%~80%,给养鸡户造成了巨大经济损失[3-7]。
为了弄清双氯芬酸对雏鸡的毒性机制,我们进行了本试验,为以后的临床安全用药提供参考。
1 材料与方法
1.1 药物及给药途径 双氯芬酸钠肠溶片,白云山制药厂生产,批号:H41024221含量:25 mg/片。药物研为粉末,灌服。
1.2 试验动物及分组 将100只13日龄白来航雏鸡随机分为 5组,每组 20只,第 1~4组为试验组,第5组为对照组,试验组鸡给予不同剂量的药物,从第1组到第4组依次给药剂量分别为2.5 mg/kg、3.5 mg/kg、4.5 mg/kg 、7.5 mg/kg 体重,对照组不给药。所有鸡喂饲小鸡颗粒全价料,自由采食,给予充足饮水。
1.3 血清制备 分别在喂药前、喂药后24 h、48 h、72 h,用 1 mL注射器,翅静脉采血,立即 2 000 r/min离心20 min,分离血清,-20℃冻存,备用。1.4 血清指标检测 血清中UA、BUN、K+、Ca2+、H+、Na+、Cl-,在自动生化分析仪和电解质分析仪进行测定。试验结果用SPSS 11.0统计软件进行方差分析。
2 结果
2.1 临床症状 喂药后4 h,试验组大部分鸡表现精神委靡,羽毛逆立,呆立一隅,饮食量明显降低。次日,第3组有6只鸡精神委靡,第4组有8只鸡精神委靡,其中第4组有4只鸡死亡,第3天,大部分鸡精神好转。
2.2 病理变化
2.2.1 肉眼病理变化 剖检死亡鸡可见,肾明显肿大,颜色变浅,呈花斑肾外观,肾表面与切面均有大量的白色尿酸盐结晶,输尿管扩张、增粗,管内充满白色尿酸盐。心包、胸膜、腹膜及肌肉有白色尿酸盐沉积,腹腔内的肠管间、肠管与胃和腹膜由于尿酸盐的沉积,粘连在一块,不易分离。
2.2.2 病理组织学变化 肾皮质结构明显被破坏,表现为肾小球肿胀,肾小囊囊腔变狭窄,近端和远端小管上皮细胞肿胀,发生颗粒变性,甚至水泡变性,严重的肾小管上皮细胞发生坏死,在肾小管中可见痛风石形成,肾小管结构消失(见图1、图2)。皮质部位的间质及肾小管内有单核细胞和异嗜性粒细胞浸润。肝组织和脾脏组织内也有痛风石形成,并伴有局部肝组织和脾组织的坏死(见图3、图6)。在心外膜下和肝被膜下可见尿酸盐沉积(见图4、图5)。
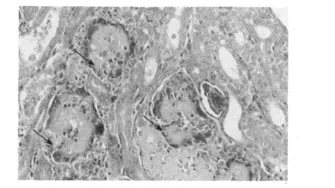
图1 肾小管中尿酸盐沉积(H.E.400×)
2.3 临床病理学指标 不同时间各组鸡血清中尿酸含量与喂药前相比,喂药后,第4组血清中尿酸的含量升高,同时也高于对照组。在喂药后24 h,第4
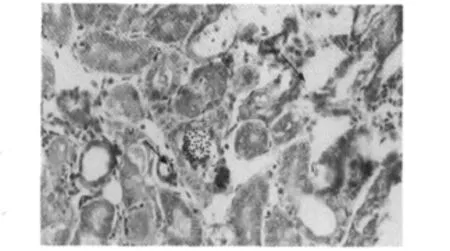
图2 肾小管上皮细胞变性坏死(H.E.400×)
组尿酸含量升高,其数值极显著高于其他组的尿酸含量(P<0.01),其中第4组中,最后死亡鸡的尿酸增高到 829.75 μ mol/L 。
喂药后24 h,第4组BUN含量高于其他组的BUN含量(P<0.01)。此组中最终死亡鸡在喂药后24 h血清中BUN达26.97 mg/dL。其他组鸡血清BUN浓度没有显著变化(P>0.05)。
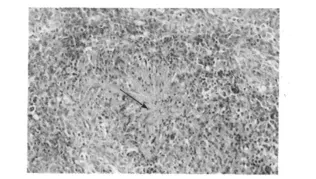
图3 脾脏中形成痛风石(H.E.400×)

图4 心外膜下的尿酸盐(H.E.400×)
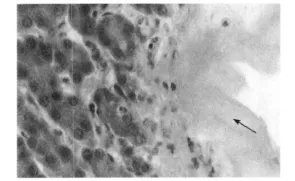
图5 肝脏被膜下的尿酸盐(H.E.400×)
喂药后24 h、48 h,第4组血清中K+浓度高于其他组的K+浓度(P<0.05)。第4组血清中pH值喂药24 h后降低(见表1)。血清中Ca2+、Na+和Cl-浓度无变化。
3 分析与讨论
3.1 双氯芬酸对肾的毒性机制 双氯芬酸对鸡的毒性,主要是其对肾脏的损害,这与其他研究一致[8-11]。但此药物对肾脏的损伤,不同的研究其结果有差别。本试验中,肾脏病理组织学变化,主要在肾皮质部,表现为肾小管内有尿酸盐沉积,肾小管上皮细胞变性、坏死等病理变化,与Oaks等[8]的研究结果一致,而与Reddy等[12]的研究结果有所不同,Reddy等观察动物的病理变化除了肾小管坏死之外,还出现慢性病变特征,表现为纤维化变化,病程较长。由于禽血浆中尿酸盐大部分是不与蛋白质结合的,因此,可通过肾小球滤过。研究表明,禽类的尿酸少部分是由肾小球排出,大部分尿酸是通过肾小管分泌[13],当肾小管受到损伤时,尿酸盐排出受阻,进而使血清尿酸升高,引起高尿酸血症,最终尿酸沉积在器官表面和组织内部。本试验的第4组死亡的鸡,经剖检,心脏、腹腔器官、胸膜和腹膜等多处有白色尿酸盐沉积,血清尿酸浓度显著升高,得到证实。另外,BUN是肾功能的最敏感的决定指标,血清中BUN的变化,反映出肾受到了损伤,本试验中,第4组鸡在喂药后24 h,BUN升高,比对照组高1.4倍(14.16∶9.91),尤其是第4组中死亡的鸡,其BUN高达26.97 mg/dL,是对照组BUN的2.7倍,试验鸡表现出明显的内脏型尿酸盐沉积等病理变化,严重损害了肾功能,表明喂给鸡双氯芬酸剂量为7.5 mg/kg体重时,对鸡肾脏有毒害作用。
试验组鸡的临床表现可通过临床病理学指标的变化来解释。从较高剂量药物组鸡的临床表现和临床病理指标可看出,在喂药后24 h,4.5 mg/kg、7.5 mg/kg体重剂量组中分别有6只鸡、8只鸡精神委靡,此时鸡血尿酸浓度升高,血液pH值下降。由于血尿酸升高,再加上肾小管损伤,肾小管对NaHCO3重吸收减少,使机体的代偿机能受到限制,致使血液pH值下降,严重者引起酸中毒,而酸中毒又抑制中枢神经系统,使鸡精神委靡。肾小管的损伤,使肾小管排K+障碍,使血液中 K+浓度升高,本研究中,7.5 mg/kg体重剂量组,在喂药后 24 h,血钾升高,高血钾可抑制肾小管上皮细胞H+与Na+的交换,同时K+与细胞内的H+可进行跨膜交换,造成H+在血液内潴留过多,加重酸中毒[14]。

图6 肝组织中的尿酸盐(H.E.400×)
3.2 鸡死亡的原因 高剂量双氯芬酸组的BUN明显增高,说明试验鸡发生了肾功能衰竭,而肾功能衰竭又可诱导高钾血症的发生。有学者研究认为,痛风禽患病后期血钾增加是其死亡的原因[10,15]。Zandvliet等[16]发现,高血钾通过改变心电图的复极化过程而使心律异常,引起禽心动过缓。
4 小结
7.5 mg/kg体重剂量的双氯芬酸可对雏鸡产生急性毒性作用,其通过损伤肾脏,诱导鸡发生内脏型痛风。其他剂量试验组未见明显的毒性反应。
[1]王俊.感冒通致血尿24例报告[J].西南军医,2005,7(5):34.
[2]马慧芬.感冒通854例不良反应文献分析[J].药学实践杂志,2004,22(3):182-183.
[3]邹强.雏鸡感冒通中毒[J].中国兽医杂志,1999,25(5):41.
[4]刘庆才,殷宏祥,张进传,等.雏鸡感冒通中毒[J].中国家禽,2000,22(1):40.
[5]曾中华.雏鸡感冒通中毒[J].中国兽医杂志,2002,38(7):59.
[6]杨建春,张新德.鸡感冒通中毒[J].中国家禽,2007,24(13):46.
[7]汤海平.三黄雏鸡发生感冒通等药物中毒 [J].中国家禽,2001,23(5):31.
[8]Oaks J L,Gilbert M,Virani M Z,et al.Diclofenac residues as the cause of vulture population declines in Pakistan[J].Nature,2004,427(6975):630-633.
[9]Meteyer C U,Rideout B A,Gilbert M,et al.Pathology and proposed pathophysiology of diclofenac poisoning in freeliving and experimentally exposed oriental white-backed vultures(Gyps bengalensis)[J].J Wild Dis,2005,41(4):707-716.
[10]Swan G E,Cuthbert R,Quevedo M,et al.T oxicity of diclofenac in Gy ps vultures[J].Biol Lett,2006b,2:1-4.
[11]Naidoo V,Duncan N,Bekker L,et al.Validating the domestic fowlas amodelto investigate the pathophy siology of diclofenac in Gyps vultures[J].Environmental Toxicology and Pharmacology,2007,24(3):260-266.

[12]Reddy,N C P,Anjaneyulu Y,Sivasankari B,et al.Comparative toxicity studies in birds using nimesulide and diclofenac sodium[J].Environ T oxicol Pharmacol,2006,22(2):142-147.
[13]Brown T P.Urinary sy stem[M]//Riddell C.Avian Histopathology.2nd ed.American Association of Avian Pathologists,1996:167-181.
[14]马学恩.家畜病理学[M].北京:中国农业出版社,2007:106.
[15]Lumeij J T.Nephrology[M]//Ritchie B W,Harrison G J,Harrison L R.Avian Medicine:Principles and Application.Flo rida Wingers,1994:538-555.
[16]Zandvliet M M.Electrocardiography in psittacine birds and ferrets[J].Semin Avian Exot Pet Med,2005,14(1):34-51.

