心脏瓣膜置换术后机械瓣功能不全再次手术
黄健宏 王茂生 黄健
近年来,机械瓣膜的材料及设计工艺得到了迅速发展,由于手术操作技术的不断进步,大幅度改善了心脏瓣膜置换术(Cardiac Valve Replacement,CVR)的疗效及安全性。目前CVR的主要术后并发症——机械瓣功能不全的发生率已经下降至1%以下,但仍是CVR最为严重和危险的并发症之一,起病迅速,病死率高,需要及时手术处理。本次研究选择我院收治的16例人工CVR术后机械瓣功能不全患者,对其发生功能不全的原因及再次手术方法进行回顾性分析,旨在探究CVR术后机械瓣功能不全再次手术的预防和手术方案,现报道如下。
1 临床资料与方法
1.1 一般资料
本次研究选择16例CVR术后机械瓣功能不全患者为研究对象,男10例,女6例,平均年龄(45.7±9.2)岁,均在我院进行首次CVR手术,手术方式包括二尖瓣置换术(mitral valve replacement,MVR)11例,主动脉瓣置换术(aortic valve replacement,AVR)5例,首次手术均使用机械瓣,其中MVR采用单叶机械瓣8枚,双叶机械瓣3枚;AVR采用单叶机械瓣3枚,双叶机械瓣2枚。本组患者中,首次手术出院至发生机械瓣功能不全间隔时间6~122个月。
1.2 手术方法
所有患者均经首次手术的胸部切口开胸,经上腔静脉、下腔静脉、主动脉建立体外循环。手术中见机械瓣膜功能障碍的原因为瓣环组织内膜增生8例,血栓形成5例,瓣环组织内膜增生合并血栓形成3例。再次手术方法包括机械瓣置换术9例,其中包括7例MVR,2例AVR;生物瓣置换术7例,其中包括5例MVR,2例AVR。
1.3 统计学方法
所有数据统一采用SPSS11.0 for windows软件进行统计学分析,组间比较采用Fisher确切概率法,以P<0.05为差异具有统计学意义。
2 结果
本组共16名患者,进行再次手术后死亡5例(31.25%),其中4例(44.44%)采用机械瓣进行再次手术,1例(14.28%)则采用生物瓣。两组不同手术方法救治成功率经比较,差异具有显著性意义(P<0.05)。
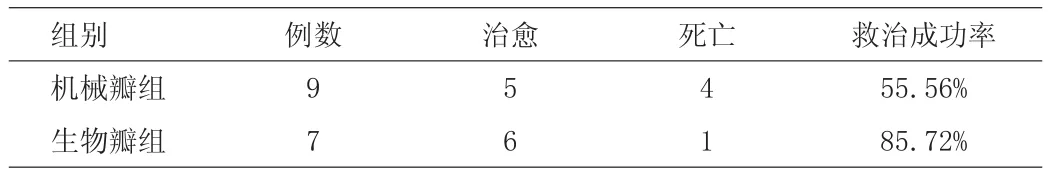
表1 机械瓣组与生物瓣组救治成功率比较表
3 讨论
心脏瓣膜作为确保血液流动正确方向和速度的重要生理结构,其病变可能危及生命。早在20世纪50年代,医学专家们就开始研究制造人工心脏瓣膜的理想材料,目前认为,理想的人工心脏瓣膜必须能够取代病变瓣膜的结构和功能,同时能够稳定移植于病变瓣膜的位置而不引起并发症或其他不良事件。机械瓣膜主要由阀体、瓣架和缝合环组成,采用的材料包括硅胶、不锈钢、钛合金、热解碳、聚四氯乙烯等,现已大量应用于临床。但机械瓣膜不具有生物结构,在血液循环中可激活凝血系统,产生血栓和纤维组织增生,因此采用机械瓣膜行CVR的病人,必须长期接受抗凝治疗,可能导致严重的出血倾向或血栓形成[1]。
机械瓣膜置换术后常用的抗凝药物有华法林及肝素。抗血小板药物单用不能显著降低机械瓣膜的瓣膜血栓形成和血栓栓塞。抗血小板药物的联合用药尚存在争议。国内外一些研究发现,抗血小板药物联合香豆素类药物行抗凝治疗对栓塞发生率并没有显著的降低作用,反而增加了出血的危险性。单用华法林抗凝是机械瓣膜置换术后预防血栓最常用的方式,华法林半衰期长,每日只需服药一次,简易方便,因此,被认为是一种理想的抗凝药物。作为一种香豆素类抗凝剂,华法林通过抑制VitK依赖性凝血因子的活化过程,使凝血酶原反应时间延长,进而阻断凝血途径,发挥抗凝作用。肝素则主要用于需要二次手术或同时进行心脏以外手术的患者,停用华法林期间静脉输注或皮下注射肝素,可作为一种理想的替代疗法。国内研究表明,抗凝治疗本身带来的出血并发症甚至高于抗凝中的并发症(如血栓、栓塞等),个别病人在换瓣术后从未进行抗凝治疗,并末发生血栓栓塞等并发症。如果取消CVR术后抗凝治疗,可彻底避免出血并发症,但目前尚未取得充分的证据证明这样做具有更高的临床价值,对于临床上使用的人造瓣膜,抗凝疗法仍是必需的。我们应对病人及其家属进行沟通和教育,使其认识到终身抗凝治疗的必要性,最终确保手术的成功。
再次CVR患者术前心功能较差,需行利尿、强心、扩血管等综合治疗改善心功能。对于随访患者,一旦发现心功能下降,应嘱其尽早手术。对合并有恶病质的患者,入院后应给予营养支持;对严重肝功能损害者应补充氨基酸,待身体状况、心功能及肝功能好转后再行手术。再次CVR患者常发生心包广泛粘连,应做好行股动脉插管的准备。右前外侧切口常用于二尖瓣、三尖瓣病变者,而左后外侧切口常用于有多次心脏手术的单纯二尖瓣或左心室病变者。左侧心包未游离时,二尖瓣环固定在前上方,位置深而不易充分显露,为避免瓣环回缩,可采取间断褥式缝合从心房侧进针,在切除病变瓣膜的同时进行缝合。在体外循环停止后,主动脉插管拔除前,常规头低位摇动心脏,一般可经主动脉插管直接排出残余气体。对创面大、渗血多、心包分离广泛者,应仔细止血。出现心包粘连者,应加强心肌保护:(1)加大首次心脏停搏液量,缩短灌注间隔时间,或持续经冠状静脉窦逆行灌注冷晶体停搏液,降低全心温度。(2)采取心脏不阻断主动脉技术,持续有氧血供,减少再灌注损伤,但缺点是术中左心房回血多,视野不佳,可能增加手术时间,致使心肌张力升高,导致心脏损伤。(3)CVR采用连续缝合方法可显著减少手术时间,CVR可在心脏不阻断主动脉技术下进行。(4)术中间断膨肺以及肺动脉排气,从而减轻对肺动脉系统的损伤。
机械瓣膜具有形态及功能可控性好、获取容易、不易发生钙化等优点。特别是机械瓣膜不仅再手术的几率低,且再次手术的难度也远小于生物瓣膜。因此,目前对于需要行CVR的病人,医生多采用机械瓣膜。但目前制约机械瓣膜发展的重要原因之一便在于其对凝血系统的激活作用,其不仅引起血栓大量生成,还会造成瓣环组织过度增生[2]。而采用机械瓣膜的CVR一旦发生术后功能不全,死亡率非常高,甚至显著高于首次手术。虽然随着操作技术的提高和机械瓣膜材料的改进,发生术后功能不全的几率已经非常低,但对于采用机械瓣的CVR患者,再次手术时不适宜继续使用机械瓣膜,由于生物瓣膜血液相容性较高,流体力学性能出色,基本不会存在血栓形成和纤维性增生的危险,术后不需要终生抗凝治疗[3-4],是CVR再次手术的理想材料。本次研究中采用生物瓣进行的CVR再次手术救治成功率高达85.72%,高于采用机械瓣膜手术的患者,在一定程度上反映了生物瓣膜进行CVR再次手术的优越性。
总之,CVR术后机械瓣膜功能障碍再次手术的处理原则在于早诊早治[5],机械瓣膜引起的血栓形成和瓣环增生是造成再次手术的主因,适合采用生物瓣膜进行再次手术。
[1]Emery RW,Emery AM,Raikar GV,et al.Anticoagulation for mechanical heart valves:a role for patient based therapy[J].J Thromb Thrombolysis, 2008, 25(1):18-25.
[2]王永亮,张伟,万俊哲,等.机械瓣膜置换术后远期抗凝状态观察及临床意义[J].中国综合临床,2009,25(10):1024-1026.
[3]李峰,胡建国,尹邦良,等.52例人工生物瓣膜临床应用分析[J].中南大学学报(医学版),2008,33 (3):257-261.
[4]彭雪华.机械瓣膜置换术后抗凝治疗病人的健康教育[J].内蒙古中医药,2009,28(18): 98-99.
[5]刘日辉,聂荣华,杨俊波,等.心脏瓣膜置换术267例临床分析[J].实用医学杂志,2010,26(4):623-625.