牛乳腺上皮细胞体外分离和培养*
弓 超,王凌云,周欢敏
(内蒙古农业大学生命科学学院,内蒙古呼和浩特 010018)
牛乳腺上皮细胞体外分离和培养*
弓 超,王凌云,周欢敏*
(内蒙古农业大学生命科学学院,内蒙古呼和浩特 010018)
从健康奶牛乳房无菌采取乳腺组织,通过添加两种不同的培养液来分离、培养、纯化牛乳腺上皮细胞,研究乳腺上皮细胞的体外培养效果。结果表明,使用组织块接种可以得到大量细胞用于体外培养。在以DMEM/F12为基础的普通培养液中进行乳腺上皮细胞体外培养,原代细胞生长较慢,细胞形态不典型。而添加表皮生长因子、胰岛素、氢化可的松所组成的完全培养液中,奶牛乳腺上皮细胞生长良好。并通过细胞形态学观察,细胞染色体核型分析,荧光免疫细胞染色方法鉴定了培养的细胞表达上皮细胞特异的角蛋白K14,K15。结果表明,分离培养的细胞是牛乳腺上皮细胞。
乳腺上皮细胞;体外培养;奶牛
动物乳腺生物反应器是伴随动物转基因技术而发展起来的一项高新生物技术。利用这项技术可以从动物乳汁中源源不断地获取用于医疗或保健目的的有生物活性的基因表达产物。使用乳腺上皮细胞来检测乳腺特异性表达载体的功能,这一方法具有快捷、方便且能够真实反映乳腺表达载体在生物体内表达水平等优点[1]。牛乳腺上皮细胞系的成功构建,为后续转基因动物生产的研究及检测目的基因的表达情况打下了基础。
牛乳腺上皮细胞的培养已有半个多世纪的历史,但目前已建立的牛乳腺细胞系并不多。1957年,Boddy M N等[2]首先利用胶原酶消化的方法将乳腺细胞或乳腺细胞团(含上皮细胞较多)从乳腺组织中分离出来,第1次实现了乳腺细胞的直接培养。由于乳腺上皮细胞是一种高度分化的细胞,必须不断地摸索体外培养的最佳条件及添加因子的作用,同时乳腺细胞在培养过程中容易脱离分化,必须培养在适宜条件下,才可维持其分化状态[3]。到目前为止建立的有限的永生化细胞系难度大,种类少,最早建立的几个乳腺上皮细胞系,有的甚至都发生了细胞特性的转移[4]。因此,建立乳腺上皮细胞分离培养方法,了解体外培养细胞的形态特征和生物学特性,对进一步了解泌乳的调控机理以及作为一个检测系统验证乳腺表达载体的功能都具有重要意义[5]。
1 材料与方法
1.1 材料
1.1.1 活体材料 牛乳腺组织取自呼和浩特市北亚清真屠宰公司。
1.1.2 主要仪器设备 超净工作台(郑州南北仪器设备有限公司),二氧化碳培养箱(Thermo),倒置显微镜(Nikon),水浴锅(memmer,德国),超纯水机(pall,美国),高压灭菌锅(HIRAYAMA),超低温冰箱(Thermo),液氮罐(乐山市东亚机电工贸有限公司),低速台式离心机(Anke),细胞计数板(上海求精生化试剂仪器有限公司)。
1.1.3 主要试剂 DMEM/F12溶液为Hyclone产品;DMSO、胰蛋白酶(T rypsin)、各种无机盐类为Sigma产品,标准胎牛血清为 TBD产品,表皮生长因子(EGF)、胰岛素、氢化可的松(Sigma),多聚甲醛、医用酒精等为国产试剂。
1.1.4 主要溶液配制 1.乳腺上皮细胞培养液:A:DMEM/F12+15%FBS+100单位/mL青霉素+100单位/mL链霉素。B:DMEM/F12+15%FBS+10 ng/mL EGF+10 μ g/mL 氢化可的松 +5 μ g/mL胰岛素 +100单位/mL青霉素 +100单位/mL链霉素。2.细胞冷冻液:70%DMEM/F12+20%FBS+10%DMSO新鲜配制。34 g/L多聚甲醛固定液:10 mLPBS溶解0.4 g多聚甲醛,磁力搅拌。用NaOH调pH到7.2,需先加入NaOH边加热边振荡,加热温度控制于60℃以下。
1.2 方法
1.2.1 组织块法分离培养牛乳腺上皮细胞 从屠宰场取新鲜的泌乳期的牛乳腺组织,生理盐水冲洗干净,直至没有乳汁和血液,并置于预先加有100单位/mL青霉素、100单位/mL链霉素的PBS中迅速带回实验室。剥离导管组织,去除脂肪及结缔组织,用 PBS反复冲洗 3遍,剪去导管两端,并用750 mL/L的酒精处理30 s。在含有微量培养液的青霉素小瓶中,将导管组织尽可能的剪碎;用牙科探针将小组织块接种到培养皿上,不加培养液,置于37℃、体积分数为5%CO2的培养箱中贴壁4 h左右。然后加适量培养液,放回培养箱中培养。
1.2.2 细胞传代培养及乳腺上皮细胞的纯化 待细胞基本长满培养板底壁,吸去原有培养液,用PBS清洗细胞两次,加入 2.5 g/L胰蛋白酶/EDTA 37℃培养箱消化,不断在倒置显微镜下观察细胞状态,待大多数细胞回缩,变圆,细胞间隙扩大时,终止消化,反复吹打细胞,1 500 r/min离心5 min,利用成纤维细胞与上皮细胞贴壁时间的差异性,将贴壁时间较长的上皮细胞连同培养液一起转移到新的培养瓶中进行培养,反复操作3次左右,就会得到较为纯化的乳腺上皮细胞。
1.2.3 牛乳腺上皮细胞冻存和复苏培养 将消化后的细胞加入 1 mL新鲜的无血清培养液重悬细胞,血球计数板计数后,用细胞冷冻液调整细胞至5×106个/mL,每个冻存管分装1 mL,放入冻存盒,于-80℃冰箱过夜,然后投入液氮中长期保存。当细胞解冻复苏时,从液氮罐中取出冻存管,迅速投入37℃的水浴锅中,快速晃动,使其完全融化。用5 mL预热的培养液重悬细胞,1 500 r/min,离心5 min弃上清,收集细胞,加入3 mL生长培养液重悬细胞,将其接种于直径为 60 mm的培养皿中,于37℃、5%CO2饱和湿度条件下培养,次日更换一次培养液,继续扩大培养。
1.2.4 乳腺上皮细胞生长曲线的绘制 培养至第5代的乳腺上皮细胞生长至80%~90%汇合时,消化离心,收集细胞,以6×103个/mL的密度接种于24孔板中,每孔加入 1 mL培养液,于 37℃、5%CO2饱和湿度条件下培养。每天同一时间用2.5 g/L胰蛋白酶/EDTA消化3孔细胞,进行细胞计数,然后取平均值。连续进行8 d。计数期间每隔3 d换一次培养液。以培养的时间为横坐标,每天所计3孔细胞的平均值为纵坐标绘制细胞生长曲线。
1.2.5 乳腺上皮细胞染色体分析
(1)待上皮细胞生长至80%汇合时,加入秋水仙素(终浓度为0.2 μ g/mL),37 ℃培养4 h;
(2)弃掉培养液,胰蛋白酶消化10 min,终止消化,1 500 r/min,离心5 min弃上清,收集细胞;
(3)缓慢加入37℃预热的0.075 mol/L KCl,37℃低渗处理30 min;
(4)低渗后加入10 mL固定液(甲醇∶冰乙酸=3∶1),预固定5 min;
(5)1 500 r/min,离心 5 min,弃上清,留约500 μ L,轻振悬浮细胞 ;
(6)加10 mL固定液,第1 mL逐滴加,混匀,室温固定20 min;
(7)重复步骤5;(8)重复步骤6;(9)1 200 r/min,离心5 min,弃上清 ,加 1.5 mL固定液,轻振悬浮细胞;
(10)吸取少量细胞悬液,滴落在预冷的干净的载玻片上,迅速在酒精灯火焰上烘烤;
(11)制备好的染色体滴片用Giemsa染色液浸染15 min,流水冲洗干净。自然干燥后,在显微镜下观察,统计染色体数目。
1.2.6 荧光免疫细胞染色法鉴定乳腺上皮细胞用荧光免疫染色法检测培养的乳腺上皮细胞中特有蛋白的表达情况,同时用牛成纤维细胞作为阴性对照组:
(1)将生长正常的乳腺上皮细胞,在室温下,用40 mL/L多聚甲醛固定生长于 24孔板中的细胞30 min,之后PBS清洗3次,每次5 min;
(2)加入 0.3%的 Triton X-100通透处理5 min,PBS清洗3次,每次5 min;(3)加入100 mL/L正常山羊血清的PBS封闭液处理30 min;
(4)加小鼠抗人的细胞角蛋白K14和K15单克隆抗体(1∶100稀释)于室温下振荡孵育1 h;
(5)加入FITC标记的山羊抗小鼠IgG的二抗(1∶50稀释),室温下避光振荡孵育30 min,PBS清洗3次,每次5 min;
(6)加入含碘化丙锭(propidium iodide,PI)10 μ g/mL 的PB,室温下染核10 min,用荧光显微镜观察结果。
2 结果
2.1 两种培养液对乳腺上皮细胞原代培养的影响
用普通DMEM/F12培养液和添加因子的完全培养液均能够获得乳腺上皮细胞。但是两种培养液培养的原代细胞析出时间及细胞形态不同。普通DMEM/F12培养液经原代培养10 d左右才会有细胞析出(图1),而添加因子的完全培养液一般在7 d左右就会有细胞析出(图2)。两种方法长出的都是乳腺上皮细胞与成纤维细胞的混合体,成纤维细胞多成条状、旋涡状或放射状排列,而上皮细胞则多呈短的梭形或多角形,细胞之间紧密相靠,相互衔接,连接成片(图3)。但是添加因子的完全培养液得到的乳腺上皮细胞形态更为典型(图2)。
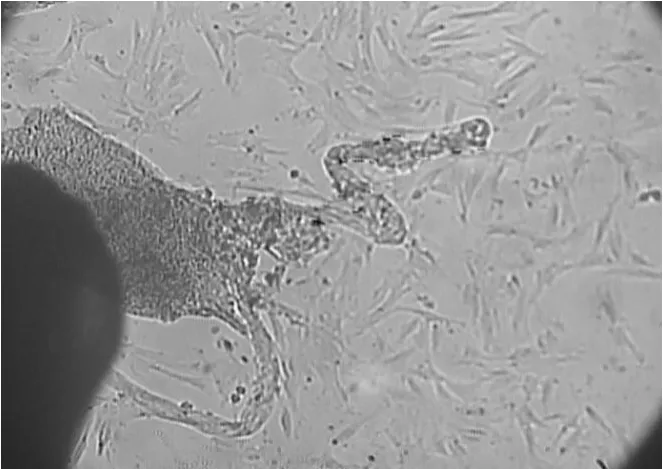
图1 普通DMEM/F12培养液原代培养10 d(100×)Fig.1 The bovine mammary epithelial cells cultured with DMEM/F12 for 10 d(100×)
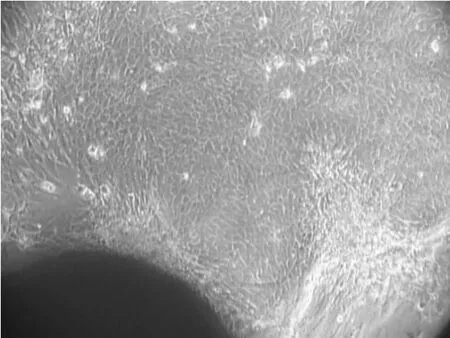
图2 添加因子的完全培养液原代培养10 d(100×) Fig.2 The bovine mammary epithelial cells cultured with complete g rowth medium for 10 d(100×)
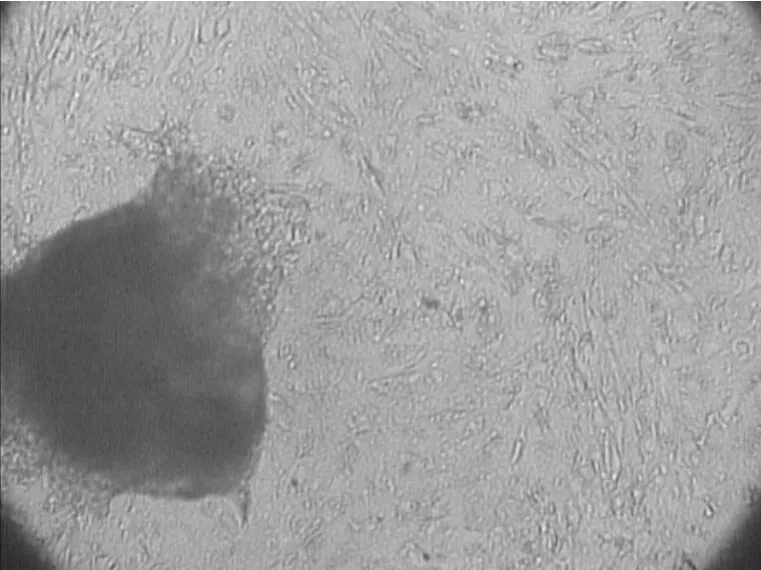
图3 原代培养中上皮细胞与成纤维细胞混杂生长的状态(100×)Fig.3 T he bovine mammary epithelial cells primarily cultured(100×)
2.2 乳腺上皮细胞与成纤维细胞的分离纯化培养
成纤维细胞与上皮细胞对胰蛋白酶的耐受性不同,在消化培养时,常是成纤维细胞先脱壁,而上皮细胞要消化相当长时间才脱壁;而且成纤维细胞与上皮细胞相比,其贴壁过程快,大部分细胞常能在短时间内(大约10 min~30 min)完成附着过程(但不一定完全伸展),而上皮细胞大部分在短时间内不能附着或附着不稳定,稍加震荡即浮起。综合这两个特性进行纯化,在1 h贴壁培养的孔中,长的基本都是成纤维细胞,随后的孔中成纤维细胞逐渐变少。用这种方法一般经过2次~3次的选择传代即可得到纯化的乳腺上皮细胞系(图4)。
2.3 乳腺上皮细胞的解冻复苏培养
冻存的牛乳腺上皮细胞经解冻接种培养皿后,保持着细胞聚集生长的上皮细胞的典型特征。细胞培养过程中,细胞形态良好。由此证明常规的细胞冷冻保存及解冻复苏的培养方法适用于牛乳腺上皮细胞(图5)。
2.4 乳腺上皮细胞生长曲线的绘制
以细胞培养天数为横坐标,平均细胞数为纵坐标绘制了牛乳腺上皮细胞生长曲线图(图6)。细胞生长曲线基本呈现典型的“S”形,符合细胞生长的一般生物学规律。生长曲线显示:牛乳腺上皮细胞生长潜伏期为0 d~2 d,对数生长期为2 d~6 d,6 d后进入平台期。试验结果表明,培养的牛乳腺上皮细胞具有正常细胞的分裂增殖特征。
2.5 乳腺上皮细胞染色体分析
观察结果:细胞核型稳定,在离体培养条件下不发生转化。选择分散良好和轮廓清晰的30个分裂相进行统计分析,结果表明28个分裂相具有正常的染色体数目(2n=60),正常率93.3%(28/30)。图7为其中的1个分裂相。
2.6 荧光免疫细胞染色分析细胞角蛋白K14、K15的表达
应用荧光免疫细胞染色分析了分离培养并经过纯化后的乳腺上皮细胞的骨架蛋白——角蛋白14、15表达情况,分析结果表明:分离培养的乳腺上皮细胞几乎全部呈阳性(图8~图11)。这一结果证明了分离培养的细胞是乳腺上皮来源且具有乳腺上皮细胞的正常生理功能,牛成纤维细胞作为阴性对照,成纤维细胞胞质无显色。
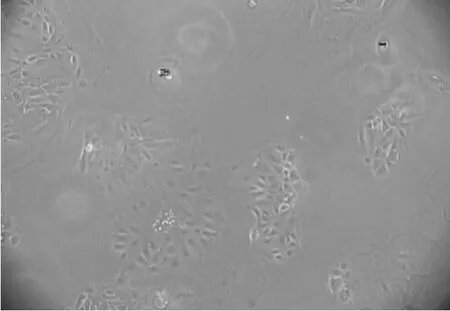
图4 乳腺上皮细胞纯化(100×)Fig.4 The bovine mammary epithelial cells purified(100×)
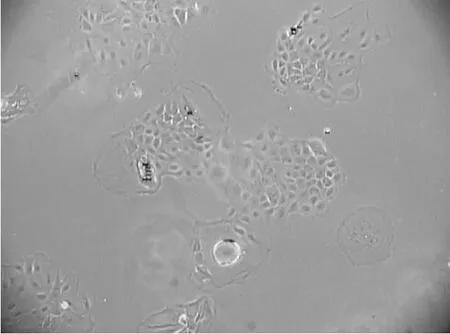
图5 解冻后的乳腺上皮细胞(100×)Fig.5 The bovine mammary epithelial cells cultured after thawing(100×)

图6 牛乳腺上皮细胞生长曲线 Fig.6 The growth curve of the bovine mammary epithelial cells

图7 牛乳腺上皮细胞的染色体(2n=60)Fig.7 Chromosome of the bovine mammary epithelial cells(2n=60)
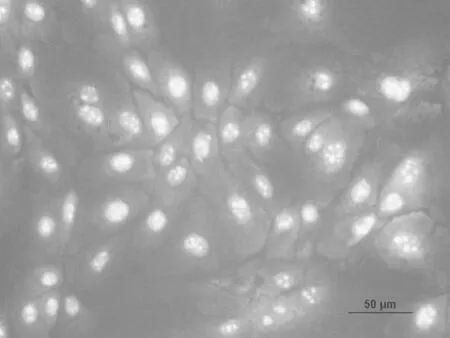
图8 纯化的乳腺上皮细胞K15抗体染色(20×)Fig.8.The purified bovine mammary epithelial cells stained with the antibodies K15(20×)
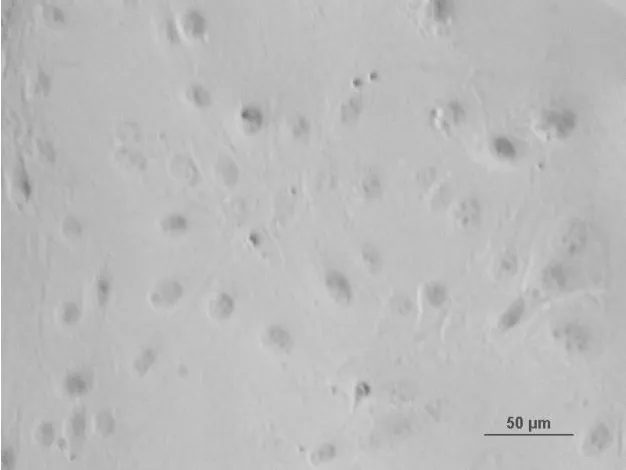
图9 暗场条件下纯化的乳腺上皮细胞K15抗体染色(20×)Fig.9 The purified bovine mammary epithelial cells stained with the antibodies K15 in dark field(20×)
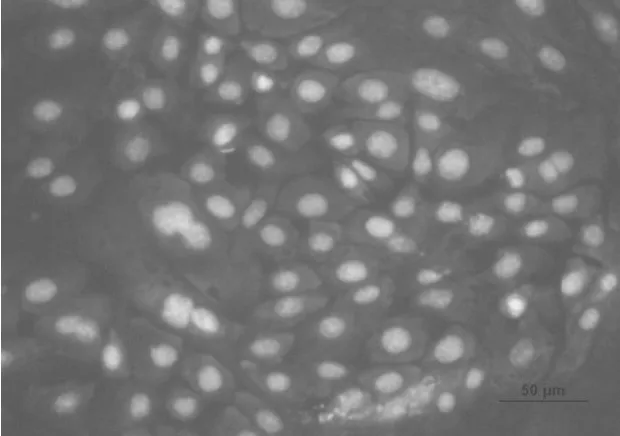
图 10 纯化的乳腺上皮细胞K14抗体染色(20×)Fig.10 The purified bovine mammary epithelial cells stained with the antibodies K14(20×)
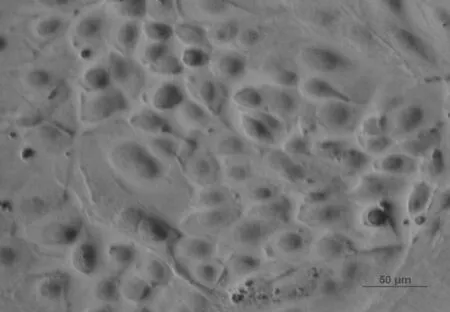
图11 暗场条件下纯化的乳腺上皮细胞K14抗体染色(20×)Fig.11 The purified bovine mammary epithelial cells stained with the antibodies K14 in dark field(20×)
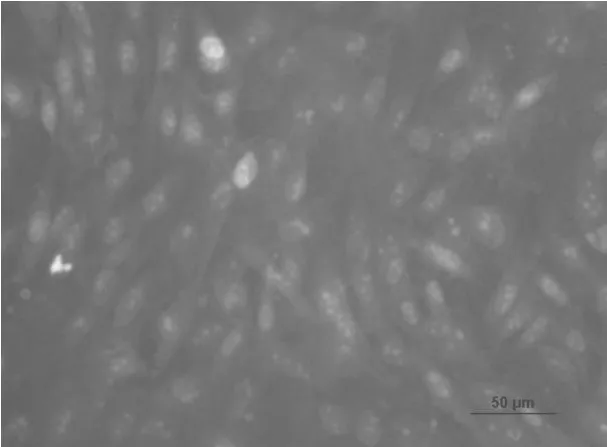
图12 牛成纤维细胞作为阴性对照(20×)Fig.12 Negative control,the bovine fibroblasts stained with the antibodies×20
3 讨论
3.1 牛乳腺细胞的原代培养
乳腺是转基因动物技术的一个主要研究对象,因为通过遗传操作可改变乳汁成份,获得具有生物活性成分的重要外源产物[6]。但通过乳腺生物反应器生产能达到商品化生产所需的为数不多。鉴于此,本研究建立了正常牛乳腺上皮细胞培养体系,为进一步研究BMEC的增殖和分化以及基因表达调控的分子机制提供了合适的细胞平台。
动物细胞原代培养主要有两种方法,即一是组织块培养法,从贴壁的组织块周围可长出细胞单层,这种方法已被证明适用于牛乳腺上皮细胞的原代培养[7];二是用酶消化法收集单细胞悬液,以密度梯度离心法纯化细胞。一些研究表明用酶消化法进行牛乳腺细胞原代培养[8]时,容易损害细胞,特别是对上皮细胞损伤更大。
乳腺是由乳腺组织、结缔组织和脂肪组织组成的,而乳腺组织是由导管和腺泡组成的。取材过程中一定要注意避免误取结缔组织和脂肪组织等非乳腺组织,从而可以避免培养过程中杂细胞的污染。本研究用组织块培养法进行牛乳腺上皮的原代培养,选取导管作为组织块的来源,可以尽量避免组织污染[9]。虽然上皮细胞从组织块中迁出的速度较慢,所需时间较长,但生长的细胞比较整齐,不易丢失损伤细胞,而且操作方法简单。原代培养1周左右,组织块周围游离出几个至十几个细胞生长在一块,细胞为鹅卵石状,呈典型的上皮细胞特征。未纯化的原代培养物为乳腺上皮细胞和成纤维细胞的混合物。
对于细胞系的纯化,本试验综合了两种细胞纯化方法:一种为酶消化法,即根据上皮细胞与成纤维细胞对胰蛋白酶的耐受性不同,在消化培养时,常是成纤维细胞先脱壁,而上皮细胞要消化相当长时间才脱壁,特别是在原代培养和培养早期这种差别尤为明显,因此利用这种差异采用多次消化法将上皮细胞和成纤维细胞分开;另一种方法是反复贴壁法,因为成纤维细胞能在很短时间内贴壁,而上皮细胞贴壁的时间则较长。综合这两种纯化方法能够更快速、更准确的获得纯化的牛乳腺上皮细胞系。
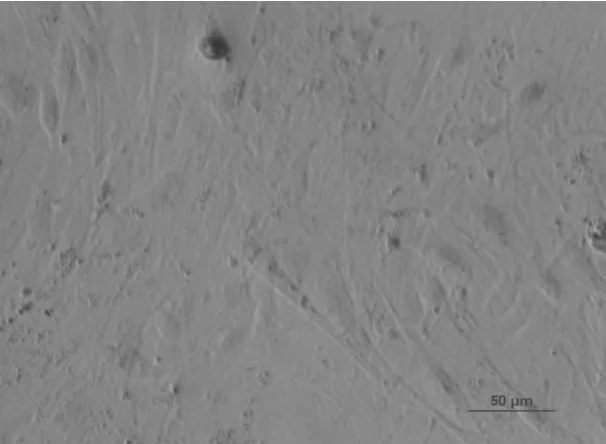
图 13牛成纤维细胞作为阴性对照(20×)Fig.13 Negative control,the bovine fibroblasts stained with the antibodies in dark field×20
对于乳腺上皮细胞系的冻存,采用与其他类型的细胞相同的细胞冻存液也得到了较好的效果,细胞复苏后活力较好。而Han Hu等[10]所使用的细胞冻存液是90%FBS加10%DMSO,对于细胞生长特性也没有改变,这可能与血清对于细胞的生长特性的维持有关。
3.2 不同培养液对乳腺上皮细胞培养的影响
乳腺上皮细胞是高度分化的体细胞,体外培养时,有一定的困难,同时乳腺里含有各种类型的细胞,并且乳腺细胞本身很脆弱,在体外培养经12代左右就明显衰老[11]。如何得到纯度高、活力旺盛的乳腺上皮细胞,合适的培养条件对建立细胞系是十分重要的。特别是培养液和添加因子对细胞生长增殖能力影响更大[12]。本试验采用两种培养液进行培养,一种为普通培养液(A:DMEM/F12+15%FBS+100单位/mL青霉素+100单位/mL链霉素),另一种为添加因子培养液(B:DMEM/F12+15%FBS+10 ng/mL EGF+10 μ g/mL 氢化可的松+5 μ g/mL胰岛素+100单位/mL青霉素+100单位/mL链霉素)。在原代培养过程中,A培养液可以培养出乳腺细胞,但培养出细胞的时间要大于B培养液培养出细胞的时间。一般用A培养液大概10 d~15 d左右才会有细胞混合生长出现。而选用B培养液,组织块法大概7 d左右就会有细胞长出。上述结果表明,A培养液与B培养液比较而言,A培养液不适于乳腺上皮细胞的原代及传代培养。EGF、胰岛素、氢化可的松3种因子协同作用下可以显著的促进BMEC的增殖。
当培养液中添加胰岛素、EGF、氢化可的松时,细胞增殖效果好。胰岛素在体外培养中被证实不仅有促进泌乳的作用还有促进DNA合成的作用[13]。Hansen H等[14]证明羊的乳腺上皮细胞在体外培养的情况下也需要胰岛素、氢化可的松、催乳素的作用才能分泌β-乳球蛋白和β-酪蛋白,但是绵羊乳腺上皮细胞对氢化可的松的反应不明显,山羊乳腺上皮细胞乳脂的合成对氢化可的松的反应也不明显。研究表明[15],EGF虽然其名为表皮生长因子,但它不仅对多种组织来源的上皮细胞都有促增殖活性,而且还对间质细胞的增殖有明显的促进作用,同时还可以作为肿瘤的促进因子。胰岛素是细胞周期的主要外源性调节因子,和EGF协同作用可推进细胞周期向前行进,促使细胞由G1后期进入S分裂期。胰岛素不仅对于乳蛋白基因的表达是必需的,而且在牛的乳腺组织中在多个时期都会促进和调控乳蛋白的合成[16]。
3.3 乳腺上皮细胞的体外鉴定
体外培养的乳腺细胞鉴定一般是鉴别细胞的标志物,如细胞骨架角蛋白,它是乳腺上皮细胞重要的标志蛋白[17]。本研究中所使用的小鼠抗人的细胞角蛋白K14和K15单克隆抗体对乳腺上皮细胞来源的细胞呈阳性反应,应用此抗体对分离培养的乳腺上皮细胞的免疫组化染色几乎全部呈强阳性,这一结果证明了分离培养的细胞是乳腺上皮细胞且乳腺上皮细胞的纯度很高。
[1]徐曼妮,厉曙光,赵建阳,等.乳腺生物反应器表达载体的检测方法[J].生物技术通报,2003(5):23-26.
[2]Boddy M N,Furnari B,Mondesert O,et al.Replication checkpoint enforced by kinases Cds1 and Chk1[J].Science,1998,280(5365):909-912.
[3]Thordarson G,Ogren L,Day J R,et al.Mammary gland development and alpha-lactalbumin production in hypophysectomized pregnant mice[J].Biol Reprod,1989,40(3):517-524.
[4]Lahiry L,Saha B,Chakraborty J,et al.Contribution of p53 mediated Bax transactivation in the aflavin-induced mammary epithelial carcinoma cell apoptosis[J].Apoptosis,2008,13(6):771-781.
[5]郑月茂,彭新荣,徐永平,等.体外培养的山羊乳腺上皮细胞形态研究[J].西北农林科技大学学报:自然科学版,2004,32(3):37-41.
[6]多曙光,吴应积,罗奋华,等.牛乳腺上皮细胞的分离培养及其生物学特性[J].动物学研究,2006,27(3):299-305
[7]杜 娟,钬和双,王根林.奶牛乳腺上皮细胞系的建立及高温对细胞超微结构影响[J].生物工程学报,2007,23(3):471-476.
[8]Institute of Animal Science.Characterization of an epithelial cell line from bovine mammary gland[J].In Vitro Cell Biol Anim,2002,38:282-292
[9]白 俊.LacS原核表达载体的构建-蛋白表达纯化和乳腺上皮细胞培养[D].内蒙古呼和浩特:内蒙古农业大学生命科学学院,2010.
[10]Han Hu,Jiaqi Wang,Juan J Loor,et al.In vitroculture and oharacterization of a mammary epithelial cell line from Chinese Holstein dairy cow[J].PLoS ONE,2009,4(11):e7636.
[11]闫 晶,贺小英,潘春留,等.pEGFP-hTERT真核表达载体的构建及转染牛乳腺细胞方法的优化[J].动物医学进展,2009,30(5):14-19
[12]Dale E.Synthesis of ex tracellular matrix proteins in bovine mammary epithelial cells[J].In Vitro Cell BiolAnim.,2001,37:629-632
[13]Hans Otto Hansen,Jens Knudsen.Bovine mammary teat and ductal epithelial cell cultures[J].Am J Vet Res,1994,55:239-246.
[14]Hansen H O,Knudsan.Lactating goat mammary gland cells in culture[J].Camp Biochcm Physioi,1991,99A:129-135
[15]王治国,王加启.奶牛乳腺上皮细胞的体外培养及应用[D].北京:中国农业科学院,2007.
[16]Menzies K K,Lefevre C,Macmillan K L,et al.Insulin regulates milk protein synthesis at multiple levels in the bovine mammary gland[J].Funct Integr Genomics,2009,9(2):197-217.
[17]于 婷,陈志伟,刘东武.牛乳腺上皮细胞体外培养研究进展[J].生命科学仪器,2009,7(3):18-24
Study on Culture of Bovine Mammary Epithelial Cellsin Vitro
GONG Chao,WANG Ling-yun,ZHOU Huan-min
(College Of Lif e Sciences,Inner Mongolia Agricultural University,Huhhot,Inner Mongolia,010018,China)
In this research,bovine mammary epithelial cells(BMEC)were isolated,purified and culturedin vitro,and further characterized by morphological observation and karyotyping analysis.The tissue-specific expression of cytokeratin K14 and K15 in BMEC was also identified by immunofluorescent cytochemical staining.The results showed that the large number of BMEC could be separated from mammary tissue inoculation.Complete growth medium can cultured BMEC better than DMEM/F12.All these results demonstrated that the purified cells were BMEC.
BMEC;in vitroculture;dairy cow
Q813.11
A
1007-5038(2011)07-0066-06
2010-12-01
内蒙古生物高科技资助项目
弓 超(1984-),男,内蒙古呼和浩特人,硕士研究生,主要从事动物发育与胚胎工程学研究。*通讯作者

