鸡伤寒沙门菌的分离鉴定及药敏试验
刘素英,王晶钰,董 睿,王利勤,王 慧
(西北农林科技大学动物医学院 陕西杨陵 712100)
鸡伤寒沙门菌的分离鉴定及药敏试验
刘素英,王晶钰*,董 睿,王利勤,王 慧
(西北农林科技大学动物医学院 陕西杨陵 712100)
为给鸡伤寒沙门菌病的防控提供理论依据与数据参考,采集疑似鸡伤寒病死鸡的肝、脾病料,进行细菌分离。根据细菌形态、培养特性、生化试验等鉴定出13株沙门菌。对分离到的菌株进行21种常用抗菌药物的敏感性试验,结果显示,分离株对阿米卡星、新霉素高度敏感,对卡那霉素、痢特灵中度敏感,而对其他药物则表现为耐药。将筛选出的阿米卡星对发病鸡场后续发病鸡群采用肌肉注射和硫酸新霉素饮水治疗和痢特灵拌料饲喂,用药5 d后,鸡群鸡伤寒沙门菌病的发病率从50%降到了5%左右。
伤寒沙门菌;分离鉴定;药敏试验;鸡
*通讯作者
沙门菌属(Salmonella)是一群寄生于人和动物肠道内的无芽胞杆菌,是一大属血清学相关的革兰阴性杆菌[1-3]。引起禽类发病的沙门菌主要有鸡白痢沙门菌、鸡伤寒沙门菌及其他有鞭毛能运动的多种沙门菌[2-4]。禽沙门菌病(Avian Salmonellosis)是由多种沙门菌引起的一类传染病的总称,临床上多表现为败血症和肠炎[5-6]。沙门菌病能导致禽的生产性能下降,种蛋的孵化率降低,对养禽业造成巨大的经济损失[7]。我国目前控制该病的主要措施是检疫淘汰带菌鸡,净化培育鸡群;对于一些没有条件净化或短期内还无法净化的鸡群则采用抗菌药物进行预防和治疗,但是由于抗菌药物的不合理使用,在抗生素的选择性压力下使得沙门菌产生的耐药性越来越快,耐药谱越来越广[5-7],因此,在目前还没有有效免疫制剂的情况下,敏感而有效的抗菌药物的筛选对该病的防控具有一定的实际意义[8]。本研究对陕西富平县发生的一起鸡沙门菌病进行了病原分离鉴定以及药敏试验,筛选出敏感的药物用于治疗,取得明显效果。
1 材料与方法
1.1 材料
1.1.1 病料 采自陕西省富平县某鸡场发病鸡的肝、脾组织。
1.1.2 培养基及微量生化发酵管 营养琼脂培养基,麦康凯琼脂培养基,伊红美蓝营养琼脂培养基,MH肉汤,均为北京奥博星生物技术有限公司产品;微量发酵管,杭州天和微生物试剂有限公司产品。
1.1.3 药敏纸片 庆大霉素,批号:090402;菌必治,批号:090410;链霉素,批号:090327;卡那霉素,批号:090327;阿米卡星,批号:090306;强力霉素,批号:090220;头孢拉定,批号:081011;氧氟沙星,批号:090112;环丙沙星,批号:081212;阿莫西林,批号:090402;头孢氨苄,批号:090203;新霉素,批号:080708;先锋 V,批号:090303;先锋必,批号:080923;羧苄青霉素,批号:090309;痢特灵,批号:080905;氨苄青霉素,批号:090315;头孢噻吩,批号:081201;复方新诺明,批号:081014;四环素,批号:081008;氟哌酸,批号:090410,均为杭州天和微生物试剂有限公司产品。
1.1.4 试验用动物及参考菌株 1日龄未免疫雏鸡60只,购自非疫区孵化场;致病性伤寒沙门菌,由西北农林科技大学动物医学院预防兽医系兽医微生物实验室提供。
1.2 方法
1.2.1 细菌的分离和纯化 取无菌采集的肝、脾、肾分别接种于鲜血琼脂平板上,置37℃温箱中培养24 h。观察细菌生长情况及菌落特征。分别挑取不同菌落涂片、革兰染色、镜检,并进行鲜血琼脂平板划线纯化培养。
1.2.2 细菌的鉴别培养及形态结构观察 挑选纯化培养的单个菌落,接种于鉴别用培养基麦康凯琼脂平板和伊红美蓝琼脂平板,同时分别接种于普通肉汤中,37℃培养24 h,观察不同菌的形态区别及生长情况。
1.2.3 生化试验 从分离出的菌株纯培养物挑选出疑似沙门菌13株(编号为S1,S2,S3,…,S13),分别接种于靛基质、构椽酸盐、尿素、硫化氢、卫矛醇、葡萄糖、蔗糖、乳糖、麦芽糖、赖氨酸、鸟氨酸等鉴定肠杆菌科常用微量发酵管中及三糖铁斜面(TSI),置于37℃温箱中培养72 h,观察其生化反应特性。
1.2.4 药敏试验 以分离菌的肉汤培养物做适当稀释,按纸片扩散法[9]操作,根据杭州天和微生物试剂有限公司提供的“纸片法药敏试验抑菌环直径判断标准(mm)”进行结果判定。
1.2.5 致病性试验 取健康雏鸡45只,随机分为15组,每组3只。2个对照组(鸡伤寒沙门菌感染组和健康对照组)。试验组各组每只雏鸡皮下接种0.2 mL不同分离菌的肉汤培养物。鸡伤寒沙门菌感染对照组每只皮下接种0.2 mL鸡伤寒沙门菌肉汤培养物,健康对照组每只皮下接种等量的灭菌生理盐水。接种后隔离饲养,每日观察并记录雏鸡的精神、食欲、饮水、粪便、运动及死亡情况,记录 10 d内雏鸡的发病和死亡情况。及时剖检病死雏鸡,观察其病理变化,并无菌采集死亡雏鸡的肝脏,接种SS营养琼脂平板,并进行涂片、染色镜检及生化试验。
1.2.6 临床应用 将药敏试验筛选出的阿米卡星对发病鸡场后续发病鸡群采用肌肉注射和硫酸新霉素饮水治疗,并于每千克饲料中加痢特灵0.2 g,连续1周。同时立即对该鸡场的发病鸡进行隔离治疗,对病情严重的应及时深埋处理,加大鸡舍内外的消毒次数,立即制定和实施严格的卫生管理制度,在不同阶段,选择敏感药物及时投喂,勤扫粪便,并观察记录临床效果。
2 结果
2.1 分离菌的培养特性及形态特征
分离菌在伊红美蓝营养琼脂平板上生长呈表面光滑、圆形、微凸、边缘整齐、淡蓝色、直径在1 mm~2 mm的小菌落。在普通琼脂上形成圆形、稍凸起、灰白色、半透明、光滑、湿润、边缘整齐但形态不一的菌落,麦康凯培养基上长出色透明、光滑的圆形小菌落,培养基不变色。挑取单个菌落接种于普通肉汤培养基上,置37℃温箱培养24 h,肉汤呈一致混浊,管底有灰白色沉淀物。
选取单个菌落制成涂片,革兰染色之后,油镜下观察,可发现大量短小、两端钝圆、多数单个存在的革兰阴性小杆菌,无芽胞,无荚膜,无运动能力。
2.2 生化鉴定
13株分离菌生化试验,结果见表1。
表1结果表明,分离菌株对麦芽糖均为产酸产气,葡萄糖产酸产气或不产气,不发酵乳糖、蔗糖;枸橼酸盐和靛基质试验反应为阳性;赖氨酸和鸟氨酸反应为阴性;尿素分解试验为阴性;MR试验为阳性;VP试验为阴性;卫矛醇和甘露醇试验为阴性。在TSI中为产酸、斜面变红、底层反应呈阳性并产硫化氢(H2S)。结果显示13株分离菌均符合鸡伤寒沙门菌的生化特性[10]。
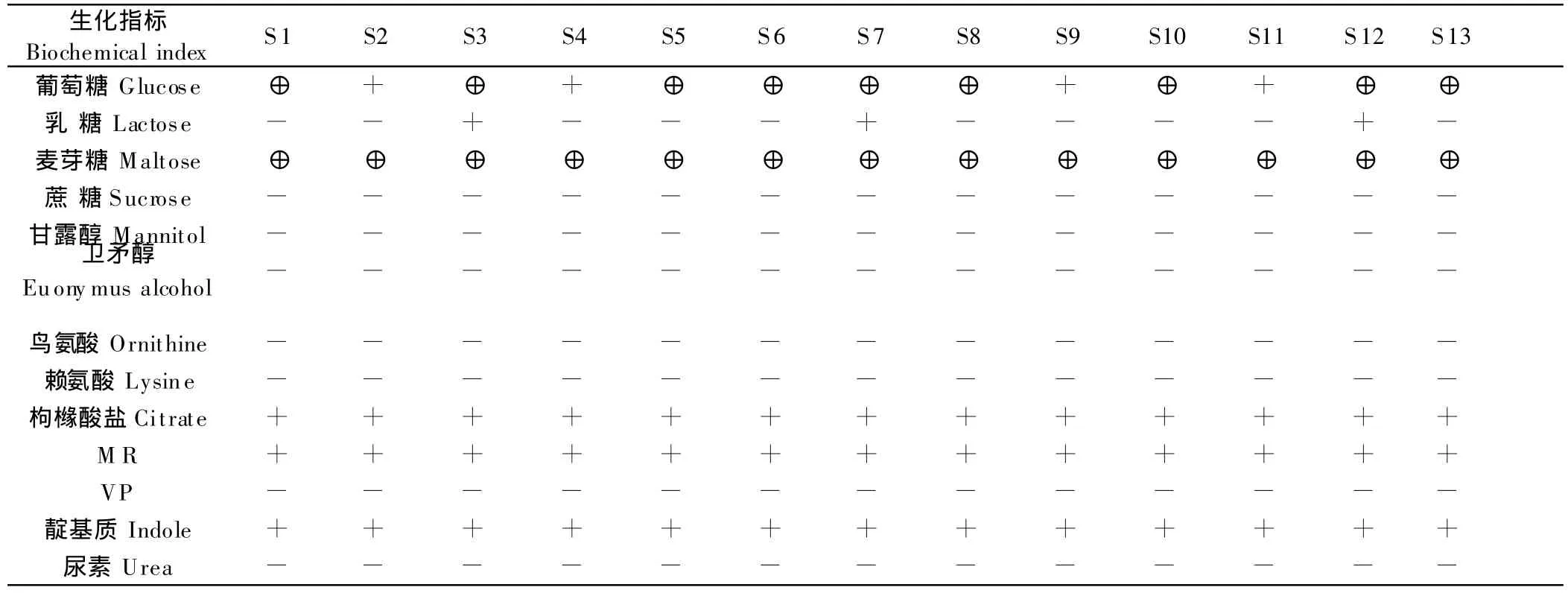
表1 细菌生化和糖发酵试验结果Table 1 The results of biochemical and sugar ferment test of bacteria
2.3 动物致病性试验
13株分离菌的动物致病性试验,结果见表2。
表2结果表明,13株分离菌除S2和S11菌株外,均对雏鸡有较强的致病性,并且在5 d内出现发病与死亡,健康对照组雏鸡生长良好,而致病性伤寒沙门菌组雏鸡全部发病并死亡。
无菌采取病死鸡的肝脏,划线接种于伊红美蓝琼脂培养基上,经37℃培养24h 后,均有无色或琥珀色半透明菌落的菌落生长;取肝组织涂片,革兰染色检查,可见红色的小杆菌,单个或成对存在。
2.4 药敏试验
13株分离菌药敏试验,结果见表3。表3结果显示,分离菌对阿米卡星、新霉素高度敏感,敏感率为100%;对痢特灵、卡那霉素中度敏感,敏感率分别为61.5%、53.8%;而复方新诺明、四环素、先锋必等药物则表现为耐药。
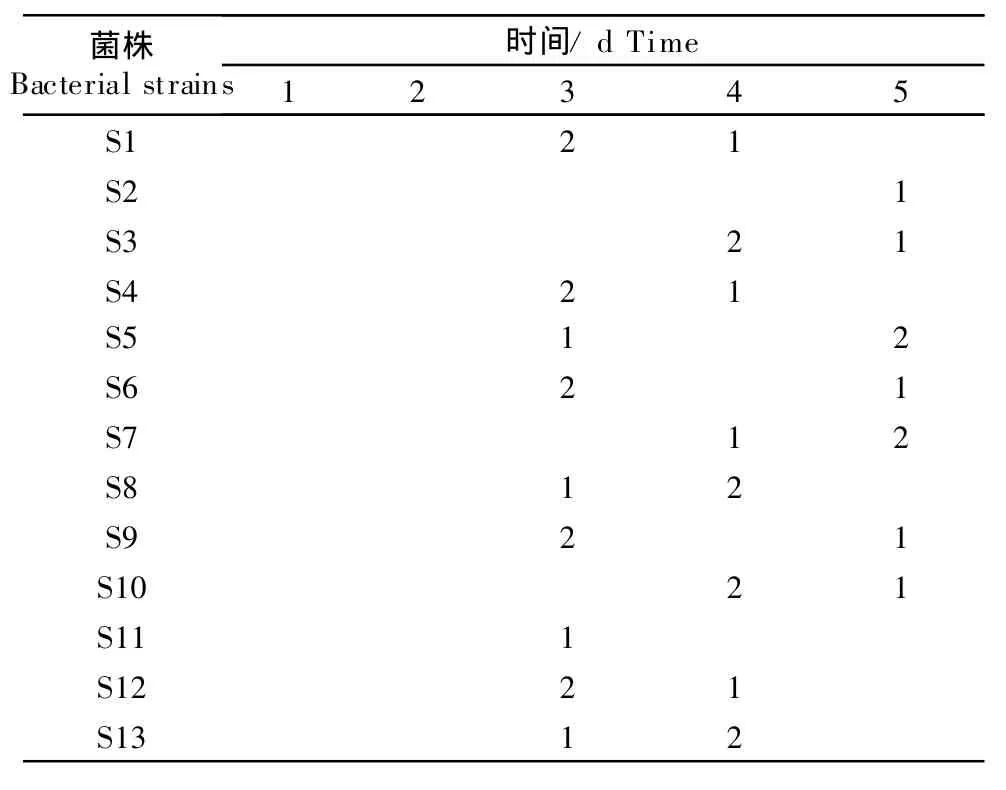
表2 13株分离菌的动物致病性试验结果Table 2 T he results of animal pathogenicity test of 13 isolates
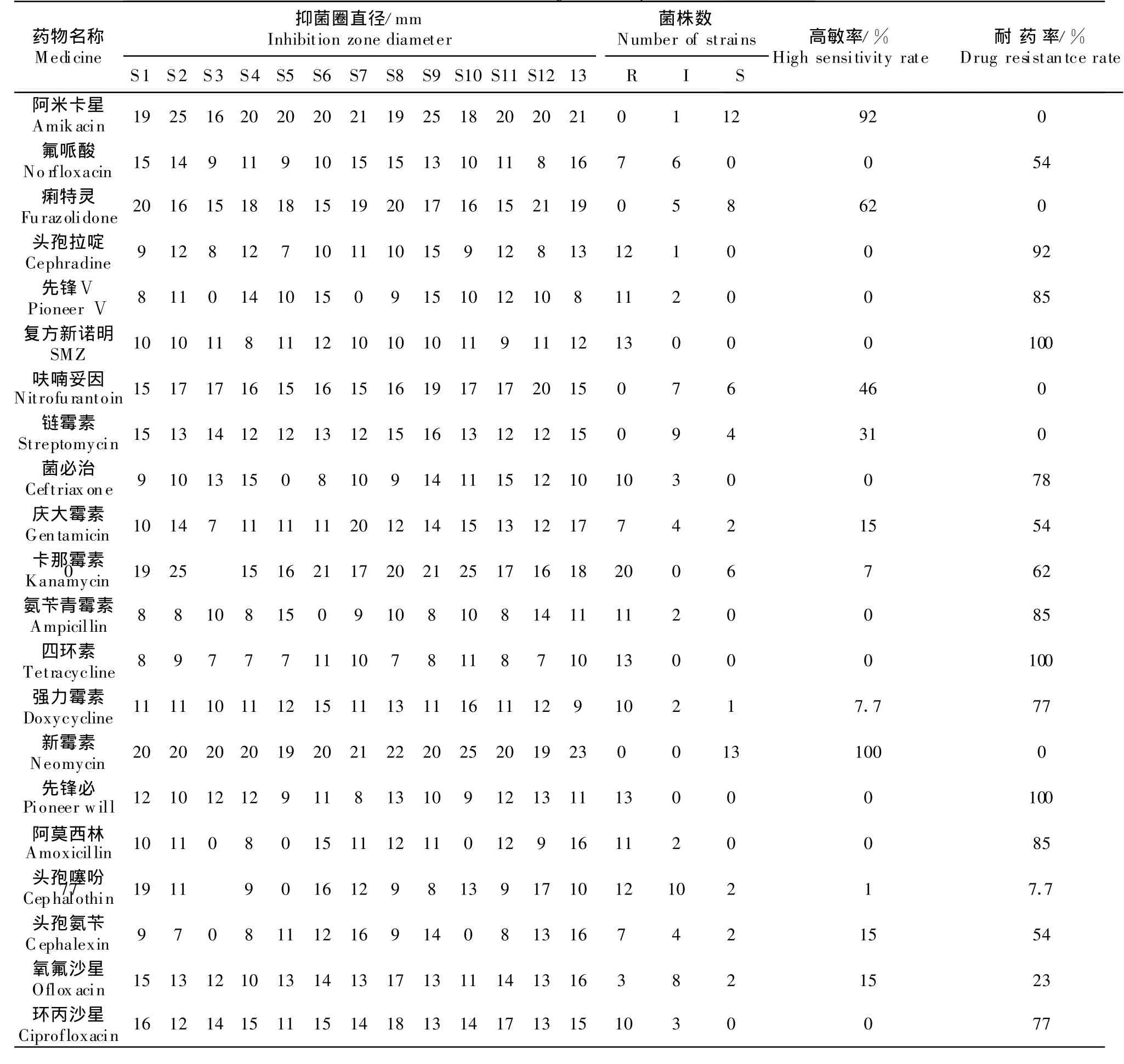
表3 13株分离菌药敏试验情况Table 3 T he results of drug sensitivity test of 13 isolates
2.5 临床应用
将筛选出的阿米卡星对发病鸡场后续发病鸡群采用肌肉注射和硫酸新霉素饮水治疗和痢特灵拌料饲喂后效果显著,用药5 d后,病鸡恢复食欲,精神大大好转,黄绿色稀粪也显著减少,死亡率显著降低,整个鸡群鸡伤寒沙门菌病的发病率从50%降到了5%左右。再用1周后,发病率几乎降为0。
3 讨论
在不同的国家和地区,引起沙门菌病流行的血清型不尽相同,即使同一地区在不同时期,其致病菌株的血清型也会发生改变,而且在同一养殖场同时可发生多种血清型混合感染。不同种类的细菌,由于其细胞内新陈代谢的酶系不同,对营养物质的吸收利用、分解排泄及合成产物的产生等都有很大的差别,细菌的生化试验就是检测某种细菌能否利用某种(些)物质,及其对某种(些)物质的代谢及合成产物,确定细菌合成和分解代谢产物的特异性,借此来鉴定细菌的种类,所以生化特性是进行细菌鉴定的常规指标[11-12]。本次分离的鸡伤寒沙门菌,在生化特性上与以往报道的不尽相同,例如13株菌均不能发酵卫矛醇,其中有3株菌能发酵乳糖,表明该菌株在生化特性上与其他地区的有一定差异性。
鸡伤寒沙门菌对许多抗菌药物敏感,长期以来,药物防控一直是生产中控制该病的主要措施。但反复多次投药既增大了养殖成本,且易出现耐药菌株,给该病的防控带来了极大的困难[13]。本试验选用了21种抗菌药物对所分离到的鸡伤寒沙门菌进行了药敏试验。结果表明,该地区鸡伤寒沙门菌耐药现象较严重,对菌株敏感的药物只有阿米卡星、新霉素、痢特灵、卡那霉素等几种,大多数药物呈不敏感或中度敏感,而该场长期应用复方新诺明、四环素、先锋必类抗菌药物,因而分离株对这几种药物有强的耐药性,由此可得出不同地区用药习惯不同,导致细菌产生的耐药性也不同,该结果与张志峰等[14]及徐仕忠等[15]的报道不同。因此,临床应用药物防控该病时,必须结合药敏试验结果,同时将2种~3种敏感药物进行交替使用,用药时一定要按疗程和足够的剂量。但是,消除该病的最根本的办法仍然是采取全面的饲养管理措施以防止鸡白痢或鸡伤寒沙门菌传染给鸡群,定期检疫淘汰带菌鸡,建立无菌鸡群,消灭传染源,切断垂直传播链锁,从而彻底消灭鸡伤寒沙门菌病。
[1]宋厚辉,王志亮,杜文金,等.鸡沙门氏菌弱毒苗的安全性和免疫效力试验[J].中国预防兽医学报,2000,22(3):202-204.
[2]陆承平.兽医微生物学[M].北京:中国农业出版社,2007:223-231.
[3]陈溥言.兽医传染病学[M].北京:中国农业出版社,2006:119-127.
[4]马 斌.鸡伤寒的类症鉴别诊断与防治[J].农技服务,2008,25(3):57,79.
[5]杨永刚,孙齐田.鸡白痢沙门氏菌病的流行特点[J].畜牧兽医科技信息,2006(3):69-70.
[6]乌仁高娃,赵立军,张 涛.鸡伤寒病的诊断与防治[J].畜牧与饲料科学,2009,30(11-12):74-75.
[7]李建中,何书君,张 程,等.鸡伤寒防治体会[J].疾病防治,2010(11):14.
[8]Zhang Q,Sahin O,McDermott P F,et al.Fitness of antimicrobial-resistantCampy lobacterandSalmonella[J].Microbes Infect,2006,8(7):1972-1978.
[9]Chen S,Zhao S,White D G,et al.Characterization of multipleantimicrobial-resistanceSalmonellaserovars isolated from retail meats[J].Appl Environ Microbiol,2004,70(1):1-7.
[10]中国农业科学院哈尔滨兽医研究所.兽医微生物学[M].北京:中国农业出版社,1998
[11]倪宏波,何宏轩,乔 军.预防兽医学检验技术[M].吉林长春:吉林人民出版社,2002:259-263.
[12]张泽波,崔宝玉.鸡沙门氏菌病防治现状与对策[J].中国动物检疫,2005,22(5):40
[13]Alcaine S D,Warnick L D,Wiedmann M.Antimicrobial resistance in nontyphoidalSalmonella[J].J Food Prot 2007,70(3):780-790.
[14]张志峰,喻华英,贾桂珍.鸡沙门氏菌的分离鉴定及药物敏感试验[J].河南农业科学,2008,26(12):1499-1502.
[15]徐仕忠,杜 蔷,彭海伶,等.鸡伤寒沙门氏菌病的诊治[J].中国兽医杂志,1999,25(4):19.
Isolation,Identification and Drug Sensitivity Test of Fowl TyphoidSalmonella
LIU Su-ying,WANG Jing-yu,DONG Rui,WANG Li-qin,WANG Hui
(College of Veterinary Medicine,Northwest A&F University,Y angling,Shaanxi,712100,China)
To provide the theoretic basis and the reference data for the prevention of fowl typhoidSalmonella,60 chicken's livers and spleens were collectedin this test.According to the morphology,culture characteristics and biochemical tests of bacteria,13 strains ofSamonellawere identified.The results of drug sensitivity tests showed that theSalmonellaisolates were resistant to paediatric compound sulfamethoxazole tablets,tetracycline tablets,cefoperazone sodium,38%of the strains were resistant to furazolidone and kanamycin,none of the 13 isolates were resistant to amikacin and neomycin.So amikacin were used by intramuscular injection,neomycin were used with water,and furazolidon were used with feed to treat fowl typhoid to chickens.After 5 days,the incidence rate decreased from 50%to 5%.
fowl typhoidSalmonella;islation and identification;drug sensitivity test;chichen
S852.612
A
1007-5038(2011)09-0037-05
2011-05-15
刘素英(1968-),女,陕西南郑人,硕士研究生,主要从事动物疫病防控研究。

