山羊传染性胸膜肺炎病原的分离鉴定*
刘 波,郝永清,张爱荣,徐春光,范 鑫
(内蒙古农业大学兽医学院,内蒙古呼和浩特 010018)
山羊传染性胸膜肺炎病原的分离鉴定*
刘 波,郝永清*,张爱荣,徐春光,范 鑫
(内蒙古农业大学兽医学院,内蒙古呼和浩特 010018)
从内蒙古地区山羊病料中分离出疑似山羊传染性胸膜肺炎的病原,经染色镜检、生化鉴定、血清学等方法初步鉴定为山羊支原体山羊肺炎亚种。参照已知山羊支原体ADI基因设计的引物进行PCR扩增,通过电泳分析得到与文献报道相一致的大小为316 bp的条带,最终确定为山羊支原体山羊肺炎亚种。
山羊支原体山羊肺炎亚种;分离;ADI基因;鉴定
*通讯作者
山羊传染性胸膜肺炎(Contagious caprine pleuropneumonia,CCPP)是由支原体引起的山羊的一种接触性传染病,以高热、咳嗽、精神萎靡为主要特征,发病率为22%~30%,有的地区高达60%~80%,死亡率为15%~30%。对世界各国的养羊业带来巨大的损失,我国于1935年在内蒙古百灵庙地区曾流行过山羊的“烂肺病”。后来在山西、河北、山东、湖北、云南、江西、新疆以及内蒙等地均有本病的发生[1]。
山羊支原体山羊肺炎亚种(M.capricolumsubsp.capripneumoniae,Mccp)是山羊传染性胸膜肺炎的主要病原之一。由于其体外分离困难,直到1976年才由Macowan于肯尼亚分离到世界上第一株Mccp(命名为F38)并且验证了其致病性。山羊支原体山羊肺炎亚种属于丝状支原体簇,除了Mccp外,还包括:山羊支原体山羊亚种(Mycoplasma capricolumsubspcapricolum,Mcc);丝状支原体丝状亚种 SC型,(Mycoplasma mycoidessubsp.mycoidesSC,MmmSC):丝状支原体丝状亚种 LC型(M.mycoides.subspmycoideslarge colony LC,MmmLC):丝状支原体山羊亚种(M.mycoidessubsp.capri,Mmc):牛支原体第七群(Mycoplasmasubsp.bovinegroup 7,Mbg7)。我国学者辛九庆、李媛和张建华等[2]于2007年从山东分离出来一株Mccp,这是国内首次报道从临床病例中分离到Mccp。
通常认为,丝状支原体簇的分类鉴别生化试验不能准确鉴定分离株;常规鉴定方法如生长抑制试验、生长沉淀试验、凝胶沉淀试验、凝集试验、补体结合试验等检测手段经常会出现一些非特异性反应或因为操作复杂等多种原因而不能准确的鉴定支原体肺炎亚种。因此,建立特异的分子生物学诊断方法对丝状支原体簇菌株的鉴定有重要意义,可以为分子流行病学研究提供较为准确的诊断工具,并为该类疾病的环境适应性进化和基因组多态性研究奠定基础,为不同地区该类疾病的预防和治疗提供流行病学依据[3]。
1 材料与方法
1.1 材料
发病山羊,为包头市蒙兴养殖公司疑似发病山羊50只。支原体基础培养基,支原体培养基添加剂(购自OXOID)。山羊支原体山羊肺炎亚种标准株(PG3),购自中国兽药监察所。山羊支原体山羊肺炎亚种阳性血清,本实验室制备。
1.2 方法
1.2.1 病料的采集 通过观察,选取症状典型的山羊进行扑杀,解剖,无菌采集肺部的病健交界处组织,肝脏的病健交界处组织和气管。
1.2.2 病原的分离鉴定
1.2.2.1 分离培养 将采集的新鲜病料去除浆膜,取深层组织一小块,用灭菌的手术剪将该组织完全剪碎,再加少量的生理盐水混合均匀,将组织液分装于1.5 mL的EP管2 000 r/min离心2 min~3 min,取上清1 mL、0.3 mL分别接种于支原体液体和固体培养基中培养。由于支原体属兼性厌氧菌,而且在体积分数为5%的CO2和一定的湿度环境中生长良好,本次培养采用“烛光”法,即在干燥器中放置蜡烛,并加少许无菌水以保持湿度,密封后37℃进行培养。每隔24 h观察1次,如果发生污染,应及时用0.45 μ m的无菌滤器过滤继续培养。一般将液体生长6 d~7 d的支原体通过对培养基颜色变化的观察进行选取,将颜色变浅的菌株进行纯化和传代;固体培养基则通过显微镜的观察,选取单个菌落,用手术刀抠取放入液体培养基中纯化和传代。重复该步骤3次~5次,最后将得到的单菌落培养物加100 mL/L的牛血清4℃保存[4]。
1.2.2.2 染色镜检 将疑似支原体菌株用姬姆萨染色、镜检。接种到固体培养基的支原体可在低倍显微镜下进行观察。
1.2.2.3 生化鉴定 参照Freundt等的方法进行发酵葡萄糖试验、水解精氨酸试验、尿素分解试验、美蓝还原试验、膜斑形成试验、血清液化试验、菌落吸附红细胞试验[5]。
1.2.2.4 血清学鉴定
疑似病羊血清的收集。采集疑似传染性胸膜肺炎的山羊采血10 mL,摆斜面静置30 min,无菌收集血清,置-20℃备用。
抗原的制备。将纯培养的支原体在 4℃以12 000 r/min离心30 min,将沉淀用 PBS洗2次,然后超声波200 W破碎10 min,取上清加20 g/L的色素,置-20℃保存备用。
凝集试验。将制备的抗原与患病羊血清各25 μL滴到玻板上,充分混匀,5 min后观察凝集现象。其中A组用病羊血清+抗原,B组用阳性血清+抗原,C组用阴性血清+抗原,D组用生理盐水+抗原。
1.2.2.5 PCR鉴定
引物的合成。通过同源性比较发现山羊支原体山羊肺炎亚种GL100株的ADI基因在丝状支原体簇中有一定的保守性,其多肽性在0.6%~3.5%波动,但其中差异最大的是编码arcD基因,因此该基因可以区分丝状支原体的簇的不同株。应用已有的针对山羊支原体山羊肺炎亚种的特异引物序列:Mccp-spe-F:5′-ATCATT TT TAATCCCT TCAAG-3′;Mccp-spe-R,5′-TACTATGAGTAATTATAATATATGCAA-3′[6-7]。
DNA提取。取培养好的支原体50 mL,12 000 r/min离心 30 min,用 PBS洗涤 2次,收集沉淀,再以酚-氯仿法提DNA。
PCR反应体系及条件。按常规体系加TaqDNA 聚合酶 12.5 μL,DNA 模板 5 μL,上下游引物各 1 μL(5 μ mol/mL),最后加双蒸水至总体积25 μL 。
扩增条件为:94℃预变性5 min;95℃变性30 s,57℃退火45 s,72℃延伸45 s,循环35次;最后72℃延伸10 min。
PCR扩增产物的分析。取扩增产物5 μL加入10 g/L的琼脂糖凝胶点样孔中,120 V,电泳 30 min,最后用凝胶成像仪观察结果。
2 结果
2.1 分离培养
2.1.1 支原体在液体培养基生长情况 疑似菌在液体培养基上培养5 d~6 d就可见培养基颜色变浅;同时做标准对照,但是标准菌株生长缓慢,培养基10 d才有轻微的变浅。
2.1.2 支原体在固体培养基生长情况 将疑似菌株接种于固体培养基,4 d~5 d长出菌落,菌落大小不一,大的直径有0.8 cm,小的直径只有0.2 cm~0.4 cm,典型煎蛋状菌落较少;同时做标准对照:标准菌在选择培养基上6 d~7 d才有菌落生长,并且菌落较大,呈典型煎蛋状菌落
2.1.3 分离与纯化 将典型单个菌落重复培养4次~5次,得到的单菌落培养物8株,分别为AM1 AM2、AM3、AM4 、AM5、AM6、PM1、PM2 在其固体培养基上可见大小较为均一的0.3 cm~0.5 cm的菌落,肉眼观察典型的煎蛋状菌落多为较小菌落。低倍镜下观察,可见小菌落也有煎蛋状;与标准株的大小,形状相似。
2.2 鉴定结果
2.2.1 临床症状 主要病变表现为胸腔积水、肺部有出血或大范围的虾肉样变、隔膜粘连等。
2.2.2 染色镜检 传代生长稳定的疑似菌株,革兰染色不易着色,染色为阴性;瑞特、姬姆萨染色较好;油镜下观察可见长杆状、球状及多形性;多数菌体聚集排列在一处,少数菌体单个散在的存在,并且多为杆状、长短不一(图1);标准菌株染色特点与上述一致,镜检也与疑似菌株相似,但是其杆状的较少、较短,且也多为散在存在。
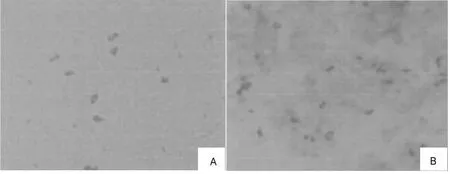
图1 分离株姬姆萨染色结果(1 000×)Fig.1 Giemas staining of the isolate(1 000×)
2.3 培养特性
接种固体培养基4 d~5 d开始生长,菌落平均大小为0.4 cm~0.6 cm,但只有零星的几个,个别几株为典型的煎蛋状(图2);与标准菌株基本一致。

图2 标准株固体培养基菌落形态(40×)Fig.2 T he colonial morphology on solid medium(40×)
2.4 生化鉴定结果
结果见表1。

表1 分离菌株生化鉴定结果Table 1 T he results of biochemical idenfication of the nine isolates
2.5 血清学鉴定结果
结果见表2。
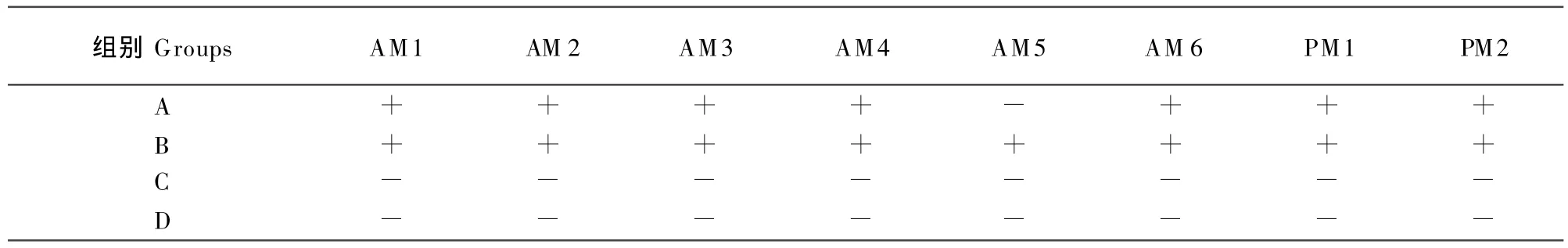
表2 分离株血清学试验结果Table 2 The results of serological test of the nine isolates
2.6 PCR结果
将PCR产物进行电泳分析,结果得到了大小为316 bp的条带,与预期的条带大小一致(图3)。
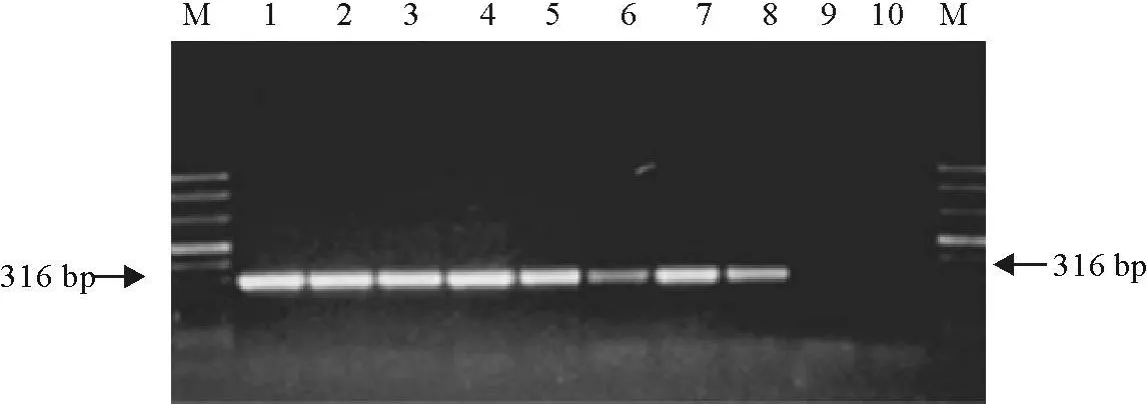
图3 PCR扩增产物电泳图Fig.3 The results of agarose gel electrophoresis of PCR products
3 讨论
3.1 山羊支原体肺炎亚种的分离培养
Mccp能在人工培养基上生长,这一点与细菌相同,但其营养要求及培养条件苛刻。由于Mccp的基因组很小,其生物合成能力较低,生长需要外源性胆固醇、核酸前体、维生素等。
病料的污染程度及病料中的Mccp的含量对于Mccp分离成功与否有重要的影响。本试验培养基添加剂中虽然加入了青霉素和醋酸铊,但培养过程中个别仍有污染。也有多份病料未分离到Mccp,分析原因,可能病料本身无Mccp,还可能因为在采集病料之前对病羊进行过药物治疗而影响分离结果。
初次分离Mccp需培养较长的时间才能观察到菌落生长,且由于Mccp菌落极小,所以培养5 d后应每日仔细观察其生长状况,至少持续1周,以免将刚长出微小菌落的培养基误作废弃处理。
3.2 关于Mccp的鉴定
通过形态及培养特征、常规生化鉴定及血清学鉴定,可对Mccp分离株作出比较准确的鉴定,但这些方法均存在假阳性、操作繁琐、费时等缺点。
大量的试验证明用PCR技术可检测到极微量的支原体DNA,其方法快速、简便、特异且敏感。同时PCR方法对支原体感染的早期诊断有重要的意义,而引物选择是PCR检测特异性和敏感性的关键。本试验所选引物有高度的特异性,它能区分丝状支原体簇的不同株,从分子生物学上鉴定了山羊支原体山羊肺炎亚种。
[1]储岳峰,赵 萍,高鹏程,等.从山羊中检测山羊支原体山羊肺炎亚种[J].江苏农业学报,2009,25(6):1442-1444.
[2]辛九庆,李 媛,张建华,等.一株山羊支原体山羊肺炎亚种的分离鉴定与分子特征[J].中国预防兽医学报,2007,29(4):243-248.
[3]杜永凤,文心田,曹三杰,等.山羊传染性胸膜肺炎病原分离鉴定[J].中国预防兽医学报,2006,28(6):618-621.
[4]程光胜.山羊传染性胸膜肺炎病原分离及诊断方法[D].重庆:中国优秀硕士学位论文全文数据库,西南大学,2006.
[5]李 媛,陶 岳.湖羊肺脏中分离绵羊肺炎支原体的鉴定[J].中国预防兽医学报,2006,28(4):375-379.
[6]Li Y,Zhang J H,Hu S P,et al.Reclassification of the four China isolated strains of the pathogen for contagious caprine pleuropneumonia[J].Wei Sheng Wu Xue Bao,2007,47(5):769-773.
[7]Woubit S,Lo renzon S,Peyraud A,et al.A specific PCR for the identification of My coplasma capricolum subsp.capripneumoniae,the causative agent of contagious caprine pleuropneumonia(CCPP)[J].Vet Microbiol,2004,104(1/2):125-132.
Isolation and Identification of the Pathogens of Caprine Contagious Pleuropneumonia
LIU Bo,HAO Yong-qing,ZHANG Ai-rong,XU Chun-guang,FAN Xin
(College of Veterinary Medicine,Inner Mongolia Agricultural University,Huhhot,Inner Mongolia010018)
The pathogens were isolated from samples collected from goats probably infected with pleuropneumonia in Inner Mongolia.According to their morphological,physiological,biochemical,and serological characteristics, the strains were identified preliminarily asMycoplasmacapricolumsubsp.capripneumoniae.A specific polymerase chain reaction was developed for identification,which specific primer pairs were designed on the basis of the target genes coding for the arginine deiminase pathway(ADI).Agarose electrophoresis showed that the DNA fragment of 316bp was amplified,which was consistent with the report by some literatures.Finally,it was determined that the isolates belonged toMycoplasma capricolumsubsp.capripneumoniae.
Mycoplasma capricolumsubsp.capripneumoniae;isolate;ADI gene;identification
S852.62
A
1007-5038(2011)09-0076-05
2011-01-29
刘 波(1984-),男,陕西榆林人,硕士,主要从事山羊支原体的研究。
——和田盘羊

