禽流感病毒NS1蛋白亚细胞定位研究
朱春玉,孙婷婷,郑方亮,艾海新,朱俊丰,王 宁,商玲玲,刘宏生
(辽宁大学生命科学院辽宁省高校动物资源与疫病防治重点实验室,辽宁沈阳110036)
禽流感病毒NS1蛋白亚细胞定位研究
朱春玉,孙婷婷,郑方亮,艾海新,朱俊丰,王 宁,商玲玲,刘宏生*
(辽宁大学生命科学院辽宁省高校动物资源与疫病防治重点实验室,辽宁沈阳110036)
为深入研究NS1蛋白的生物学功能,了解NS1蛋白在哺乳动物细胞中的分布和亚细胞定位情况。采用RT-PCR扩增出禽流感病毒NS1基因片段,克隆至载体pEGFP-N1,经酶切和测序鉴定后,将构建的重组质粒pEGFP-N1-NS1经脂质体介导转染293T细胞和Hela细胞,在荧光显微镜和激光扫描共聚焦显微镜下观察NS1在细胞中的分布、亚细胞定位情况。成功构建了真核重组表达质粒pEGFP-N1-NS1,并在293T细胞及Hela细胞中得到高效表达。融合蛋白发出的绿色荧光表明NS1蛋白主要分布在细胞核,在胞浆中有少量表达。本研究成功在哺乳动物细胞中表达NS1蛋白,并对其进行亚细胞定位,为流感病毒的相关功能研究奠定了基础。
禽流感病毒;NS1蛋白;亚细胞定位
*通讯作者
禽流感(Avian influenza,AI)是由A型流感病毒(Avian influenza virus,AIV)引起的从呼吸系统病变到全身败血症的一种高度接触性急性传染病,已导致家禽及鸟类的普遍感染并对人类造成了严重的威胁[1]。进入21世纪后,禽流感在全球愈演愈烈,呈现世界范围流行的趋势。据世界卫生组织(WHO)报道,截止2011年4月,全球人类感染H5N1亚型流感病毒的539个病例中已有318人死亡,病死率达到60%。禽流感不仅给养禽业造成了巨大的损失,而且严重威胁到人类健康和安全。
A型流感病毒的基因组为单股负链节段RNA,分为8个基因片段,编码11种蛋白,NS1蛋白(nonstructural protein 1,NS1)是A型流感病毒惟一的非结构蛋白,由第8个基因编码,可编码202个~237个氨基酸(amino acid,AA),不同毒株有差异,是一个具有多种活性的调控因子[2]。NS1蛋白是一种多功能调节蛋白,它可与宿主细胞内多种蛋白质分子相互作用,产生复杂的生物学效应,从而有利于病毒的复制和增殖。
先前的研究发现,A型流感病毒的NS1蛋白含有两个核定位信号(nuclear localization signal,NLS),一个位于氨基端第35位~41位氨基酸,另一个位于羧基端第219位~230位氨基酸(个别流感病毒株NS1蛋白有237个氨基酸,此时其第2个NLS在219位~232位氨基酸)[3-4]。由于蛋白质在细胞内的定位和分布方式可能关系到其生物学功能的正常发挥,为了进一步深入了解NS1蛋白在调节流感病毒的致病性及毒力方面发挥的重要作用,本研究构建了增强型绿色荧光蛋白EGFP与NS1基因直接嵌合生成的真核表达载体pEGFP-N1-NS1,以表达产生融合蛋白,用其转染293T细胞和Hela细胞,观察NS1蛋白在哺乳细胞中的分布和亚细胞定位,为进一步研究NS1蛋白的生物学功能提供重要依据。
1 材料与方法
1.1 材料
1.1.1 病毒、载体和细胞 H5N1亚型禽流感病毒A/chicken/Hubei/327/2004(H5N1)为武汉大学病毒学国家重点实验室分离保存;pEGFP-N1载体为Clontech公司产品;大肠埃希菌E.coliDH5α为本实验室保存;293T和Hela细胞为武汉大学病毒学国家重点实验室分离保存。
1.1.2 主要试剂 DNA Marker DL 2 000、DNA Ploymerase、dNTP、限制性内切酶EcoRⅠ、BamHⅠ和T4DNA连接酶均为宝生物工程(大连)有限公司产品;PCR产物纯化(小量)试剂盒、胶回收(小量)试剂盒、质粒(小量)抽提试剂盒均为北京博大泰克生物基因技术有限责任公司产品;脂质体(LipofectamineTM 2000)为Invitrogen公司产品;多聚甲醛为Sigma公司产品;DAPI为Roche公司产品;其他化学试剂均为国产分析纯。
1.2 方法
1.2.1 NS1基因的扩增 采用常规方法,从接种H5N1亚型AIV的鸡胚尿囊液中提取病毒基因组RNA,进行RT-PCR扩增。以所得的cDNA为模板,根据GenBank收录的NS全基因序列(GenBank登录号为:AY684710)中NS1编码区序列设计一对引物 P1、P2,上游引物 Pl:5′-CCGGAATTCTAATGGATTCCAACACTGTGTCAAGC-3′, 带 有EcoRⅠ酶切位点;下游引物 P2:5′-CGGGGATCCCGAACTTTTGACTCAATTGTTCTCGC-3′,带有BamH I酶切位点,特异性扩增NS1编码基因,引物由上海英骏公司合成。PCR反应参数为:94℃预变性5min;94℃1min,58℃1min,72℃1min,35个循环;72℃延伸10min。PCR产物经10g/L琼脂糖凝胶电泳鉴定。
1.2.2 真核表达载体pEGFP-N1-NS1的构建及鉴定 将PCR扩增的NS1基因片段和真核表达载体pEGFP-N1用EcoRI、BamHI双酶切,纯化后,用T4DNA连接酶16℃连接过夜,然后YC法转化大肠埃希菌DH5α感受态细胞,37℃培养12h~16h,挑单菌落扩大培养,经双酶切鉴定筛选出阳性重组子。将鉴定为阳性的重组质粒送北京华大基因有限公司测序。序列确证无误后命名为pEGFP-N1-NS1。
1.2.3 293T细胞和Hela细胞的培养 293T细胞和Hela细胞于含100mL/L胎牛血清(FBS)、含双抗(100单位/mL青霉素和100μg/mL链霉素)的DMEM(GIBCO)培养基中37℃、体积分数为5%的CO2条件培养,传代。
1.2.4 真核表达载体pEGFP-N1-NS1的转染及融合蛋白的表达 在转染前1d将待转染细胞以合适的细胞密度接种到铺有消毒盖玻片的6孔板中,37℃培养,待细胞生长至70%~80%汇合度时,参照Lipofectamine TM2000说明书将重组质粒pEGFP-N1-NS1转染293T细胞和Hela细胞,转染步骤如下:4μg重组质粒和10μL Lipofectamine 2000中分别与无血清培养基混合,室温下孵育5min。将稀释好的重组质粒与Lipofectamine2000再混合,室温下孵育20min,均匀滴入相应培养皿中,摇匀。转染后6h换用含血清的DMEM培养基,转染不同时间点(24 、48 、72h)用倒置荧光显微镜(Olympus IX70)动态观察细胞形态及绿色荧光蛋白的表达情况。
1.2.5 Western blot检测 转染后48h,用胰酶消化细胞,在4℃以4 000r/min离心5min,PBS洗3次,向细胞沉淀中加入裂解液(50mmol/L Tris-HCl pH7.5,150mmol/L NaCl,10mL/LTritonX-100,0.5mmol/L PMSF)冰上孵育30min,超声破碎后12 000r/min离心10min,取上清,Bradford法测定蛋白浓度。经SDS-PAGE电泳后进行电转印,转印条件为90V2h。将转印后的硝酸纤维素膜放入50 g/L脱脂奶粉中封闭1h,将硝酸纤维素膜与抗EGFP的标签抗体孵育2h,用TBST洗涤3次,再与辣根过氧化物酶标记的二抗37℃作用1h,用TBST洗涤3次,再经TBS洗涤3次后,显色,进行免疫印记分析。
1.2.6 激光扫描共聚焦显微镜观察NS1蛋白的亚细胞定位 转染24h后,吸出培养液,用无血清培养基或PBS洗1次,加入40g/L多聚甲醛固定细胞,室温孵育20min,用PBS轻轻洗涤3次后加入DAPI进行核染色,同时轻晃培养板使染液均匀平铺于细胞层表面,避光,室温下染核5min,PBS洗涤多次,将盖玻片细胞面缓慢平放于有300mL/L甘油的载玻片上封片,避光保存,尽快于激光扫描共聚焦显微镜下观察NS1蛋白的分布与定位情况。
2 结果
2.1 NS1基因的克隆
以提取的H5N1亚型AIV RNA为模板,用设计的引物对H5N1亚型AIV RNA反转录的cDNA进行PCR扩增,产物经10g/L琼脂糖凝胶电泳分析,在687bp处出现一特异条带(图1),与预期结果一致。
2.2 真核表达载体pEGFP-N1-NS1的构建
真核表达载体pEGFP-Nl-NS1经EcoRⅠ和BamHⅠ双酶切后,进行10g/L琼脂糖凝胶电泳,出现大小约为687bp的目的基因片段,其和NS1基因分子大小一致,表明NS1基因片段已克隆于载体pEGFP-N1中(图2)。DNA测序结果表明,NS1基因已正确插入pEGFP-N1载体中,插入序列无误,阅读框正确,命名为pEGFP-N1-NS1。
2.3 真核表达载体pEGFP-N1-NS1的融合表达
转染后在不同时间点(24、48、72h)分别用倒置荧光显微镜动态观察细胞形态及绿色荧光蛋白的表达情况,结果发现融合的绿色荧光蛋白在细胞内的分布方式和表达情况并没有随着时间的延长而发生改变,考虑到24h绿色荧光强度已达到高峰,因此我们选用24h作为进行亚细胞定位的时间点。
2.4 EGFP-NS1融合蛋白 Western blot检测
NS1蛋白分子质量为28ku,EGFP蛋白分子质量为27ku,融合蛋白EGFP-NS1的分子质量为55 ku左右。将融合蛋白表达载体pEGFP-N1-NS1转染293T细胞系48h后,进行Western blot分析,结果显示,融合蛋白在分子质量55ku处出现一条蛋白条带(图3),说明融合蛋白中的NS1为全长,与预期结果一致。

图1 NSl基因RT-PCR电泳结果Fig.1 Agarose gel analysis of NS1gene by RT-PCR
2.5 NS1蛋白的亚细胞定位分析
将pEGFP-N1-NS1质粒DNA用脂质体法转染293T细胞。24h后,经过DAPI染色细胞核,在488 nm波长激发光下,在激光共聚焦显微镜下观察并拍照。EGFP融合蛋白被激发出绿色荧光(图4)。结果显示EGFP-NS1融合蛋白主要分布于细胞核内,在胞浆中也有少量的表达,而作为对照的EGFP蛋白则弥漫性分布于胞浆和细胞核中。重组质粒在同样的条件下转染Hela细胞系也获得相同的结果(图5)。
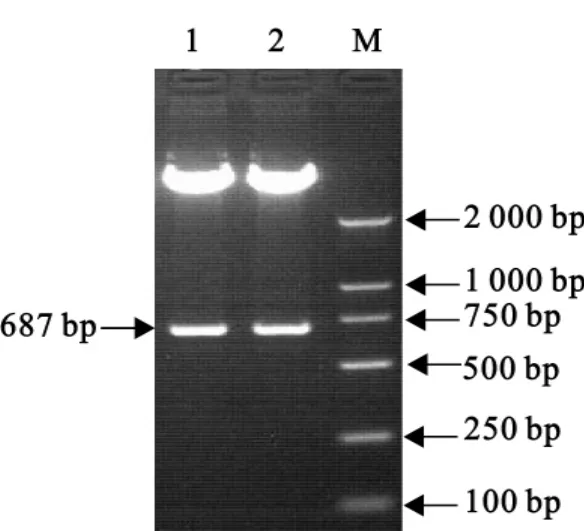
图2 重组质粒pEGFP-N1-NS1的双酶切鉴定Fig.2 Enzyme digestion identification of recombinant plasmid pEGFP-N1-NS1

图3 融合蛋白Western blot分析Fig.3 Western blot analysis of fusing protein
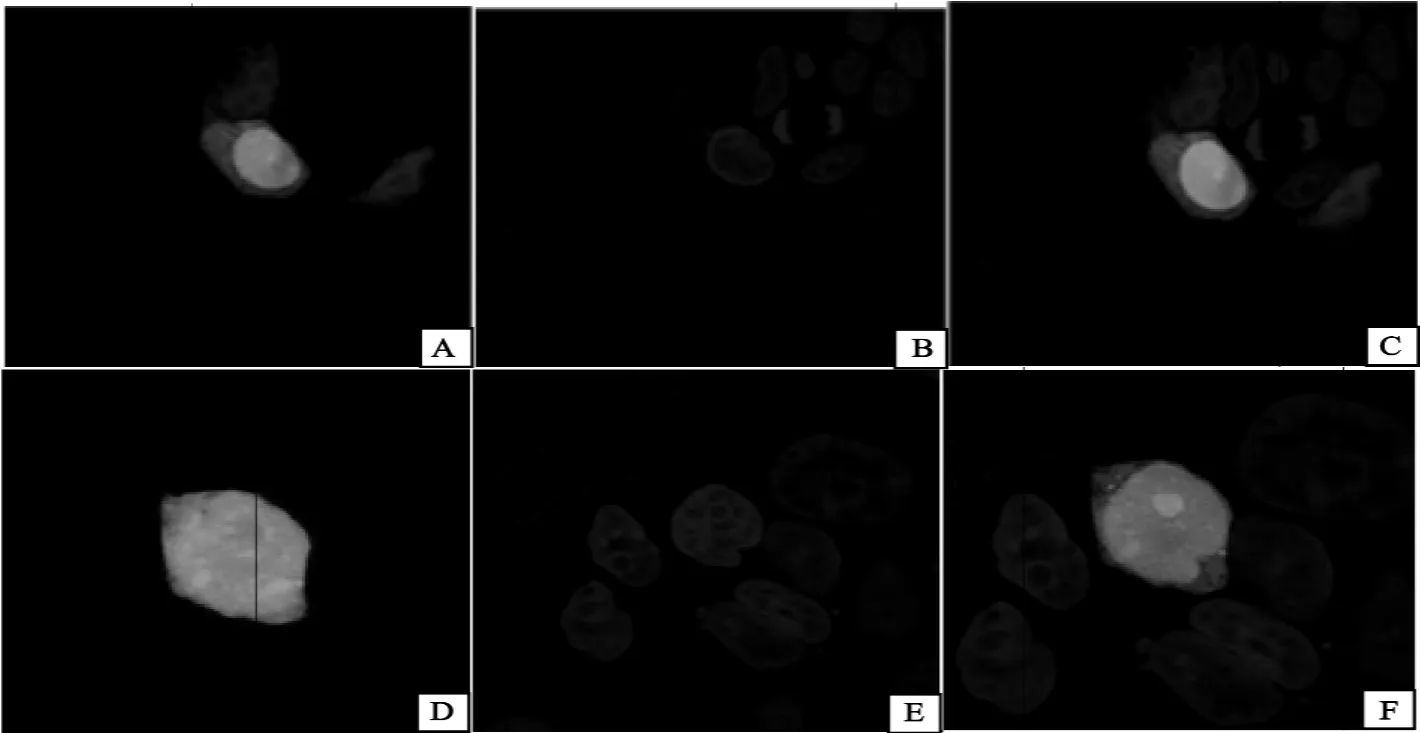
图4 NS1蛋白在293T细胞中的定位(1 000×)Fig.4 Cellular localization of NS1protein in 293Tcells(1 000×)

图5 NS1蛋白在Hela细胞中的定位(1 000×)Fig.5 Cellular localization of NS1protein in Hela cells(1 000×)
3 讨论
NS1蛋白是流感病毒惟一的非结构蛋白,在调节流感病毒的致病性及毒力方面发挥着重要的作用,它可能是H5N1亚型禽流感病毒高致死率的关键所在[5]。它的定位研究可以为探索其功能提供一个辅助的证据。本研究成功构建了增强型绿色荧光蛋白EGFP与NS1蛋白融合的真核表达载体pEGFP-N1-NS1,转染人宫颈癌(Hela)细胞和人胚肾(293T)细胞,通过对绿色荧光蛋白的检测证实目的基因在真核细胞中表达。为了进一步观察NS1蛋白在细胞中的分布、亚细胞定位情况,我们进一步将带有EGFP-NS1融合蛋白的真核表达载体pEGFPN1-NS1转染细胞24h后于激光扫描共聚焦显微镜下观察,研究结果表明,pEGFP-N1空载体转染的各种细胞中表达的荧光在细胞核和细胞质内基本均一,而pEGFP-N1-NS1转染的各种细胞中表达的绿色EGFP-NS1融合蛋白主要分布于细胞核,少量分布于细胞质中。
NSl的分布可能依赖如下几个因素:①病毒毒株;②NSl的表达水平;③细胞固定程序;④使用的细胞类型;⑤细胞极性;⑥感染后的时间[6-8]。本次研究发现,NS1蛋白主要定位在细胞核,在胞浆内也有少量的表达,其可能的原因是:由于NS1包含1个或2个核定位序列(NLS),因不同毒株而异。NLS1位于35~41残基,高度保守,牵涉到3个残基(Arg-35、Arg-38、Lys-41)。NLS1既结合细胞输入子-α而介导NS1的核导入,也参与结合dsRNA,暗示 NS1具有核输入dsRNA的能力[9]。另外,NS1在胞浆中也有少量的分布,可能NS1中存在1个潜在的核输出信号(NES)导致它的核-细胞质运输。NLS和NES之间存在竞争,当NLS在核内与其他蛋白质相互结合时,此时NES处于优势,进行核输出。这一分子机制还有待确认,但细胞的特定因子在NS1的细胞定位中很可能扮演着关键角色[10]。
EGFP是一种优化的突变型GFP,它可在450 nm~490nm的蓝光激发下发出绿光。EGFP作为一种基因表达的标记物,其优点在于:①不干扰细胞的生长和功能。携带EGFP的融合蛋白既具有绿色荧光,又保持靶蛋白的生理功能,而且对细胞无毒性作用,因而能在活细胞状态下检测基因表达。②观察更为方便。将EGFP融合基因转染至真核细胞中表达后,可以方便地通过观察活细胞中EGFP融合蛋白的绿色荧光布局,分析未知基因表达蛋白在细胞中的分布和定位。③EGFP标记方法比免疫组织化学及传统的标记方法具有更高的灵敏度和分辨率。因此,EGFP作为一种极具潜力的标记物为研究基因功能及表达调控提供了极大的便利[11]。本研究选用带有EGFP报告基因的pEGFP-N1载体,通过观察EGFP-NS1融合蛋白的表达情况可以较为方便地反映NS1蛋白的表达及亚细胞定位,试验可见转染细胞发出明亮的绿色荧光,细胞核呈强绿色荧光,EGFP-NS1融合蛋白在细胞核内呈聚集趋势。本研究用EGFP作为标记物来观察未知基因表达蛋白在细胞中的分布和定位,为进一步研究新基因的功能提供了线索和思路。
综上所述,本研究构建的pEGFP-N1-NS1重组质粒在细胞中得以高效表达,EGFP-NS1融合蛋白在细胞中具有核定位效应,因此pEGFP-N1-NS1可以作为研究NS1在细胞中分布和亚细胞定位的有效工具,为NSl执行其功能提供新的定位点,对阐明禽流感病毒的致病机理及对禽流感疾病的治疗都有一定的理论意义和实际价值。
[1] Zhang W,Wang C Y,Yang S T,et al.Inhibition of highly pathogenic avian influenza virus H5N1replication by the small interfering RNA targeting polymerase A gene[J].Biochemi Biophy Res Communica,2009,390(3):421-426.
[2] Bornholdt1ZA,Prasad B V.X-ray structure of NS1from a highly pathogenic H5N1influenza virus[J].Nature,2008,456(18):985-989.
[3] Melen K,Kinnunen L,Fagerlund R,et al.Nuclear and nucleolar targeting of influenza A virus NS1protein:striking differ-ences between different virus subtypes[J].J Virol,2007,81(11):5995-6006.
[4] Murayama R,Harada Y,Shibata T,et al.Influenza A virus nonstructural protein 1(NS1)interacts with cellular multifunctional protein nucleolin during infection[J].Biochemi Biophys Res Communica,2007,362(4):880-885.
[5] Hirotaka I,Kyoko S,Ryo T,et al.The HA and NS genes of human H5N1influenza A virus contribute to high virulence in ferrets[J].PLoS Pathogens,2010,6(9):1106-1119.
[6] Volmer R,Mazel S B,Volmer C,et al.Nucholar localization of influenza A NSl:striking differences between mammalian and avian cells[J].J Virol,2010,7(63):1743-1750.
[7] Sehneider J,Dauber B,Melen K,et al.Analysis of influenza
B virus NSl protein trafficking reveals a novel interaction with nuclear speckle domains[J].J Virol,2009,83(2):701-711.[8] Matsuda M,Suizu F,Hirata N,et a1.Characterization of the interactionof influenza virus NSl with Akt[J].Biochemi Biophys Res Communica,2010,395(3):312-317.
[9] Mahmoudian S,Auerochs S,Groche M,et al.Influenza A virus proteins PBl and NSl are subject to functionally important phosphorylation by protein kinase C [J].J Gene Virol,2009,90(6):1392-1397.
[10] 刘贵生,罗青平,冯 政,等.甲型流感病毒多功能蛋白质NSl的研究进展 [J].中国畜牧兽医,2010,37(12):193-209.
[11] Jacob T,Hemavathy K,Jacob J,et al.A nanotechnologybased delivery system:Nanobots.Novel vehicles for molecular medicine[J].J Cardiothoracic Surgery,2011,52(2):159-167.
Subcellular Localization of Avian Influenza Virus NS1 Protein
ZHU Chun-yu,SUN Ting-ting,ZHENG Fang-liang,AI Hai-xin,ZHU Jun-feng,WANG Ning,SHANG Ling-ling,LIU Hong-sheng
(KeyLaboratoryofAnimalResourceandEpidemicDiseasePrevention,
LifeScienceSchoolofLiaoningUniversity,Shenyang,Liaoning,110036,China)
In order to deeply study on biological function of NS1protein,learn about distribution and subcellular localization of NS1protein in mammalian cells.NS1gene of avian influenza virus was amplified by RT-PCR,and cloned into vector pEGFP-N1.Recombinant plasmid was identified by enzyme digestion and sequencing,the recombinant plasmid pEGFP-N1-NS1was transfected into 293Tcells and Hela cells by liposome,distribution and subcellular localization of NS1protein was observed by the fluorescence microscope and the confocal laser scanning microscope.Eukaryotic recombinant expression plasmid pEGFP-N1-NS1was successfully constructed,it had high levels of expression.in 293Tcells and Hela cells.NS1green fluorescent fusion protein is mainly distributed in the nucleus,is slightly distributed in the cytoplasm.The study successfully expressed NS1protein in mammalian cells and analyzed subcellular localization of NS1protein.It is a solid basis for related function research on influenza virus.
Avian influenza virus;NS1protein;subcellular localization
S852.659.5
A
1007-5038(2011)10-0010-05
2011-04-29
国家自然科学基金项目(30671852);病毒学国家重点实验室开放研究基金项目(2010009);辽宁省百千万人才工程项目(022064);辽宁省教育厅重点实验室项目(2009S043);辽宁大学青年科研基金项目(488020)
朱春玉(1978-),女,内蒙赤峰人,副教授,博士,主要从事病毒学和生物农药研究。

