玄参脑保护作用提取物的工艺优化
李 娟, 萧 伟, 刘 涛, 王永香, 王 伟
(1.南京中医药大学,江苏南京 210046;2.江苏康缘药业股份有限公司,江苏 连云港 222001;3.成都大学,四川成都 610106)
玄参为玄参科植物玄参Scrophularia ningpoensisHemsl.的干燥根,始载于《神农本草经》,性寒,味苦、甘、咸,具有清热凉血,泻火解毒,滋阴等功效。现代药理研究表明玄参具有抗炎、降压、抗乙肝病毒[1]、增强免疫[2]等作用,尤其是在心脑血管方面具有抗动脉粥样硬化[4]、抑制血小板聚集[5]、以及保护局灶性脑缺血等[6]的作用。其中以哈巴俄苷和哈巴苷为代表的环烯醚萜类成分是玄参滋阴的主要药效成分[3]。故本实验以干浸膏得率、哈巴苷、哈巴俄苷的转移率为考察指标,优化玄参的水提醇沉工艺参数,并通过药理学指标考察了纯化前后对药效学的影响,从而进一步说明工艺的合理性。
1 仪器和试药
Waters 2695高效液相色谱仪(包括2695四元梯度泵,在线脱气机,自动进样器,柱温箱,Waters 2996二极管阵列检测器Empower色谱工作站);BP211D电子天平(梅特勒-托利多仪器(上海)有限公司);R-501旋转蒸发仪(申顺生物科技有限公司);SHZ-ⅢD型循环水真空泵(上海亚荣生化仪器)。
玄参购自湖北药材有限公司(经江苏康缘药业股份有限公司质量部鉴定,为玄参科植物玄参Scrophularia ningpoensisHemsl.的干燥根);哈巴苷对照品(中国药品生物制品检定所,批号:111729-200602),哈巴俄苷对照品(中国药品生物制品检定所,批号:111730-200604);甲醇、乙腈为色谱纯,水为双重蒸馏水;其他试剂均为分析纯。尼莫地平,山东新华制药股份有限公司生产,批号 0909215;2,3,5-氯化三苯基四氮唑,sigma公司生产;超氧化物岐化酶(SOD)、丙二醛(MDA)试剂盒均购自南京建成生物工程研究所。
清洁级SD大鼠,雄性,体质量280~300 g,由浙江省实验动物中心提供,合格证号SCXK(浙)2008-0033。
2 方法与结果
2.1 哈巴苷,哈巴俄苷的测定
2.1.1 色谱条件 Kromasil C18(4.6 mm ×250 mm,5 μm);流动相:乙腈(A)-0.03%磷酸水溶液(B);依据2010版中国药典玄参项下的测定方法进行洗脱,体积流量:1 mL/min;检测波长前13 min为210 nm和13 min后为280 nm;柱温:30 ℃;进样量:10 μL。
2.1.2 对照品溶液的制备 精密称定5.28 mg的哈巴苷和1.91 mg的哈巴俄苷置20 mL的量瓶中,用30%甲醇定容,摇匀,再从中精密吸取1 mL的混合标准品,置10 mL的量瓶中,加30%甲醇定容,即得每1 mL含有哈巴苷52.8 μg和哈巴俄苷19.1 μg的对照品溶液备用。
2.1.3 哈巴苷,哈巴俄苷的线性关系考察 分别精密吸取264 μg/mL 哈巴苷和95.1 μg/mL 的哈巴俄苷混合溶液0.4、1.0、2.0、5.0 mL,置 10 mL 量瓶中,加 30% 甲醇定容,摇匀。按2.1.1项下的色谱条件进样10 μL,测得峰面积,以对照品质量浓度(μg/mL)为横坐标,峰面积为纵坐标,绘制标准曲线,计算哈巴苷的线性回归方程为:Y=3 068.7X-1 835,r=0.999 7。哈巴俄苷的线性回归方程:Y=25 253X-7 099.1,r=0.999 7。结果表明,哈巴苷在10.56 ~264 μg/mL,哈巴俄苷在3.82 ~95.5 μg/mL 范围内线性关系良好。
2.2 干浸膏的测定 干浸膏得率的计算:精密量取供试品溶液25 mL,置已干燥至恒重的蒸发皿上,水浴挥干溶剂,105℃干燥至恒重,移至干燥器中,冷却30 min,立即精密称重,计算干浸膏的得率。
2.3 醇沉正交试验设计及结果分析 根据初步试验工艺设计,得到最佳水提工艺为浸泡1 h,8倍量的热水,提取3次,每次1.5 h。按照上述最佳结果,进行醇沉的最佳工艺考察。
2.3.1 醇沉因素与水平的确定 根据预实验,醇沉时相对密度在1.10以下,醇沉效果不理想;当大于1.20时,药液太浓,乙醇不易分散,因此药液相对密度水平设定为1.10、1.15、1.20。并按照表1和表2的试验安排对醇沉工艺进行优选,结果见表3。

表1 醇沉的因素水平

表2 正交试验结果
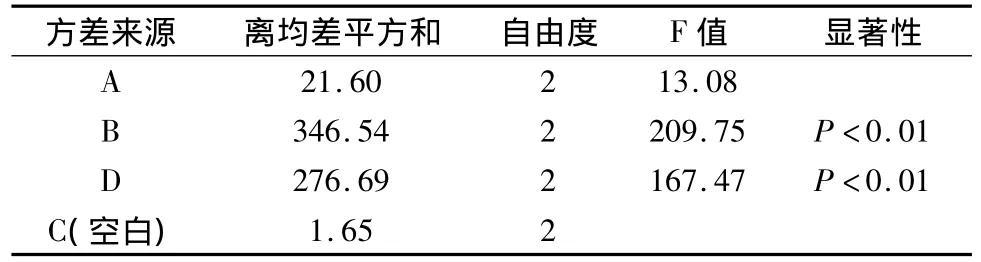
表3 方差分析表
根据极差和方差分析结果可知,影响醇沉工艺因素的顺序是B>D>A,B、D对醇沉工艺有极显著的影响,采用两两比较LSD检验,可知,密度为1.15和1.10相差不大,无统计学意义。而1.15可节约乙醇用量,更适合工业化大生产的要求,故最佳相对密度为 1.15,故优选的最佳工艺为A2B1D3。即相对密度为1.15,调整含醇量为60%,静置36 h。
2.3.2 验证实验 根据上述筛选的结果重新进行3次试验,验证工艺的稳定性,得到其干膏率、哈巴苷、哈巴俄苷平均转移率依次为20.05%、98.63%,96.36%,综合评分的均值85.87%,RSD值为1.62%。表明优选的醇沉工艺稳定、合理、可行。
基于中药发挥作用的多成分和多靶点的特点,单纯从化学指标来筛选工艺尚不足以说明工艺的合理性。为此,本实验又以对脑缺血再灌注保护作用为指标对醇沉前后的玄参溶液进行了药效学考察,以便进一步佐证工艺的合理性。
2.4 醇沉前后对脑缺血再灌注保护作用的影响 选取体质量在280~300 g的雄性SD大鼠随机分为4组,即假手术组、模型组(前两组均给予生理盐水灌胃)、尼莫地平组(10.8 mg/kg)、玄参水提液组(30 g/kg,相对于生药的量)和玄参水提醇沉液组(30 g/kg)。根据Zea Longa等[7]方法制备大鼠大脑中动脉栓塞(middle cerebral artery occlusion MCAO)模型,10%水合氯醛(350 mg/kg)腹腔注射麻醉大鼠,分离、结扎并切断右侧颈外动脉,由颈外动脉残端沿颈总和颈内动脉缓慢插入头端膨大的尼龙鱼线约18 mm,阻塞大脑中动脉入口造成缺血。缺血3 h后拔出栓线进行24 h再灌注,假手术组仅分离颈总动脉、颈外动脉和颈内动脉但不插线。于缺血/再灌24 h后断头取脑,测其湿重及于105℃干燥48 h至恒重后的干重,并按下式计算脑组织的含水量;于再灌24 h后断头取脑,行2 mm厚的冠状切片5片,置于2% 红四氮唑(TTC)溶液中37℃孵育30 min,正常脑组织呈现深红色,梗死灶呈白色,利用图像处理软件(AutoCAD)得5个脑片缺血侧的总面积和梗死区域的面积,并计算梗死区域占大脑半球总面积的百分比。结果见表4。

结果显示,模型组与假手术组相比差异显著(P<0.01),大鼠脑水肿明显;玄参水提液、玄参水提醇沉后与玄参水提均可降低MCAO大鼠的神经行为学评分,改善大鼠缺血/再灌注后的行为障碍,明显减少梗死百分比,减轻脑水肿程度;含等生药量的玄参提取液及玄参醇沉液对脑缺血再灌注模型的保护无显著性差异,说明醇沉后药效成分未减少,同时干膏率又有较大的降低,故醇沉适合玄参水提液的纯化。
表4 玄参提取物对大鼠神经功能学,脑组织含水量和梗死面积的作用 (±s,n=8)

表4 玄参提取物对大鼠神经功能学,脑组织含水量和梗死面积的作用 (±s,n=8)
组别 神经功能评分 脑组织含水量/% 脑梗死面积测定/%假手术76.9 ±0.034 0模型 7.50 ±1.58 83.5 ±0.054* 25.89 ±5.96尼莫地平 4.78±2.11▲▲ 78.7±0.021▲ 15.75±5.08▲▲玄参水提液 4.80±1.93▲▲ 76.1±0.059▲ 17.83±8.44▲玄参水提醇沉液 5.40±1.90▲ 78.1±0.028▲ 17.94±5.70 0▲
3 讨论
在工艺优化的初步阶段,以浸泡时间、溶媒用量、煎煮次数和煎煮时间为考察因素,以哈巴俄苷、哈巴苷的转移率及干浸膏的量为指标,采用L9(34)表优选水提工艺,为了验证工艺的准确性,进行重复验证实验,得到干膏得率、哈巴苷和哈巴俄苷平均转移率依次为51.90%,71.06%,71.57%。
药材中苷类成分常与酶共存,在适宜的温度和湿度下,易使苷类水解,因此,在预实验中考察了酶对哈巴苷和哈巴俄苷的影响,即采用冷水浸泡时,哈巴苷,哈巴俄苷的转移率分别为33.08%、30.09%,而采用沸水浸泡后,两者的转移率分别为65.47%、60.64%,故选用热浸法来提取。
目前,国内外对哈巴俄苷的研究报道比较多[3,8-9],但对哈巴苷的检测及其活性的研究比较少。现代药理研究表明玄参中水溶性成分是其主要药效成分[10],而哈巴苷、哈巴俄苷都是其水溶性成分,且两者在药材中量也相对较高。因此,选择哈巴苷、哈巴俄苷做为工艺筛选的指标可最终确保玄参提取物的药效。
[1]蔡少青,谢丽华,王建华,等.中药玄参中哈巴俄苷和肉桂酸的高效液相色谱法测定[J].药物分析杂志,2000,20(3):191-194.
[2]杜先婕.玄参提取物的药理活性研究及强筋健骨胶囊的药理学研究[D].西安:西北大学,2009.
[3]谢丽华,刘洪宇,钱瑞琴,等.哈巴苷与哈巴俄苷对阴虚小鼠免疫功能及血浆环化核苷酸的影响[J].北京大学学报,2001,33(3):283-284.
[4]李 静,陈长勋,高 阳.玄参提取物抗炎与抗动脉硬化作用的探索[J].时珍国医国药,2010,21(3):532-534.
[5]倪 正,蔡雪珠,黄一平.玄参提取物对大鼠血液流变性、凝固性和纤溶活性的影响[J].中国微循环,2004,8(3):152-153.
[6]Huang Q,Gong QY,Yao MH.Protective effect ofScrophularia ningpoensisextracts on cerebral ischemia injury in rats[J].Chin J New Drugs Clin Rem,2004,23(6):323-327.
[7]Longa E Z,Weinstein P R,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84.
[8]王建华,谢丽华,刘洪宇,等.玄参不同加工品中哈巴俄苷与肉桂酸的HPLC含量测定[J].中国药学杂志,2000,35(6):375-378.
[9]张道锦,王 瑞,毕开顺.MECC法测定玄参中哈帕酯苷和安格洛苷C的含量[J].沈阳药科大学学报,2001,18(3):189-191.
[10]王 珲.玄参水溶性成分的研究[D].武汉:武汉工业大学,2008.

