卵巢早衰患者骨量变化的相关研究
林琳,齐铮琴,金海红,王智文,岳天孚
(1.天津医科大学总医院妇产科,天津 300052;2.秦皇岛市第一医院妇产科,河北 秦皇岛 066000)
卵巢早衰(premature ovarian failure,POF)指女性在40岁前绝经,伴有高促性腺激素及低性腺激素血症。POF在女性人群中发病率约为1%[1],近年其发病率有逐渐升高的趋势,POF的致病因素复杂,但约有50%的患者未发现明确致病原因,称为特发性卵巢早衰。卵巢早衰低雌激素水平可导致围绝经相关症状的出现及生育力的明显减退,对女性的身心健康有严重影响。雌激素对女性骨量的维持有重要意义,因雌激素的缺乏卵巢早衰患者远期发生骨质疏松症的风险会明显升高,本研究对特发性POF患者的骨量变化及其相关因素进行探讨,为临床防治POF患者的骨质疏松症提供理论依据。
1 资料与方法
1.1 一般资料
选择2009年1月至2010年6月在我院生殖内分泌门诊就诊的特发性卵巢早衰患者42例,特发性POF诊断标准:年龄在40岁以下超过3个月经周期无月经来潮,至少2次不同日血清FSH>40 IU/L,E2<25 pg/mL,特发性POF为无自身免疫性疾病及其他代谢性疾病,排除卵巢手术,放疗,化疗等明显卵巢损害性因素,染色体核型正常的POF患者。对照组选择在我院体检中心健康体检同年龄段健康女性60例。
1.2 方法
1.2.1 临床资料采集:详细询问各研究对象病史及家族史,月经史,生育史,测量体质量、身高,计算体质指数(body massindex,BMI),体质指数计算公式:BMI=体质量(kg)/身高(m)2
1.2.2 性激素测定:POF患者于就诊时清晨留取空腹静脉不抗凝全血4 mL,分离血清,应用化学发光法测定患者FSH、LH、E2水平。对照组于月经第2~4 d空腹留取静脉血,测定FSH、LH、E2。
1.2.3 骨密度测定:骨密度测定仪器为美国Lunar公司生产的DPX.L型双能X线骨密度仪(DEXA),仪器精度1%,重复测量误差<1%,仪器由专人操作。测量对象取仰卧屈膝固定位测腰椎(L2-4)骨密度;取右下肢轻度内旋位,支架和砂袋固定踝关节外侧,测量股骨近端股骨颈的骨密度,以骨矿面密度(bone mineral density,BMD)g/cm2表示。
1.3 统计学分析
计量资料采用t检验,计数资料采用χ2检验,相关分析采用线性相关分析,P<0.05为有统计学意义。采用SPSS11.0软件进行统计分析。
2 结果
2.1 POF组及对照组各临床指标及性激素水平
POF组雌激素缺乏时间为29.1±13.5(月),POF组血清FSH,LH水平明显高于对照组(P<0.05),E2水平明显低于对照组(P<0.05),其他临床指标差异无统计学意义。见表1。

表1 2组临床指标及性激素水平Tab.1 Clinicalcharacteristics of women with POFand controls
2.2 POF组与对照组腰椎及股骨颈骨密度比较
POF组腰椎及股骨颈骨密度均显著低于对照组(P<0.05)。见表2。
2.3 POF组骨密度的相关因素分析
POF组腰椎及股骨颈骨密度与雌激素缺乏时间、FSH水平均呈显著负相关(P<0.05),与年龄、体质量指数呈显著正相关(P<0.05),雌激素水平与腰椎骨密度显著正相关(P<0.05),与股骨颈骨密度无显著相关性(P>0.05)。见表3。
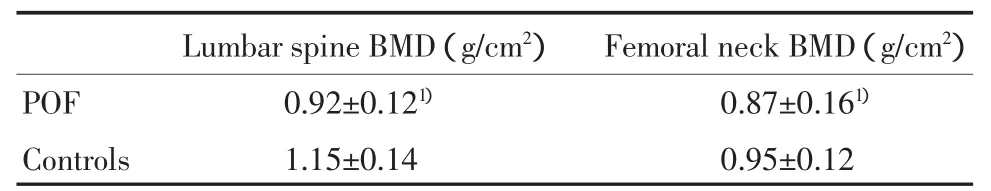
表2 两组腰椎及股骨颈骨密度Tab.2 BMD of women with POF and controls
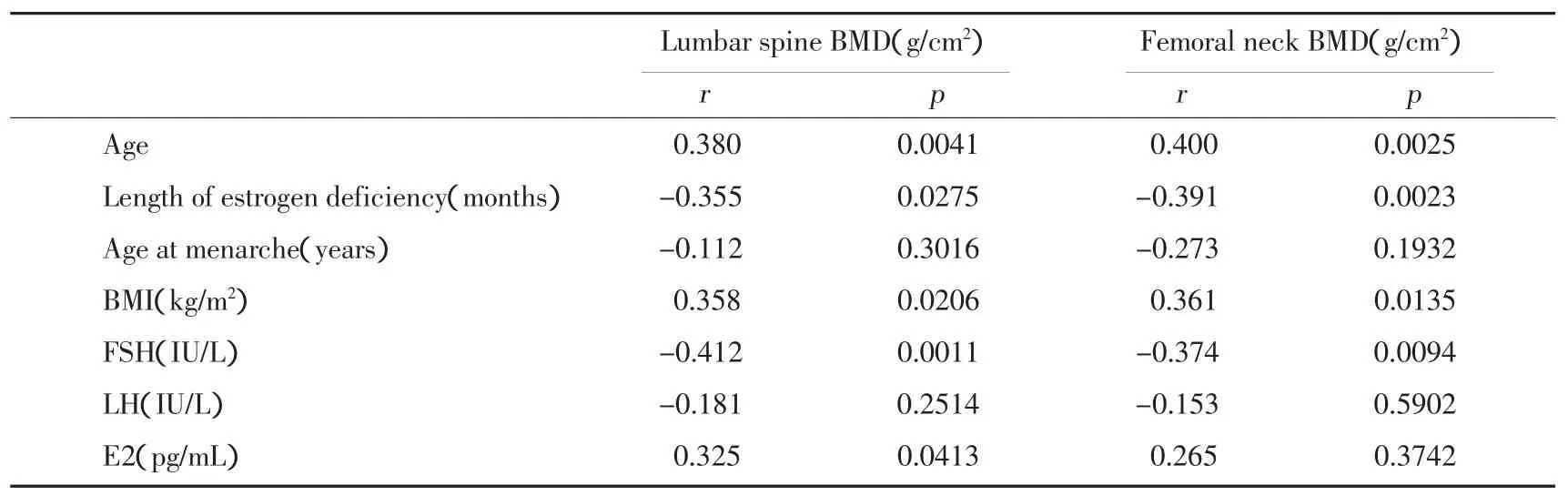
表3 POF患者骨密度相关因素分析Tab.3 Correlation between clinical characteristics of women with POF and BMD
3 讨论
POF是一种以缺乏初潮或40岁以前卵泡提前耗竭为特征的卵巢缺陷性疾病,部分患者由于体内雌激素缺乏可有严重的代谢性及心血管疾病的发生,对于卵巢早衰患者发病后骨代谢变化的研究较少。本研究结果表明随着雌激素缺乏时间的延长,POF患者的骨密度会逐渐降低,体内雌激素水平与腰椎骨密度呈正相关,雌激素的长期缺乏会明显影响POF患者的骨密度。1987年Eriken等[2]首次证实人成骨细胞上存在着雌激素受体(estrogen receptor,ER),雌激素直接参与调节骨代谢,近期的研究证实破骨细胞也是雌激素的靶细胞,雌激素与破骨细胞上的ER结合可抑制骨吸收过程,其抗骨质疏松的作用主要是通过抑制骨吸收来实现的。POF患者的性激素水平与正常绝经期女性相似,有研究表明正常女性随着绝经年限越长,骨量丢失会逐渐增加,POF患者的骨量因雌激素的缺乏也会出现类似的变化,其发生骨质疏松的可能性将明显升高[3],故对于POF患者早期有效的激素替代治疗显得尤为重要,外源性激素应尽可能使用与卵巢产生的雌激素类似的替代药物,尽可能的降低雌激素缺乏对骨量的影响[6]。
本研究中POF患者的骨密度与正常对照组相比,明显降低,相关因素分析表明年龄、体质指数与腰椎及股骨颈骨密度正相关,而年龄是相关性较强的因素。骨密度峰值是人体生命过程中获得的最大BMD值,也是人生命最成熟期达到的骨组织的总量,影响人一生的骨量。BMD峰值可做为评估人体骨量丢失出现的时间和骨丢失程度的重要参数。研究表明30~35岁是女性一生中骨量最高的年龄[4]。本研究中,POF患者平均年龄<35岁,POF患者发病时可能还未及获得最大骨峰值,在这些患者发病后随着破骨大于成骨过程的发生而表现为低骨量,因此我们认为绝经年龄是较雌激素缺乏时间更好的一项预测骨量减少及骨质疏松发生的指标。体质指数与POF患者骨密度呈正相关,BMI是对人身体素质影响的综合反映,包括了遗传、运动、饮食等因素,体质量对骨骼是一种机械负荷因素。高BMI妇女脂肪组织中芳香化酶使雄激素向雌激素转化增加,低BMI妇女因肾上腺雄激素产生低且外周脂肪组织中雌激素的转换少,循环中性激素水平较低,故体质量减轻常导致血浆性激素水平的变化并伴随骨量和骨转换率的改变[5],有文献报道BMI对髋部骨折有保护作用,低BMI是发生髋部骨折的重要危险因素[6]。故POF患者保持正常的体质量对骨密度的维持有较重要的作用。
本研究结果表明POF患者的FSH水平与腰椎及股骨颈骨密度呈显著负相关,雌激素仅与腰椎骨密度呈显著正相关,而且FSH与骨密度的相关性好于E2,此结果与Lana等[7]的报道相似。雌激素的长期缺乏是POF患者骨密度降低的主要原因,而FSH水平的升高可能是其骨密度降低的另一重要因素。有研究表明FSH具有促进破骨细胞骨吸收的作用,健康绝经前妇女FSH>20 IU/L,雌激素水平正常者,其股骨颈骨密度的丢失率显著增加,故有学者认为,对于绝经早期和性腺功能减退所致的骨丢失,不只是雌激素水平下降的结果,也可能与循环中的促性腺激素分泌增加和抑制素B分泌减少有关,因为在围绝经期骨丢失比率增加发生在雌激素水平变化之前,此时的FSH水平已明显增加。年轻闭经者因FSH水平升高可导致骨量积累不足和低骨量[13],本研究进一步证实了POF患者FSH水平升高与其骨量减少有关,FSH的变化可能对POF患者的骨代谢产生影响[8],POF患者的FSH水平是预测其骨量变化的另一较好指标。
POF患者的骨密度降低与多种因素相关,对于其骨质疏松的防治,早期规范的激素替代治疗是首选的治疗方法,同时补充钙剂及健康的生活方式对于POF患者减少骨丢失、预防骨质疏松的发生同样重要。
[1]Goswami D,Conway GS.Premature ovarian failure [J].Horm Res,2007,68(4):196-202.
[2]Mone Z,Baljit SM,Li S,et al.Understanding osteoelast formation and function:Implications for future therapies for osteoporosis[J].Curr Opin Orthop,2003,14(5):341-350.
[3]Amarante F,Vilodre LC,Maturana MA,et al.Women with primary ovarian insufficiency have lower bonemineral density[J].Braz JMed Biol Res.2011,44(1):78-83.
[4]张萌萌,李亚刚,刘颖,等.长春市16019例汉族人群骨密度调查及骨质疏松发病率分析[J].中国骨质疏松杂志,2009,15(7):534-537.
[5]Wang MC,Bachrach LK,Van Loan M,et a1.The relative eontributionsof lean tissuemassand fat masstobonedensity in youngwomen[J].Bone,2005,37(4):474-481.
[6]De Lacet C,Kanis JA,Oden A,et a1.Body mass index asa predictor of fracture risk:a meta-analysis [J].Osteoporosis Int,2005,16(11):1330-1338.
[7]Lana MB,Straminsky V,Onetto C,et al.What is really responsible for bone loss in spontaneous premature ovarian failure?A new enigma[J].Gynecol Endocrinol,2010,26(10):755-759.
[8]Yilmaz C,Atalay B,Caner H,et a1.Augmentation of loosened sacral pedicle SCre with percutaneous polymethylmethacrylate injection[J].JSpinal Disord Tech,2006,19(5):373-375.

