碳酸酐酶Ⅰ、Ⅱ在结直肠癌中的表达及意义
王宁,陈洋,姜奕
(中国医科大学附属第一医院1.普通外科;2.中心实验室,沈阳 110001)
结直肠癌(colorectal cancer,CRC)是常见的消化道肿瘤,目前认为其发生、发展经历从正常上皮—增生—腺瘤—癌—浸润转移这样一个过程[1,2]。碳酸酐酶(carbonic anhydrases,CA)是一组催化H++HCO3-葑H2O+CO2可逆反应的同工酶。CA家族包括十几个成员,其中 CAⅠ、CAⅡ位于细胞质内[3,4]。迄今为止关于CAⅠ、CAⅡ在CRC中表达情况的报道不多,它们的表达与CRC的发生、发展以及临床病理特征的关系尚有待进一步阐明。本研究采用免疫组织化学法,对CAⅠ、CAⅡ在正常结直肠黏膜、息肉、腺癌及转移淋巴结中的表达进行研究,探讨CAⅠ、CAⅡ的表达与结直肠癌的发生、发展以及临床病理特征的关系。
1 材料与方法
1.1 材料
取自中国医科大学附属第一医院普通外科2008年3月至2010年9月术前未经放化疗、手术切除的64例原发性CRC患者标本,患者平均年龄(61.4±12.5)岁,其中男33例,女31例。术后病理证实64例均为腺癌。术后病理证实的20个转移淋巴结(lymph node metastasis,LNM)来自 15例腺癌,27个息肉(包括增生性息肉17个和腺瘤性息肉10个)来自上述15例腺癌同时切除的标本。另外3个腺瘤为结肠镜无法电切,经手术切除并经术后病理证实。55个配对的正常黏膜取自CRC患者,距肿瘤10 cm以上肉眼观察正常处。CRC中高分化18例,中分化33例,低分化13例;TNM分期Ⅰ期4例,Ⅱ期31例,Ⅲ期25例,Ⅳ期4例。
CAⅠ羊抗人多克隆抗体、CAⅡ鼠抗人单克隆抗体购自Santa Cruz公司(PBS稀释,浓度为1∶100)。三步法免疫组织化学试剂盒购自福州迈新公司。
1.2 方法
对以上组织进行甲醛固定,石蜡包埋,连续切片。其中1张切片行HE染色供病理诊断,其余切片供免疫组织化学研究。
石蜡切片以二甲苯脱蜡、梯度乙醇水化。新鲜配制的3%双氧水,室温15 min去除内源性过氧化酶。用蒸馏水和pH 7.4的PBS缓冲液清洗后,高温高压修复:置于pH 6.0的柠檬酸缓冲液入高压锅中加热至沸腾2 min,PBS缓冲液冲洗。滴加动物非免疫血清,室温封闭1 h,滴加一抗,4℃孵育过夜。用PBS冲洗后,滴加生物素标记的二抗,室温下反应20 min。再用PBS冲洗。滴加链霉菌抗生物素蛋白-过氧化物酶,室温下反应20 min,PBS冲洗,DAB显色,自来水冲洗,苏木素复染或轻染。自来水冲洗,梯度乙醇脱水,二甲苯透明,中性树胶封片。光学显微镜下观察,依信号的强弱分为阴性(-)0分,弱阳性(+)1分,中度阳性(++)2分,强阳性(+++)3分。
1.3 统计学处理
利用SPSS统计软件,计量资料以x±s表示,采用秩和检验进行统计学分析,对有配对标本者进行配对秩和检验。以P<0.05为差异有统计学意义。
2 结果
CAⅠ、CAⅡ于胞质内着色,正常黏膜主要着色区位于肠腔侧的腺细胞,而癌组织则无此特点。CAⅠ、CAⅡ信号在正常黏膜中最强,在增生和腺瘤性息肉减弱,CRC 中最弱(图 1,2)。
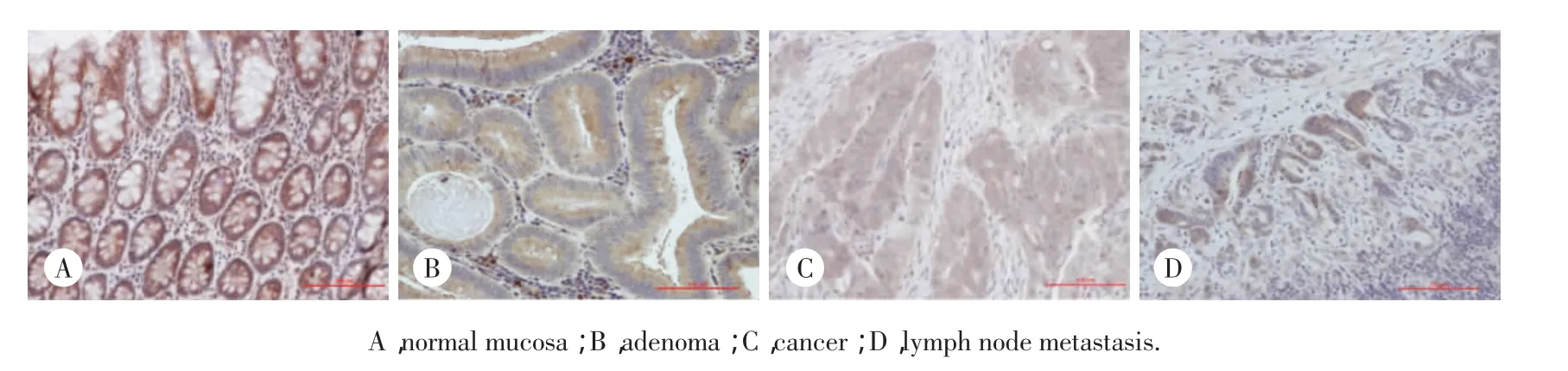
图1 CAⅠ在正常黏膜、腺瘤、腺癌及转移的淋巴结中表达 ×200Fig.1 The expression of CAⅠ in normal mucosa,adenoma,cancer and LNM(Stained with diaminobenzidine and counterstained with hematoxylin,×200)
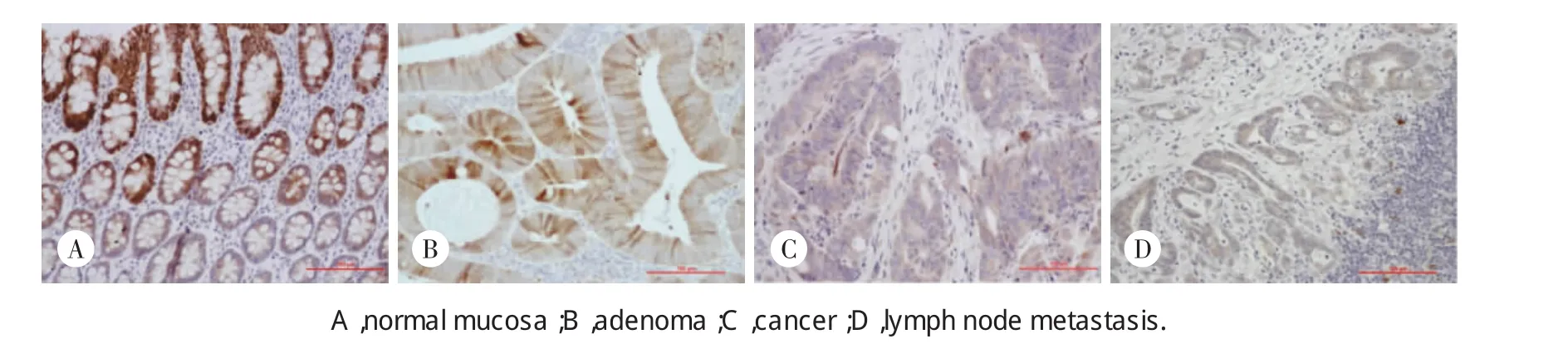
图2 CAⅡ在正常黏膜、腺瘤、腺癌及转移的淋巴结中表达 ×200Fig.2 The expression of CAⅡ in normal mucosa,adenoma,cancer and LNM (Stained with diaminobenzidine and counterstained with hematoxylin,×200)
CAⅠ强度在配对的正常黏膜、癌组织中分别为(2.95±0.23)和(1.64±0.52),二者差异有统计学意义(P<0.01)。CAⅠ在增生性息肉和腺瘤性息肉中分别为(2.39±0.50)和(2.44±0.53),与配对的正常黏膜比较显著降低,差异均有统计学意义(P<0.05)。CAⅠ在CRC中强度与匹配的息肉(2.41±0.50)比较显著降低(P<0.01)。然而,CAⅠ在配对的CRC和LNM 中表达强度相近,分别为(1.86±0.36)和(1.67±0.58),差异无统计学意义(P=0.10)。高、中、低分化的 CRC 中 CAⅠ表达分别为(1.84±0.50)和(1.63±0.50)、(1.57±0.51),虽逐渐降低但差异无统计学意义(P=0.21)。在CRC的Ⅰ、Ⅱ期与Ⅲ、Ⅳ期中CAⅠ表达分别为(1.63±0.56)、(1.76±0.44),二者差异无统计学意义(P=0.33)。
CAⅡ表达在配对的正常黏膜、癌组织中分别为(2.80±0.49)和(1.20±0.87),二者差异有统计学意义(P<0.01)。CAⅡ表达在增生性息肉和腺瘤性息肉中分别为(2.59±0.51)、(2.50±0.53),与配对的正常黏膜比较显著降低,差异有统计学意义(P<0.05),而增生性息肉与腺瘤性息肉间CAⅡ表达差异无统计学意义(P=0.66)。CAⅡ在CRC中表达与匹配的息肉(2.56±0.51)比较显著降低(P<0.01)。然而,CAⅡ表达在配对的CRC和LNM(1.35±0.67)中强度相近,差异无统计学意义(P=0.61)。高、中、低分化的CRC 中 CAⅠ表达分别为(1.34±0.91)、(1.17±0.90)、(0.96±0.63),虽逐渐降低但差异无统计学意义(P=0.60)。在CRC的Ⅰ、Ⅱ期与Ⅲ、Ⅳ期中CAⅠ表达分别为(1.32±0.80)、(0.98±0.87),差异无统计学意义(P=0.91)。
3 讨论
CA是一组含锌的金属酶,负责催化H++HCO3-葑H2O+CO2可逆反应,以实现对酸碱平衡等的调节。据报道CAⅡ是CA家族中活性最高的,而CAⅠ的活性则为中等[3~5]。
由于CO2很容易被动弥散通过细胞膜,因此细胞质内的CAⅠ、CAⅡ在正常情况下主要是使反应向右进行,从而帮助CO2的跨膜转运[4,6]。虽然肿瘤细胞外呈酸性(pH 5.6~6.8),但细胞内却呈中性或碱性(pH 7.2~7.5)[3,7,8]。而 HCO3-是体内维持碱性环境的重要物质。因此,我们推测肿瘤细胞为了减少HCO3-的丢失,CAⅠ、CAⅡ表达降低。而来自糖酵解产生的乳酸等的H+则通过Na+/H+交换等主动排出细胞外[4,9]。
Kummola等认为,CAⅠ、CAⅡ基因均位于8号染色体q臂上,而且密切关联。调控区域或等位基因的缺失或点突变可导致CAⅠ、CAⅡ的表达同时降低。并推测CAⅠ、CAⅡ可能发挥着抑癌功能[5]。
CAⅠ、CAⅡ在正常黏膜中的表达主要在临近肠腔侧,而且无论在正常结直肠黏膜组织中还是CRC中CAⅠ、CAⅡ表达高低与在结直肠中不同部位无关,与文献报道相符[10]。CAⅠ、CAⅡ在正常黏膜中表达最强,在良性息肉、癌组织中逐级降低[10]。由于本组CRC中Ⅰ期和Ⅳ期仅各有4例,故我们将Ⅰ、Ⅱ期与Ⅲ、Ⅳ期分2组比较,并证实CAⅠ、CAⅡ在CRC中表达与分期无关。Kivela等也认为CAⅠ、CAⅡ在CRC中表达与Dukes分期无关[10]。但Bekku等用Western blot法研究证实CAⅠ、CAⅡ在CRC中的表达随Dukes分期的进展显著降低[11]。与Kivela等的结果不同[10],本研究显示虽然随着分化程度的降低,CAⅠ、CAⅡ强度减弱,但差异无统计学意义。Bekku等[11]的研究表明CAⅠ的表达与CRC分化无关;但CAⅡ在结肠癌中,中分化低于高分化(P<0.04),在直肠癌中的表达与分化无关。而Nieme等对77个遗传性非息肉病性CRC的研究表明CAⅡ的表达与分化程度和Dukes分期均无关[12]。
近年关于CRC的比较蛋白质组学研究也显示,CAⅠ、CAⅡ是CRC组织中表达显著下调中的两个蛋白[13~16]。而且将CAⅡcDNA克隆转染CRC细胞后,癌细胞侵袭、趋化运动能力及耐药性均明显降低[13,14]。
本研究与Kivela等的结果相符,在淋巴结转移中CAⅠ、CAⅡ的表达不再继续降低,甚至略高于原发灶[10]。白雪等的研究也表明,与原发灶比较,肝转移灶中CAⅡ的表达并未显著降低[14]。
综上所述,CAⅠ、CAⅡ是正常结直肠黏膜腺上皮细胞中所必需的酶。CAⅠ、CAⅡ的表达从增生性息肉和腺瘤开始即显著低于正常黏膜,说明CAⅠ、CAⅡ表达下调是CRC发生中的早期事件。CAⅠ、CAⅡ在LNM中表达与原发灶相比无显著差异,说明CAⅠ、CAⅡ表达下调与LNM无关。
[1]蒯筱漪,李正阳,张红杰.线粒体解耦联蛋白2在结肠癌中的表达及其临床意义[J].世界华人消化杂志,2010,18(21):2202-2208.
[2]刘铁权,孙明军,魏敏杰.组蛋白去乙酰化酶1、2在大肠癌及腺瘤组织中的表达及其与临床病理的关系[J].世界华人消化杂志,2010,18(30):3195-3199.
[3]Chiche J,Brahimi-Horn MC,Pouysségur J.Tumour hypoxiainducesa metabolic shift causing acidosis:a common feature in cancer [J].J Cell Mol Med,2010,14(4):771-794.
[4]Potter CP,Harris AL.Diagnostic,prognostic and therapeutic implications of carbonic anhydrases in cancer[J].Br JCancer,2003,89(1):2-7.
[5]Kummola L,H覿m覿l覿inen JM,Karttunen T,et al.Expression of anovel carbonic anhydrase,CA ⅩⅢ,in normal and neoplastic colorectal mucosa[J].BMCCancer,2005,5:41.
[6]Henry RP,Swenson ER.The distribution and physiological significance of carbonic anhydrase in vertebrate gas exchange organs[J].Respir Physiol,2000,121(1):1-12.
[7]Fang JS,Gillies RD,Gatenby RA.Adaptation tohypoxiaand acidosis in carcinogenesis and tumor progression [J].Semin Cancer Biol,2008,18(5):330-337.
[8]Lindner D,Raghavan D.Intra-tumoural extra-cellular pH:a useful parameter of responsetochemotherapy in syngeneic tumour lines[J].Br JCancer,2009,100(8):1287-1291.
[9]Beltrán AR,Ramírez MA,Carraro-Lacroix LR,et al.NHE1,NHE2,and NHE4 contribute to regulation of cell pH in T84 colon cancer cells[J].Pflugers Arch,2008,455(5):799-810.
[10]Kivela AJ,Saarnio J,Karttunen TJ,et al.Differential expression of cytoplasmic carbonic anhydrases,CA Ⅰ and Ⅱ,and membrane-associated isozymes,CA Ⅸ and Ⅻ,in normal mucosa of large intestineand in colorectal tumors[J].Dig Dis Sci,2001,46(10):2179-2186.
[11]Bekku S,Mochizuki H,Yamamoto T,et al.Expression of carbonic anhydrase I or II and correlation to clinical aspects of colorectal cancer[J].Hepatogastroenterology,2000,47(34):998-1001.
[12]Niemel覿AM,Hynninen P,Mecklin JP,et al.Carbonic anhydrase Ⅸishighly expressed in hereditary nonpolyposiscolorectal cancer[J].Cancer Epidemiol Biomarkers Prev,2007,16(9):1760-1766.
[13]白雪,李世拥,于波,等.结直肠癌原发灶和正常肠黏膜组织相关差异表达蛋白研究[J].解放军医学杂志,2008,33(5):495-497.
[14]白雪,李世拥,安萍,等.结直肠癌原发灶和肝转移灶组织中蛋白质组差异表达及临床意义[J].中华医学杂志,2005,85(30):2128-2131.
[15]Bi X,Lin Q,Foo TW,et al.Proteomic analysis of colorectal cancer reveals alterations in metabolic pathways:mechanism of tumorigenesis[J].Mol Cell Proteomics,2006,5(6):1119-1130.
[16]Kim H,Kang HJ,You KT,et al.Suppression of human seleniumbinding protein 1 isa late event in colorectal carcinogenesisand is associated with poor survival[J].Proteomics,2006,6(11):3466-3476.

