法国海岸松树皮提取物碧萝芷对长链游离脂肪酸诱导的巨噬细胞perilipin2基因表达的影响
范斌,杜强,谷剑秋,张锦
(中国医科大学1.附属盛京医院神经内科,沈阳 110004;2.附属盛京医院内分泌科,沈阳 110004;3.附属第一医院内分泌科,沈阳110001)
单核细胞通过内皮细胞的间隙移入内膜下并分化成巨噬细胞,巨噬细胞吞噬体内过剩的脂质后变成泡沫细胞,泡沫细胞聚集并形成斑块是动脉粥样硬化发生、发展的主要病理基础[1,2]。研究表明,perilipin2与泡沫细胞的形成密切相关,在动脉粥样硬化动物模型ApoE-/-鼠的实验中,敲除perilipin2基因能显著抑制泡沫细胞及斑块的形成[3],提示perilipin2是治疗动脉粥样硬化的理想分子目标,下调perilipin2的表达有助于减少泡沫细胞的形成。我们通过对一系列具有抗炎、抗氧化作用的天然化合物的筛选,发现法国海岸松树皮提取物—碧萝芷(Pycnogenol,PYC)能够抑制油酸诱导的perilipin2的表达,并进一步探讨了其相关分子机制。
1 材料与方法
1.1 试剂
油酸(oleic acid,OA)(Wako Pure Chemical Industries,日本),perilipin2单克隆抗体(PROGEN Biotechnik,德国),GAPDH单克隆抗体、过氧化物酶耦联羊抗豚鼠IgG及羊抗鼠抗体(Santa Cruz Biotechnology,美国),Western blot试剂盒(GE Healthcare,英国),转染试剂、Lipofectamine PLUS reagent(Invtrogen,美国),荧光素发光检测试剂盒(Promega,美国),逆转录 ReverTra Ace-a kit试剂盒(Toyobo,Osaka 日本),Real-time PCR SYBR Green试剂盒(Bio-Rad,美国),空白pGL3荧光素酶报告质粒,包含perilipin2启动子-2 090 bp区域的pGL3质粒,对照pRL-TK质粒及PYC由日本九州大学附属病院第三内科生山祥一郎教授慷慨提供。
1.2 方法
1.2.1 细胞培养及处理:RAW264.7鼠巨噬细胞株(RIKEN,日本)1×106个接种于10 mLα-MEM培养基中(100 mL/L胎牛血清,1×105U/L青霉素),置于37℃、5%CO2恒温培养箱。1~2 d传代1次。50μg/mL碧罗芷或DMSO预处理RAW264.7细胞1 h后,200 μmol/L油酸刺激细胞24h,行Real-timePCR及Westernblot检测perilipin2mRNA和蛋白的表达水平。
1.2.2 Real-time PCR:按 Isogen说明书提取总RNA。取0.5μg总RNA,按逆转录ReverTra Ace-a kit说明书操作合成单链cDNA,鼠perilipin2上游引物序列:5′-CTGTCTACCAAGCTCTGCTC-3′,下游引物序列:5′-CGATGCTTCCTTCCACTCC-3′。 GAPDH上游引物序列:5′-ACCACAGTCCATGCCATCAC-3′,下游引物序列:5′-TCCACCACCCTGTTGCTTA-3′。按SYBER Green Real-time PCR荧光试剂盒说明书操作,总反应体积25μL(12.5μLSYBERGreen supermix 5μL,1︰20稀释的cDNA,各引物的终浓度为320 nmol/L),以GAPDH为内参照物,perilipin2量以对GAPDH的相对诱导倍数表示。
1.2.3 Western blot:用4℃预冷裂解液(含pH 7.5 50 mmol/L Tris-HCl,0.5 g/L Nonidet 40、1 mmol/L EDTA、1 mmol/L EGTA、150 mmol/L NaC1、100 mL/L甘油、50 mmol/L氟化钠、10 mmol/L焦磷酸钠、1 mmol/L矾酸钠、80μmol/Lβ甘油磷酸、1 mmol/L PMSF、10 mg/Laprotinin、100 mg/L soybean trypsin inhibitor和10 mg/L leupeptin)裂解细胞。取25μg蛋白,95℃变性5 min后,经120 g/LSDS2PAGE行垂直电泳(100 V×90 min),室温100 V ×100 min转膜,50 g/L牛奶室温封闭1 h。结合一抗(豚鼠抗鼠ADRPmAb,1∶200 稀释),室温 1 h,结合二抗(羊抗豚鼠,1∶20 000 稀释),室温 1 h。感光、洗片,蛋白条带扫描后行光密度分析。
1.2.4 瞬时转染及荧光素酶活性分析:用Lipofectamine PLUSreagent转染试剂,按使用说明书进行操作,将 RAW264.7细胞(2×105/孔)接种于 12孔板,培养24 h后,改为去除胎牛血清培养基培养,转染混合液 50μL(Lipofectamine 2μL,PLUSreagent 5 μL,1μg荧光素酶报告质粒,0.4μg pRL-TK 质粒,用去除胎牛血清培养液调整至50μL),37℃转染4 h。1×PBS洗涤,改为包含胎牛血清α-MEM培养基,PYC预处理1 h后,用相应浓度油酸培养24 h。收集并裂解细胞,使用Dual-Luciferase Reporter Assay System荧光素酶检测系统,按说明书操作,进行荧光素酶活性检测。根据对照质粒pRL-TK Renilla活性标准化转染效率。
1.3 统计学分析
采用SSPS11.0统计软件进行统计学分析。所有数据用x±s表示,采用单因素方差分析(ANOVA),P<0.05为差异有统计学意义。
2 结果
2.1 油酸诱导巨噬细胞perilipin2 mRNA和蛋白的表达
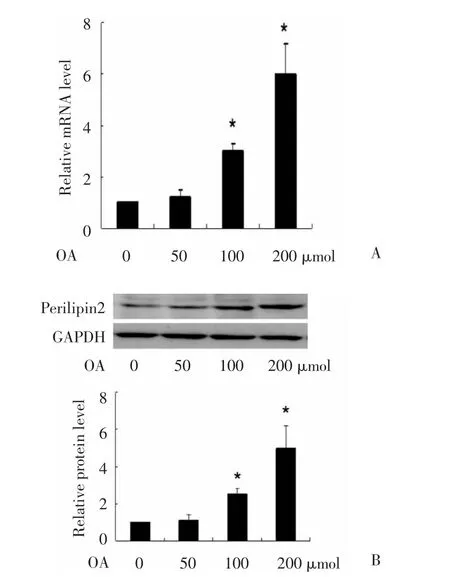
图1 油酸以浓度依赖方式上调RAW264.7细胞perilipin2 mRNA和蛋白的表达Fig.1 Oleic acid stimulated perilinpin2 expression in a dosedependent manner in RAW 264.7 cells
长链游离脂肪酸可诱导perilipin2表达,因此我们首先检测了长链游离脂肪酸的代表—油酸对鼠巨噬细胞系RAW264.7细胞perilipn2表达的影响。结果提示,油酸以剂量依赖的方式显著诱导了perilipin2 mRNA和蛋白的表达(图1)。由于200 μmol/L油酸对perilipin2 mRNA和蛋白表达的诱导作用最显著且未见任何毒性作用,因此我们选用浓度200μmol/L进行下一步研究。结果显示,200 μmol/L油酸以时间依赖的方式显著诱导了perilipin2 mRNA和蛋白的表达(图2),刺激24 h时诱导效果最显著。

图2 油酸以时间依赖方式上调RAW264.7细胞perilipin2 mRNA和蛋白的表达Fig.2 Oleic acid stimulated perilinpin2 expression in a timedependent manner in RAW 264.7 cells
2.2 PYC抑制油酸诱导的perilipin2表达
我们的前期研究证明,肝细胞中PYC可下调perilipin2的表达,从而抑制脂质在肝细胞的聚集[4]。因此,本研究中我们检测了PYC对巨噬细胞中perilipin2表达的影响。结果表明,PYC以剂量依赖方式显著抑制了油酸诱导的perilipin2 mRNA和蛋白的表达。50μg/mLPYC几乎完全抑制了油酸诱导的perilipin2表达(图3)。
2.3 PYC抑制油酸诱导的perilipin2启动子的活性

图3 PYC抑制油酸诱导的perilipin2表达Fig.3 PYC suppressed OA-induced perilipin2 expression
我们在前期研究中构建了包含perilipn2基因5′端转录调控区-2 090 bp的荧光素酶报告质粒。将其转染至RAW264.7细胞,通过荧光素酶活性分析,结果发现,油酸显著诱导了perilipin2启动子的活性,使其升高了4.5倍(图4)。下一步我们检测了PYC是否可以抑制油酸诱导的启动子活性。转染包含perilipin2启动子区域-2 090 bp pGL3荧光素酶表达质粒至RAW264.7细胞,50μg/mL PYC预处理1 h后,用油酸连续刺激24 h。荧光素酶活性分析结果显示,PYC显著抑制了油酸诱导的启动子活性(图4)。提示PYC通过抑制油酸诱导的perilipin2启动子的活性而抑制了perilipin2的表达。

图4 PYC抑制油酸诱导的perilipin2启动子活性Fig.4 PYCsuppressed OA-induced perilipin2 promoter activity
3 讨论
研究表明,PAT(perilipin,adipophilin,Tip47)家族蛋白镶嵌在细胞内脂肪滴表面,调控脂肪滴和脂质的生成、转运、聚集和脂肪分解。PAT家族蛋白包括 :perilipin,adipose differentiation-related protein(ADRP),tail-interacting protein of 47 kDa(TIP47),现重新命名为 perilipin1,perilipin2 和 perilipin3[5,6]。其中perilipin2在巨噬细胞、泡沫细胞及动脉硬化斑块中选择性高表达,提示perilipin2表达与动脉粥样硬化形成密切相关[7,8]。长链游离脂肪酸、oxLDL、VLDL、PPAR配体及 TRL4,9信号通路均可上调perilipin2 的表达[6,9,10]。由于长链脂肪酸是过氧化物酶体增殖物激活受体(peroxisome proliferators-activated receptor,PPAR)的配体,并通过激活PPAR来发挥其生物学作用,在人和鼠的perilipin2启动子上游均存在PPAR反应原件(PPRE),因此,我们推测长链脂肪酸是通过激活PPAR诱导perilipin2表达的[4,11,12]。本研究选用油酸作为长链脂肪酸的代表诱导perilipin2的表达,结果表明,在鼠巨噬细胞系RAW264.7细胞中,油酸以剂量和浓度依赖方式显著诱导了perilipin2 mRNA和蛋白的表达,浓度为200μmol/L时诱导作用最显著。接下来我们构建了包含PPRE的perilipin2启动子区域-2 090 bp的pGL3荧光素酶报告质粒。荧光素酶活性分析实验结果显示,油酸显著诱导了perilipin2启动子的活性,提示油酸通过激活PPAR诱导了perilipin2的表达。
研究显示,perilipin2过表达增加了人单核细胞系THP-1源性巨噬细胞的脂质蓄积,在诱导THP-1细胞向巨噬细胞分化的过程中或用氧化修饰的低密度脂蛋白和极低密度脂蛋白刺激THP-1源性巨噬细胞时,perilipin2的表达均上调[7]。另外,perilipin2在人动脉粥样硬化斑块和斑块内的泡沫细胞中也高度表达[8]。最近关于perilipin2和ApoE双基因敲除鼠的研究表明,perilipin2基因的敲除抑制了泡沫细胞形成及动脉粥样硬化的病变进展[3]。这些研究结果提示,perillipin2在巨噬细胞中的高表达与泡沫细胞形成和动脉粥样硬化的发生发展密切相关,抑制perilipin2的表达有助于延缓动脉粥样硬化进展。
PYC是法国海岸松树皮提取物,目前作为健康食品和化妆品成分已在包括中国在内的40多个国家上市。PYC由低聚原花青素、果酸及生物类黄酮等40多种小分子水溶性生物活性成分组成,是最强的天然抗氧化剂。研究表明,PYC具有调节免疫应答,降低2型糖尿病患者血糖、血脂,改善微循环的作用[13~16]。本研究结果首次证明,PYC以浓度依赖方式显著抑制了油酸诱导的鼠巨噬细胞perilipin2 mRNA和蛋白的表达,并可能因此抑制泡沫细胞的形成。为进一步明确其机制,我们检测了PYC对perilipin2启动子活性的影响。结果表明,PYC以浓度依赖方式抑制油酸诱导的perilipin2启动子活性,提示PYC是通过抑制PPAR活性而抑制启动子活性的。鉴于PPAR在调节脂质代谢过程中的复合作用,我们有理由相信抑制PPAR活性有可能是PYC调节脂质代谢异常的基本分子机制。
总之,本研究证明了在巨噬细胞中PYC抑制了油酸诱导的perilipin2表达,并进一步揭示PYC是通过抑制perilipin2启动子活性而直接抑制perilipin2表达的,为将来PYC应用于动脉粥样硬化的防治提供了理论支持。
[1]Liu PS,Ying YS,Zhao YM,et al.Chinesehamster ovary K2 cell lipid drop lets appear to be metabolic organelles involved in membranetraffic[J].JBiol Chem,2004,279(5):3787-3792.
[2]Kumi TS,Shintaro O,Toshiaki H,et al.The surface of lipid droplets is a phospholip idsmonolayer with a unique fatty acid composition[J].JBiol Chem,2002,277(46):44507-44512.
[3]Paul A,Chang BH,Li L,et al.Deficiency of adipose differentiationrelated protein impairs foam cell formation and protects against atherosclerosis[J].Circ Res,2008,102(12):1492-1501.
[4]Fan B,Ikuyama S,Gu JQ,et al.Oleic acid-induced ADRPexpression requires both AP-1 and PPARresponse elements,and is reduced by Pycnogenol through mRNA degradation in NMuLi liver cells[J].Am JPhysiol Endocrinol Metab,2009,297(1):112-123.
[5]Kimmel AR,Brasaemlle DL,Mcandrews-hill M,et al.Adoption of PERILIPIN as a unifying nomenclature for the mammalian PAT-family of intracellular,lipid storage droplet proteins [J].J Lipid Res,2010,51(3):468-471.
[6]Murphy DJ.The biogenesis and functions of lipid bodies in animals,plants and microorganisms[J].Prog Lipid Res,2001,40(5):325-338.
[7]Larigauderie G,Furman C,Jouye M,et al.Adipophilin enhances lipid accumulation and prevents lipid efflux from THP-1 macrophages:potential role in atherogenesis [J].Arterioscler Thromb Vasc Biol,2004,24(3):504-510.
[8]Wang X,Reape TJ,Li X,et al.Induced expression of adipophilin mRNA in human macrophages stimulated with oxidized low-density lipoprotein and in atherosclerotic lesions[J].FEBSLett,1999,462(1-2):145-150.
[9]Gu JQ,Wang DF,Yan XG,et al.A Toll-like receptor9-mediated pathway stimulatesperilipin3(TIP47)expression and induceslipid accumulation in macrophages [J].Am JPhysiol Endocrinol Metab,2010,299(4):E593-E600.
[10]Gu JQ,Ikuyama S,Wei P,et al.Pycnogenol,an extract from French martime pine,suppresses Toll-like receptor 4-mediated expression of adipose differentiation-related protein in macrophages[J].Am J Physiol Endocrinol Metab,2008,295(6):E1390-E1400.
[11]Forman BM,Chen J,Evans RM.Hypolipidemic drugs,polyunsaturated fatty acids,and eicosanoids are ligands for peroxisome proliferatoractivated receptors alpha and delta [J].Proc Natl Acad Sci USA,1997,94(9):4312-4317.
[12]Klieweer SA,Sundseth SS,Jones SA,et al.Fatty acids and eicosanoids regulategene expression through direct interactions with peroxisome proliferator-activated receptorsα and γ [J].Proc Nat Acad Sci USA,1997,94(9):4318-4323.
[13]Packer L,Rimbach G,Virgili F.Antioxidant activity and biologic properties of a procyanidin-rich extract from pine bark,PYC[J].Free Radic Biol Med,1999,27(5-6):704-724.
[14]Rohdewald P.A review of the French maritime pine bark extract(Pycinogenol),a herbal medication with a diverse clinical pharmacology[J].Int JClin Parm Ther,2002,40(4):156-168.
[15]Devaray S,Kaul N,Schonlau F,et al.Supplementation with a pine bark extract rich in polyphenols increases plasma antioxidant capacity and alters plasma lipoorotein profile [J].Lipids,2002,37(10):931-934.
[16]Liu X,Wei J,Tan F,et al.Antidiabetic effect of Pycnogenol French maritimepinebark extract in patientswith diabetestypeⅡ[J].Life Sci,2004,75(21):2505-2513.

