灯盏花注射液抗新生鼠缺氧缺血性脑损伤的作用及对Bcl-2、Bax蛋白表达的影响*
(河北大学医学部,保定071002)
新生儿缺氧缺血性脑损伤(hypoxic-ischemic brain damage,HIBD)是由于出生前或出生时缺氧所造成的,患儿多留有脑瘫、癫痫等神经系统后遗症。目前,对于新生儿缺氧缺血性脑损伤的有效治疗方法一直是国内新生儿科学的研究热点。近年来,中药对缺氧缺血性脑损伤的治疗作用越来越多的引起人们的关注。中药的活性成分可以多靶点地作用于脑缺血缺氧损伤后的环节。
灯盏花注射液(breviscapin injection,BI)具有抗氧化,清除自由基,扩张微血管的作用。目前,临床主要用于治疗脑梗塞引起的脑缺血,及其后遗症的治疗。本研究通过建立新生鼠缺氧缺血脑损伤模型,观察了灯盏花注射液干预新生大鼠HIBD后患侧海马CA1区神经元密度和组织学分级以及凋亡相关基因Bcl-2(B细胞淋巴瘤/白血病-2,B cell lymphoma/leukemia-2)、Bax(Bcl-2 associated X protein)蛋白表达情况,探讨灯盏花注射液对新生鼠脑损伤后Bcl-2、Bax蛋白表达的影响和神经元保护作用,从而为临床新生儿HIBD的治疗提供理论依据。
1 材料与方法
1.1 实验动物与分组
120只清洁级新生7日龄SD大鼠,由河北医科大学实验动物中心提供,体质量12~18 g,雌雄不限。随机分为6组(n=20):假手术组(Sham组):假手术组术中只暴露左侧颈总动脉,不结扎,术后也不进行缺氧;模型组(HIBD组):模型组按照吴婉芳[1]等的方法造模。造成脑组织的缺血缺氧损伤;对照组(Control组):对照组在造模完成后,即刻开始腹腔注射无菌注射用水,剂量为0.05 ml/10g,每天1次;灯盏花治疗组(BI-10mg、20mg、40mg):灯盏花治疗组在造模完成后,即刻开始腹腔注射灯盏花注射液,分为 10mg/kg、20mg/kg、40mg/kg三个亚剂量组,每天1次。
以上动物分别于造模后24h、3 d、7 d、14 d断头取材,硫堇染色后行脑组织病理学检查。
另96只新生7日龄SD大鼠随机分为4组(n=24):假手术组、模型组、10mg/kg灯盏花治疗组、对照组,于造模后24h、3 d、7 d、14 d断头取材,应用免疫组织化学方法观察凋亡相关基因Bcl-2、Bax蛋白表达情况,并计数各组各时间点免疫阳性细胞数目及积分光密度值。
1.2 药品与仪器
灯盏花注射液为神威药业生产,规格5 ml∶20mg。免疫组化试剂盒购自晶美生物工程有限公司生产。Bcl-2抗体,Santa公司(SC492);Bax抗体,Santa公司(SC526)。石蜡切片机,Leica公司;Olympus光学显微镜,日本Olympus光学工业株式会社;捷达JEDA801D形态学图像分析系统,江苏省捷达科技发展有限公司;二目显微镜摄像系统,北京麦克奥迪仪器仪表有限公司。
1.3 造模方法
参照吴婉芳[1]等的方法,将大鼠固定在手术板上。行颈部手术造成大鼠脑组织缺血:颈部正中切口,分离并双线结扎左侧颈总动脉。颈部术毕,恢复2 h。之后,将结扎后的新生鼠置于37℃恒温水浴2500ml密闭玻璃容器中,以1.5~2.5 l/min的速度输入体积浓度8%的氧气和92%氮气的混合气体。测氧仪监测舱内氧浓度,使之维持在7.5%~8.5%之间,持续2~3 h。缺氧完成后取出新生大鼠并放回母鼠笼中继续哺乳喂养。
1.4 染色方法
1.4.1 硫堇染色方法 在预定时间点将动物迅速断头取脑,冠状切取视交叉后1 mm至4 mm脑组织,将所取标本置于4%多聚甲醛固定液中固定48 h,梯度酒精脱水;二甲苯透明,石蜡包埋。将所取脑组织标本常规脑组织切片(5μm 厚),切片以二甲苯、梯度酒精(100%~70%)脱蜡至水,浸入0.25%硫堇溶液中47℃染色10min,80%~95%酒精脱色至适度,无水酒精脱水,二甲苯透明、中性树胶封片。
参照Kato分级方法[2],于光学显微镜下,根据迟发性神经元死亡(delayed neuronal death,DND)的程度,确定组织学分级(histological grade,HG)和神经元密度(neuronal density,ND),对海马CA1区组织学改变进行评价。(1)HG:0级,无神经元死亡;1级:散在神经元死亡;2级:成片神经元死亡;3级:几乎全部的神经元死亡。取左侧平均等级作为统计值。(2)ND:计数海马CA1区每1 mm区段内细胞膜完整、胞核饱满、核仁清晰的锥体细胞数目,每张切片左侧海马各计数3个区段取平均值作为统计值。
1.4.2 免疫组织化学染色方法 在预定时间点将动物迅速断头取脑,冠状切取视交叉后1 mm至4 mm脑组织,将所取标本置于4%多聚甲醛固定液中固定48 h,梯度酒精脱水;二甲苯透明,石蜡包埋。将所取脑组织标本常规脑组织切片(5μm厚),切片以二甲苯脱蜡及梯度酒精脱水,PBS洗 15 min,0.3%H2O2,甲醇液37℃下孵育15 min以去除内源性过氧化酶,PBS洗 3次,每次 5 min,0.01 mmol/L枸橼酸缓冲液修复抗原,置 95~98℃,20min;正常羊血清封闭,在37℃湿盒中温育20min,吸去血清,加入Bcl-2或Bax蛋白多克隆抗体(1∶100稀释),4℃过夜;依次加入生物素化二抗及三抗,室温下各孵育50min;DAB显色;镜下控制,流水冲洗终止,常规脱水,二甲苯透明,中性树胶封片。每次实验均设阴性对照,以PBS代替一抗,结果显示阴性。
判断标准:阳性反应胞浆内呈棕黄色染色,阴性结果则为胞浆内无棕黄色。计数400倍视野下海马CA1区Bcl-2或Bax蛋白表达阳性细胞数。
1.5 统计学处理
应用SPSS 13.0软件进行统计分析:组织学分级采用多样本资料的秩和检验。细胞计数以均数±标准差()表示,组间比较应用单因素方差分析。
2 结果
2.1 灯盏花注射液对海马CA1区神经元密度的影响
Sham组中,各时间点大鼠海马CA1区未见明显神经细胞缺失。HIBD组、Control组各时间点与Sham组比较,神经元密度明显降低(P<0.05),组织学分级显著增高(P<0.05)。BI-10mg组,与对照组相应时间点比较,神经元密度显著高于对照组(P<0.05),组织学分级明显降低(P<0.05)。20mg治疗组中,7 d时与Control组相应时间比较差别具有统计学意义。40mg治疗组中,各相应时间点与Control组比较,未见明显差别(表1,图1、4)。
Tab.1 Quantitative presentation of the number of survival pyramidalneurons in the CA1 hippocampus(,n=5)
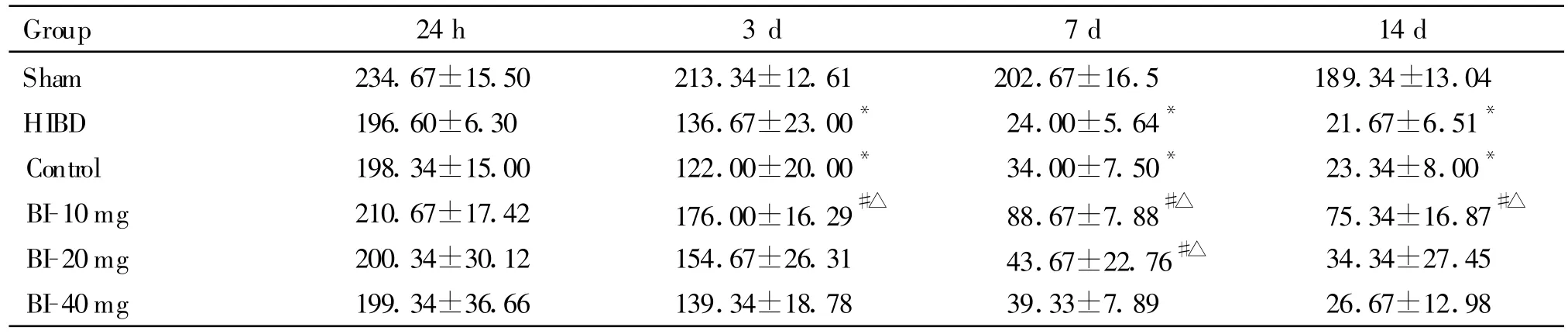
Tab.1 Quantitative presentation of the number of survival pyramidalneurons in the CA1 hippocampus(,n=5)
HIBD:Hypoxic-ischemic brain damage*P<0.05 vs sham group;#P<0.05 vs control group;△P<0.05 vs HIBD group
Group 24h 3 d 7 d 14 d Sham 234.67±15.50 213.34±12.61 202.67±16.5 189.34±13.04 HIBD 196.60±6.30 136.67±23.00* 24.00±5.64* 21.67±6.51*Control 198.34±15.00 122.00±20.00* 34.00±7.50* 23.34±8.00*BI-10mg 210.67±17.42 176.00±16.29#△ 88.67±7.88#△ 75.34±16.87#△BI-20mg 200.34±30.12 154.67±26.31 43.67±22.76#△ 34.34±27.45 BI-40mg 199.34±36.66 139.34±18.78 39.33±7.89 26.67±12.98
2.2 灯盏花注射液对海马CA1区神经元组织学分级的影响
Sham组中,组织学分级为0-1级;HIBD组、Control组各时间点与Sham组比较,组织学分级显著升高,为2-3级;BI各剂量组与Control组比较,组织学分级降低,为1-2级。

Fig.1 Histological grade(HG)of the CA1 hippocampus with each group
2.3 灯盏花注射液对海马CA1区神经元凋亡的影响
Sham组,大鼠海马CA1区未见明显的 Bcl-2、Bax阳性颗粒出现。HIBD组、Control组,与Sham组比较,Bcl-2、Bax蛋白表达于3 d时达到高峰。表现为阳性细胞数目最多,染色最深。BI-10mg治疗组中,与Control组比较:Bcl-2蛋白,阳性细胞数目增多,蛋白表达进一步增加,3 d增加最明显,7 d、14 d时表达逐渐回落(P<0.05);Bax蛋白,阳性细胞数目减少,蛋白表达减少,3 d最明显(P<0.05,表 2、3,图 2、3、5、6 见下页)。
Tab.2 Number of immunohistochemical staining positive cells in expression of Bcl-2 in the CA1 hippocampus(,n=6)
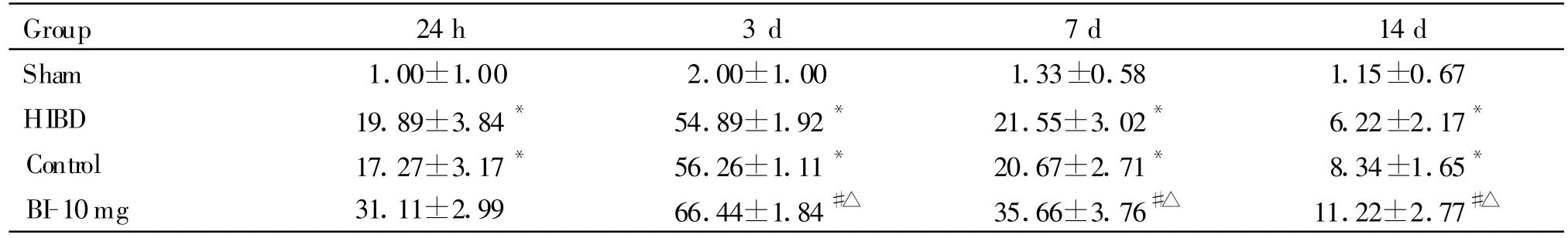
Tab.2 Number of immunohistochemical staining positive cells in expression of Bcl-2 in the CA1 hippocampus(,n=6)
*P<0.05 vs sham group;#P<0.05 vs control group;△P<0.05 vs HIBD group
Group 24h 3 d 7 d 14 d Sham 1.00±1.00 2.00±1.00 1.33±0.58 1.15±0.67 HIBD 19.89±3.84* 54.89±1.92* 21.55±3.02* 6.22±2.17*Control 17.27±3.17* 56.26±1.11* 20.67±2.71* 8.34±1.65*BI-10mg 31.11±2.99 66.44±1.84#△ 35.66±3.76#△ 11.22±2.77#△
Tab.3 Number of immunohistochemical staining positive cells in expression of Bax in the CA1 hippocampus(,n=6)
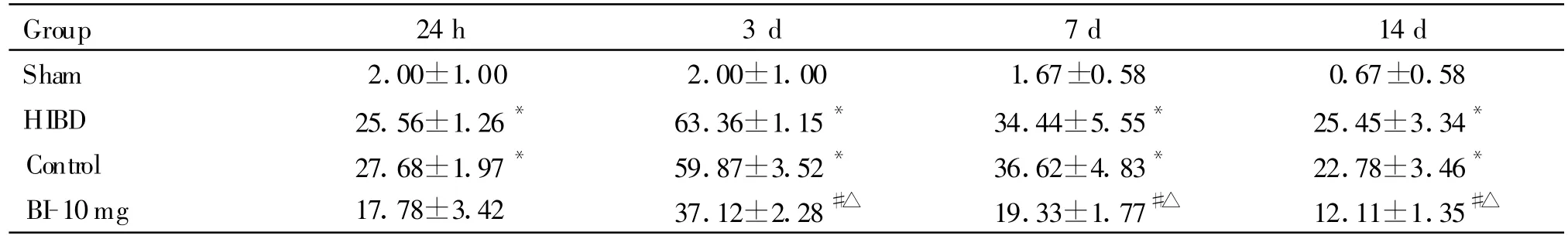
Tab.3 Number of immunohistochemical staining positive cells in expression of Bax in the CA1 hippocampus(,n=6)
*P<0.05 vs sham group;#P<0.05 vs control group;△P<0.05 vs HIBD group
Group 24h 3 d 7 d 14 d Sham 2.00±1.00 2.00±1.00 1.67±0.58 0.67±0.58 HIBD 25.56±1.26* 63.36±1.15* 34.44±5.55* 25.45±3.34*Control 27.68±1.97* 59.87±3.52* 36.62±4.83* 22.78±3.46*BI-10mg 17.78±3.42 37.12±2.28#△ 19.33±1.77#△ 12.11±1.35#△

Fig.2 Quantitative presentation of the immunohistochemistry with integral optical density(IOD)of the immunostaining on Bcl-2 expression in each group

Fig.3 Quantitative presentation of the immunohistochemistry with integral optical density(IOD)of the immunostaining on Bax expression in each group

Fig.4 Microphotographs of thionin staining showed breviscapin injection reduced delayed neuronal death(DND)of pyramidal neurons in the CA1 hippocampus(Thionin staining ×400,Scale bar=50μm)
3 讨论
新生儿HIBD病情重,病死率高,存活儿多留有脑瘫、癫痫等神经系统后遗症,其发病机制也十分复杂,是近年来新生儿科学的研究热点。目前研究认为,缺氧缺血脑损伤中,神经元的死亡方式除了被动的坏死外,还有主动死亡过程:凋亡、迟发性神经元死亡。而脑缺血缺氧的严重程度、持续时间决定了脑组织是通过坏死还是凋亡途径发生损伤。坏死发生于原发刺激的即刻,迟发性神经元死亡发生于数小时后,仅涉及神经元;凋亡出现于刺激后数小时至数天。根据各国学者对迟发性神经元死亡进行的一系列研究,提出其发生机制与兴奋性氨基酸的神经毒性作用、自由基的损伤作用、细胞内钙超载、能量代谢障碍、凋亡等方面有关。在HIBD过程中,凋亡神经元是否发生继发的能量衰竭决定了其是否会出现迟发性神经元死亡,而迟发性死亡的程度则决定了HIBD的远期预后[3]。

Fig.5 Microphotographs of immunohistochemical staining showed changes in expression of Bcl-2 in the CA1 hippocampus on3 d in each group(Immunohistochemical staining ×400,Scale bar=50μm)

Fig.6 Microphotographs of immunohistochemical staining showed changes in expression of Bax in the CA1 hippocampus on 3 d in each group(Immunohistochemical staining ×400,Scale bar=50μm)
Bcl-2家族与细胞凋亡关系密切。现已知与凋亡相关的基因基本上分为两大类[4]:一类是促进细胞凋亡的基因,如 Bax、Baxls、e-fos、e-jun、野生型p53、即早基因等;另一类是抑制凋亡的基因,如Bcl-2和Bcl-xl等。其中Bcl-2基因和Bax基因是目前较明确的一对在功能上相互对立的细胞凋亡调控基因,两者同属Bcl-2基因家族,且在中枢神经系统均有表达。Bcl-2是重要的抗凋亡基因,Bax则是与Bcl-2作用相反的促凋亡基因。原癌基因Bcl-2编码26 kD的胞浆蛋白,在发育的细胞中表达,而成熟或走向凋亡的细胞中不表达。在细胞的凋亡过程中主要发挥抗凋亡作用。Bax作为Bcl-2家族的另一成员,其功能与Bcl-2相反,过度表达可促进细胞凋亡。Bcl-2的过度表达可以与Bax竞争结合,形成Bax-Bcl-2异二聚体,从而抑制细胞凋亡作用[5,6]。Bcl-2蛋白和Bax蛋白在细胞内共存,但是存在形式有所差别。细胞中的Bcl-2蛋白常常以同源二聚体的形式存在,而Bax蛋白可自身形成同源二聚体,也可以和Bcl-2蛋白形成异源二聚体。当Bcl-2蛋白以同源二聚体形式存在时,细胞趋向于存活;但如果Bax蛋白大量表达并与Bcl-2蛋白形成异源二聚体或自身形成同源二聚体时,细胞趋向于死亡[7,8]。
灯盏花注射液是从云南菊科植物灯盏细辛(即灯盏花)提取精制而成的。现代研究认为,其有效成分为灯盏花总黄酮,包括a-羟基黄芩素和灯盏花素及其衍生物[9],灯盏花总黄酮具有抗凝、改善微循环、改善脂质代谢,清除自由基、减轻脂质过氧化,同时具有钙通道阻滞和蛋白激酶C(PKC)抑制等多方面药理作用[10]。临床上多用于高血压、冠心病、脑血栓形成、脑血管意外所致瘫痪等疾病的辅助治疗。
在本实验过程中观察到,Sham组,各时间点大鼠海马CA1区神经元排列整齐,胞核饱满,核仁清晰可见,位于中央。且未见有明显Bcl-2、Bax阳性颗粒出现。HIBD组、Control组,与Sham组相应时间点比较,出现较明显的神经元缺失、坏死,存活神经元数目减少,组织学分级升高;Bcl-2、Bax蛋白自24h开始表达逐渐增加,并于3 d时达到高峰(与其余各时间点比较差别有显著意义P<0.05)。表现为阳性细胞数目最多,染色最深,7 d、14 d表达又有所降低,但仍较Sham组为多(P<0.05)。灯盏花注射液10mg治疗组中,Bcl-2蛋白,与Control组各相应时间点比较,阳性细胞数目增多,蛋白表达进一步增加,3 d增加最明显,7 d、14 d时表达逐渐回落(P<0.05);Bax蛋白,与Control组比较,阳性细胞数目减少,蛋白表达减少,3 d最明显(P<0.05)。神经元密度显著增高(P<0.05),组织学分级明显降低(P<0.05)。20mg治疗组中,7 d时与Control组相应时间比较差别具有统计学意义。40mg治疗组中,各相应时间点与Control组比较,未见明显差别。由以上结果我们可以得出结论:应用灯盏花注射液对缺氧缺血脑损伤的新生鼠进行干预后,可使其海马CA1区神经元密度增加,组织学分级降低,表明灯盏花注射液可以减轻海马CA1区神经元的迟发性死亡。另一方面,应用灯盏花后,可使抗凋亡蛋白Bcl-2表达增加,而使促凋亡蛋白Bax表达降低。说明灯盏花注射液可以减轻新生大鼠缺氧缺血脑损伤后神经元的凋亡、迟发性神经元死亡的程度,从而对缺氧缺血脑损伤具有保护作用。
[1]吴婉芳,徐放生,张莉莉,等.建立新生儿缺氧缺血性脑病动物模型[J].新生儿科杂志,1992,7(6):265-267.
[2]Kato H,Liu Y,Araki T,et al.Temporal profile of the effects of pretreatmentwith brief cerebral ischemia on the neuronal damage following secondary ischemia insult in the gerbil:cumulative damage and protective effects[J].Brain Res,1991,553(2):238-242.
[3]Schulz J B,Weller M,Moskowitz M A.Caspases as treatment targets in stroke and neurodegenerative diseases[J].Ann Neurol,1999,45(4):421-429.
[4]Dragunow M,Preston K.The role of inducible transcription factors in apoptotic nerve cell death[J].Brain ResBrain Res Rev,1995,21(1):21-28.
[5]Cheng E H,Wei M C,Weiler S,et al.Bcl-2,Bcl-x(L)sequester BH3 domain-only molecules preventing Bax and Bak mediated mitochondrial apoptosis[J].Mol Cell,2001,8(3):705-711.
[6]D'Sa C,Klocke B J,Cecconi F,et al.Caspase regulation of genotoxin induced neural precursor cell death[J].J Neurosci Res,2003,74(3):435-445.
[7]Hanada M,Aime-Sempe C,Sato T,et al.Structure-function analysis of Bcl-2 protein.Identification of conserved domains important for homodimerization with Bcl-2 and heterodimerization with Bax[J].J Biol Chem,1995,270(20):11962-11969.
[8]Krajewski S,Mai J K,Krajewska M,et al.Upregulation of bax protein levels in neurons following cerebral inchemia[J].J Neurosci,1995,15(10):6364-6376.
[9]余传龙,黄泰康,丁志遵.中药词海第一版[M].北京.中国医药科技出版社.1993:2290.
[10]徐 光,张礼萍.野黄芩甙元及其类似物对蛋白激酶C的抑制作用[J].上海医科大学学报,1993,20(3):157-190.

