低氧暴露对大鼠外周血T淋巴细胞活化的影响*
田云梅,聂鸿靖,刘嘉瀛,张延坤,张东祥,汪 海
(军事医学科学院卫生学环境医学研究所军事环境医学研究中心,天津 300050)
我国高原地域辽阔,其中海拔3000m以上的高原主要分布在西部和西南部地区,约占全国总面积的1/4以上。人体快速进入3000m以上高原会因缺氧发生以呼吸、消化和中枢神经系统症状为主的急性高原反应,严重者会发展为高原肺水肿(high altitude pulmonary edema,HAPE)和高原脑水肿(high altitude cerebral edema,HACE)[1],长时间低氧暴露会引发高原心脏病和高原红细胞增多症(high altitude polycythemia,HAPC)等慢性高原病(chronic mountain sickness,CMS)[2]。研究表明高原低氧导致机体免疫功能异常[3],而这些功能异常可能与多种高原病的发生发展密切相关。这将严重影响高原进驻者的身体健康和高原作业效率,甚至危及生命,是亟待需要解决的问题。
低氧是一种应激刺激原,机体在刺激原的作用下,可以激发免疫细胞活化、分化和效应(免疫应答)。在免疫反应过程中,T淋巴细胞的活化依赖两个信号,即来自抗原与T细胞受体结合的第一信号和由抗原呈递细胞上的共刺激分子与T细胞表面的相应受体结合而产生的共刺激信号(第二信号),T淋巴细胞表面共刺激分子提供的第二信号的缺乏,将会使 T细胞进入克隆无能状态或发生凋亡[4]。CD28是T细胞上表达的具有重要功能的共刺激分子,对T细胞的活化起正向协同作用,可促进T细胞增殖、活化、IL-2分泌及抗凋亡因子Bcl-2的表达。目前尚缺乏有关高原低氧环境下CD28在机体淋巴细胞上表达变化的相关研究报道,因此本研究观察了低氧暴露后大鼠外周血T淋巴细胞亚群及其活化共刺激分子的变化,为进一步揭示高原病的发病机制及其研究防治措施提供依据。
1 材料与方法
1.1 实验动物与分组
健康雄性Wistar大鼠,体重160~180g,随机分为常氧对照组和低氧暴露组,每组10只,实验动物由军事医学科学院实验动物中心提供(合格证号:SCXK-(军)2007-004)。
1.2 主要试剂及仪器
Anti-rat CD3-FITC、anti-rat CD4-PE-cy5、anti-rat CD8-Percp、anti-rat CD28-PE、溶血素及上样管均购自BD公司,其他试剂为国产分析纯。BD FACS Calibur流式细胞仪为BD公司产品,LDZ5-2型低速自动平衡离心机为北京医用离心机厂产品。
1.3 急性低氧暴露条件及取材
大鼠适应性饲养3 d后,对照组动物在常氧环境中饲养,低氧暴露组置低压舱内进行减压低氧暴露:以10m/s速度上升至5000m停留5 min,以同样速度上升至7000m停留3 min,再以同样速度上升至8000m。模拟海拔8000m低氧暴露8 h后,以20m/s的速度降至海平面高度,第2天以同样的方式进行低氧暴露,持续10d,分别于低氧暴露前及低氧暴露后8 h、3 d、6 d和10d采血,测定大鼠外周血T淋巴细胞亚群。
1.4 外周血T淋巴细胞亚群测定
1.4.1 样品管制备 自大鼠后眼眶静脉丛采血200μl,肝素抗凝 ,分别制备阴性对照管,CD3+、CD4+、CD8+、CD28+单阳性对照管和样品管(表1),混匀后避光放置15 min。各管加2 ml溶血素,用涡旋震荡器充分混匀,使液体变透明,再避光放置9 min。500×g离心5 min,弃上清,加 2 ml PBS洗两次,后加700μl PBS重新悬浮,流式细胞仪测定各样品管T淋巴细胞亚群。

Tab.1 Preparation method of control tubes and sample tubes(μl)
1.4.2 流式细胞仪测定 打开cellquest软件,选择散点图,X轴为FSC,Y轴为SSC。打开获取条件窗口,调出获取条件 Detectors/Voltage,Threshold和Compensation。设定获取细胞数为10000,用阴性对照管调节细胞群,使细胞合理分布,选定淋巴细胞设门G1=R1,FSC>120(图 1A)。选择散点图,X 轴为CD3,Y轴为SSC,用CD3单阳性管设定CD3阳性细胞,设门G2=R2(图1B)。再作三个散点图:设定X轴为 CD3、Y 轴为 CD28、G1=R1(图 1C);设定X 轴为CD3、Y 轴为 CD4或 CD8、G1=R1(图 1D-E);设定X 轴为CD4或CD8、Y 轴为CD28、G2=R2(图1F-G)。用阴性对照管调节FL1、FL2、FL3电压,使细胞群位于图的左下角,十字设定阴性、阳性细胞界限。用CD3单阳性管,对照图1C调节FL2-FL1%荧光补偿;用CD4或CD8单阳性对照管,对照图1F/G调节FL2-FL3%荧光补偿;用CD28单阳性管,对照图1 C和F/G,分别调节FL1-FL2%和FL3-FL2%荧光补偿。先获取阴性对照管细胞,然后依次上样,测定各样品管。

Fig.1 Schematic diagram of setting the parameter of flow cytometer
1.5 统计学处理
2 结果
2.1 低氧暴露对大鼠体重的影响
模拟海拔8000m低氧暴露8 h后,低氧组大鼠体重(173.4±7.4)g较常氧对照组(183.8±6.0)g显著降低(P<0.05);模拟海拔8000m低氧暴露3 d后,低氧组大鼠体重进一步降低(P<0.01,167.7±7.5 vs 196.0±7.7)。随着低氧暴露时间的延长,低氧组大鼠体重增长率显著低于常氧对照组(P<0.01)。
2.2 低氧暴露对大鼠外周血T淋巴细胞亚群的影响
模拟海拔8000m低氧暴露8 h后,大鼠外周血CD3+、CD8+细胞数均显著降低 (P<0.01,表2),CD4/CD8显著增加(P<0.05);低氧暴露6 d后,CD4+细胞数也显著降低(P<0.01)。说明模拟海拔8000m低氧暴露早期,大鼠细胞免疫功能受到明显抑制。
Tab.2 Effect of hypoxia on peripheral blood T lymphocyte subsets in rats(,n=10)

Tab.2 Effect of hypoxia on peripheral blood T lymphocyte subsets in rats(,n=10)
*P<0.05,**P<0.01 vs before hypoxia;#P<0.05 vs hypoxia for 8 h;△P<0.05,△△P<0.01 vs hypoxia for 3 d;▲ ▲P<0.01 vs hypoxia for 6 d
Hypoxic time CD3+(%) CD4+(%) CD8+(%) CD4/CD8 Before hypoxia 66.66±4.46 44.77±5.00 21.27±3.31 2.15±0.36 Hypoxia for 8 h 59.04±7.14** 40.28±6.22 16.30±1.54** 2.48±0.36*Hypoxia for 3 d 57.95±5.78** 38.86±5.76 15.91±3.12** 2.53±0.64 Hypoxia for 6 d 55.92±5.97** 35.53±3.33**# 18.35±3.66* 1.99±0.34#△Hypoxia for 10d 51.36±7.68**△▲▲ 33.89±5.55**#△ 17.05±3.86* 2.03±0.34#△△
2.3 低氧暴露对大鼠外周血T淋巴细胞活化共刺激分子的影响
模拟海拔8000m低氧暴露8 h后,大鼠外周血CD8+CD28+、CD8+CD28-细胞数均显著降低;低氧暴露3 d后,CD4+CD28+细胞数显著降低(P<0.01,图2A),CD4+CD28-细胞数显著增加(P<0.01,图2B),CD8+CD28+、CD8+CD28-细胞数有所恢复;低氧暴露6 d后,大鼠外周血CD8+CD28+细胞数显著增加(P<0.01,图2A)。说明模拟海拔8000m低氧暴露8 h和3 d后,大鼠外周血 CD8+、CD4+T淋巴细胞活化水平均显著下降,随着低氧暴露时间的延长,CD8+T淋巴细胞活化水平由降低变为增加。
3 讨论
在淋巴细胞中占相当比例的T淋巴细胞(CD3+),根据其表面标志和功能特征,可分为CD4+和CD8+两个细胞亚群。CD4+细胞为辅助性T细胞,是免疫反应的中心细胞。CD4+T细胞在胸腺主要产生Th1型细胞和Th2型细胞,其中Th1型细胞可以产生IL-2,TNF-α,INF-γ等细胞因子,它们可以促进细胞介导的免疫反应;Th2型细胞可以产生如IL-4,IL-10等细胞因子,它们可以刺激B细胞产生抗体。CD8+细胞为细胞毒性T细胞,是免疫反应的效应细胞。研究表明模拟海拔8000m低氧暴露10d期间,大鼠外周血CD3+、CD4+、CD8+细胞数均有不同程度的下降,CD3+、CD4+细胞数下降趋势与小鼠试验基本相同[5]。实验结果提示模拟海拔8000m低氧暴露10d期间,大鼠细胞免疫功能紊乱。
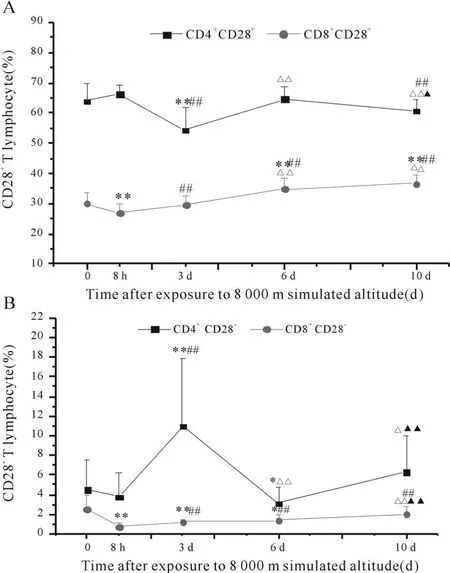
Fig.2 Effect of hypoxia on peripheral blood CD28+and CD28-T lymphocyte subsets in rats(¯x ± s,n=10)
T细胞活化并发挥效应作用需要两个信号:一是抗原特异性刺激信号,另一个是T淋巴细胞协同刺激因子所提供的第二信号。T细胞表面有许多重要的共刺激分子,参与T细胞的活化、增殖及发挥效应功能,其中CD28是特异性细胞免疫应答所必需的信号。依据CD28的表达与否,可将T细胞分为CD8+CD28+、CD8+CD28-、CD4+CD28+、CD4+CD28-四个细胞亚群。
CD8+CD28+T细胞是主要组织相容性复合体-1类限制性细胞毒前体细胞,具有MHC-1类限制细胞毒活性,在CD4细胞分泌的细胞因子作用下,分化为效应性杀伤T细胞[6];CD4+CD28+T细胞是代表大多数辅助性T细胞。本实验从T细胞活化共刺激分子角度研究低氧暴露对T淋巴细胞活化的影响,结果表明模拟海拔8000m低氧暴露8 h后,CD8+CD28+T细胞显著下降,低氧暴露 3 d后,CD4+CD28+T细胞也显著下降,提示低氧暴露早期T淋巴细胞活化水平降低。
CD8+CD28-T细胞具有短的端粒,分化能力比CD8+CD28+T细胞低,是一种终末细胞,是由于抗原的慢性刺激而由CD8+CD28+细胞分化而来,能直接作用于辅助性T细胞,可以通过抑制抗原提呈细胞CD40信号通路从而抑制CD4+T细胞的增殖。体外实验证明CD8+CD28-T细胞可以抑制IFN-γ的产生,从而对炎症疾病具有保护作用[7]。Komocsi等[8]报道,使用 anti-CD3 MAb刺激Wagener's肉芽肿患者外周血及肉芽肿内的CD4+CD28-T细胞,并体外克隆扩增24h后测定细胞因子水平,发现CD4+CD28-T细胞大量分泌 IFN-γ及TNF-α,与此同时在CD28分子缺乏时保持对IL-12的敏感性,扩大Th1细胞的效应。本次实验研究表明模拟海拔8000m低氧暴露 8 h后,大鼠外周血CD8+CD28-细胞水平显著性下降;低氧暴露3 d后,大鼠外周血CD4+CD28-T细胞数显著增加。
低氧暴露后,大鼠外周血T淋巴细胞亚群的这个变化过程可能有两种解释:一是高原低氧暴露后,促肾上腺皮质激素、环腺苷酸和糖皮质激素显著增加[9],从而免疫系统受到抑制,机体可能通过减少对免疫反应的负调节作用和增加Th1型细胞因子的分泌来实现免疫反应的稳态,在此过程中可能会导致Th1型和Th2型细胞因子分泌失衡。二是在高原早期肺水肿患者的肺泡灌洗液中前炎症因子显著增加[10],大鼠外周血T淋巴细胞的变化过程可能与低氧暴露后前炎症因子增加有关。
[1]Norboo T,Saiyed H N,Angchuk P T,et al.Mini review of high altitude health problems in Ladakh[J].Biomed Pharmacother,2004,58(4):220-225.
[2]Penaloza D,Arias-Stella J.The heart andpulmonary circulation at high altitudes:healthy highlanders and chronic mountain sickness[J].Circulation,2007,115(9):1132-1146.
[3]Facco M,Zilli C,Siviero M,et al.Modulation of immune response by the acute and chronic exposure to high altitude[J].Med Sci Sports Exerc,2005,37(5):768-774.
[4]Roelen D L,Bushell A R,Niimi M,et al.Immunoregulation by CD4T cells in the induction of specific immunological unresponsiveness to allantigens in vivo:evidence for a reduction in the frequency of alloantigen-specific cytotoxic T cells in vitro[J].Hum Immunol,1998,59(9):529-539.
[5]田云梅,聂鸿靖,刘嘉瀛,等.高原低氧免疫损伤及其干预措施的研究[J].中国应用生理学杂志,2010,26(4):404-410.
[6]Dalod M,Sinet M,Deschemin J C,et al.Altered ex vivo balance between CD28+and CD28-cells within HIV specific CD8+T cells of HIV-seropositive patients[J].Eur J Immunol,1999,29(1):38-44.
[7]Ménager-Marcq I,Pomié C,Romagnoli P,et al.CD8+CD28-regulatory T lymphocytes prevent experimental inflammatory bowel disease in mice[J].Gastroenterol,2006,131(6):1775-1785.
[8]Komocsi A,Lamprecht P,Csernok E,et al.Peripheral blood and granuloma CD4+CD28-T cells are a major source of interferon-gamma and tumor necrosis factor-alpha in Wegener's granulomatosis[J].Am J Pathol,2002,160(5):1717-1724.
[9]Kaur C,Singh J,Peng CM,et al.Upregulation of adrenocorticotrophic hormone in the corticotrophs and downregulation of surface receptors and antigens on the macrophages in the adenohypophysis following an exposure to high altitude[J].Neurosci Lett,2002,318(3):125-128.
[10]Kubo K,Hanaoka M,Hayano T,et al.Inflammatory cytokines in BAL fluid and pulmonary hemodynamics in high altitude pulmonary edema[J].Respir Physiol,1998,111(3):301-310.

