小鼠负重游泳后血清代谢模式变化分析*
吴健全,郭长江,高蔚娜,刘 晋,韦京豫,杨继军
(军事医学科学院卫生学环境医学研究所,天津 300050)
在运动过程中,机体的工作能力或工作效率下降,不能维持在特定水平上,经过适当休息可以恢复的生理现象,称为运动性疲劳。对于疲劳的研究已逾百年历史,但疲劳发生的具体机制目前仍未十分明了。许多假说用来解释疲劳现象[1],如代谢物堵塞、能源耗竭、内环境稳定性失调、保护性抑制、神经-肌肉疲劳控制链“突变”理论等。这些学说都曾成功解释了疲劳某一方面现象,在运动性疲劳及其预防研究中发挥过一定的作用,但由于疲劳过程涉及骨骼肌、呼吸、循环、神经-内分泌-免疫等多系统功能,表现为复杂的网络化调节,目前还没有一种理论能够完全把握疲劳过程中的各种现象。
代谢组学是一种新兴的组学技术,通过测定生物样品内源性代谢产物含量,并采用模式识别方法对机体代谢表型进行分析,高通量、全景式研究生物体在生理、病理等状况下发生的各种代谢动态变化,有助于发现外来因素对机体发挥作用的靶器官和位点,确定特异性生物标记物,为作用机制研究提供新的研究方向或思路[2]。
本研究以非耐力训练小鼠为研究对象,采用一次性负重游泳方式建立疲劳模型,采用代谢组学分析方法研究疲劳过程机体代谢表型变化,从物质和能量代谢角度探讨疲劳过程及其机制,为正常人群疲劳干预措施研究提供理论依据。
1 材料与方法
1.1 动物
SPF级雄性昆明小鼠60只,体质量18~20g,由军事医学科学院实验动物中心提供,许可证号:SCXK-(军)2007-004。
1.2 方法
小鼠按体重随机分为4组,每组5只。分别为正常对照组和3个运动组,均给予AIN-93合成饲料,喂养14 d。喂养期间小鼠适应性游泳2次,每次10min。第15天运动组小鼠尾部系相当体重2%的铅丝,置水温35℃,水深30cm的桶中进行负重游泳试验,时间分别为30min,60min和120min。游泳后擦干动物体表水分,乙醚麻醉,摘眼球取血,分离血清,-20℃冻存。
1.3 1H NMR分析
离心管中加入 100μl 3-三甲基硅烷基-2,2,3,3-四氘代丙酸钠(TSP,Merck)的重水(D2O,美国Cambridge Isotope Laboratories)溶液(1mg/ml),150μl血清以及 350μl重水,充分震荡混匀后,用 Eppendorf MiniSpin Plus型离心机13000r/min离心10min。取550μl上清加入核磁共振管中待用。
在Varian INOVA 600MHz超导核磁共振谱仪(美国Varian)上调用驰豫编辑(Carr-Purcell-Meiboom-Gill,CPMG)和扩散 编辑(Long-eddy-delay,LED)脉冲序列对样品进行检测。CPMG谱宽为8000Hz,采样点数32 k,采样时间2 s,累加次数128次,其间采用低功率脉冲对水峰进行预饱和。LED谱宽为8000Hz,采样点数32 k,采样时间2 s,累加次数128次,扩散时间为100ms,其间采用低功率脉冲对水峰进行预饱和。在对自由感应衰减(free induction decay,FID)信号数据进行填零,分别加上0.5 Hz(CPMG实验)和3 Hz(LED实验)的线增宽因子后进行傅立叶变换转得到1H NMR谱图。以乳酸甲基信号双峰的左侧峰定为δ 1.33。
1.4 数据处理
CPMG数据和LED数据分段积分,将积分按每张谱的总积分强度归一化。所得数据输出并转换到Excel文件保存,以SIMCA-P+软件(v10.04,Umetrics,Umea,Sweden)进行多元统计分析。数据采用平均中心化(mean centering)或Pareto标度化进行预处理之后采用PCA分析。为强化组间差异,进一步采用PLS-DA或OSC分析。分析结果以得分图(scores plot)和载荷图(loadings plot)的形式表示。得分图采用各样本在前2个主成分坐标中的位置来表示,反映样本间的分布,从中可以得出样本之间的差异;载荷图反映各积分段对样本主成分得分值的贡献大小,结合得分图中组间分布差异,可找出对这种差异贡献较大的一些积分段;由其对应的化学位移并结合1H NMR谱图,可确定相应的代谢物,从而对样品中某些代谢物的变化及其可能意义进行深入分析。
2 结果
2.1 负重游泳后小鼠血清1H NMR图谱的变化
从小鼠血清CPMG1H NMR谱可看出,小鼠血样内源性小分子代谢产物随游泳时间而发生变化,各主要波峰的归属为β-羟丁酸(1.2)、乳酸(1.31-1.33,4.10-4.12)、乙酸(1.92)、丙酮(2.22)、丙酮酸(2.26)、胆碱(3.20)、磷酸胆碱(3.22,3.23)、丙氨酸(1.46,1.47)、葡萄糖(3.4~4.0)、脂类(0.86)等。运动过程中乳酸、β-羟丁酸、丙酮、脂类等谱峰随运动时间不断增大,而糖类则相反。另外运动过程中胆碱和磷酸胆碱谱峰减小也是较典型改变(图1)。
小鼠血清LED1H NMR谱显示运动过程中血清脂类相关代谢产物随游泳时间也发生相应变化,主要波峰有极低密度脂蛋白(VLDL,1.18,1.34,1.38)、低密度脂蛋白(LDL ,0.9,1.3)、高密度脂蛋白(HDL,0.82,0.86,1.26)、不饱和脂肪酸(5.3)、脂质(1.58)、磷脂酰胆碱(3.22)、N-乙酰糖蛋白(N-acetylglycoprotein,2.02)、O-乙酰糖蛋白(O-acetylglycoprotein,2.14)。运动后脂蛋白、不饱和脂肪酸、脂质、NAc谱峰明显增大,磷脂酰胆碱、OAc谱峰减小。
2.2 CPMG实验1H NMR图谱模式识别
小鼠血清CPMG实验1H NMR谱波峰积分值的PLS-DA结果见图2。3个游泳组代谢模式与正常对照组有明显差异,随着游泳时间延长差异有逐渐增大的趋势。从因子载荷图中可以发现导致这种差异的主要代谢产物,其中较正常对照组升高的化合物有β-羟丁酸、乙酸、乳酸,降低的化合物有葡萄糖、胆碱、磷酸胆碱、丙氨酸等。
2.3 LED实验1H NMR图谱模式识别
正常对照组与其他三组基本沿t1方向分离,30min组、120min组沿t2方向与60min游泳组有一定差异。从因子载荷图可以看出,与正常对照组相比,游泳后小鼠血清磷脂酰胆碱水平降低,而HDL、LDL和VLDL等脂蛋白以及不饱和脂肪酸、N-乙酰糖蛋白、脂质水平等均明显升高。排除正常对照组,对3个游泳组进行比较,结果表明,随着游泳时间延长,HDL、LDL和VLDL等脂蛋白以及不饱和脂肪酸、N-乙酰糖蛋白、脂质水平均相应升高,而磷脂酰胆碱水平则逐渐降低。
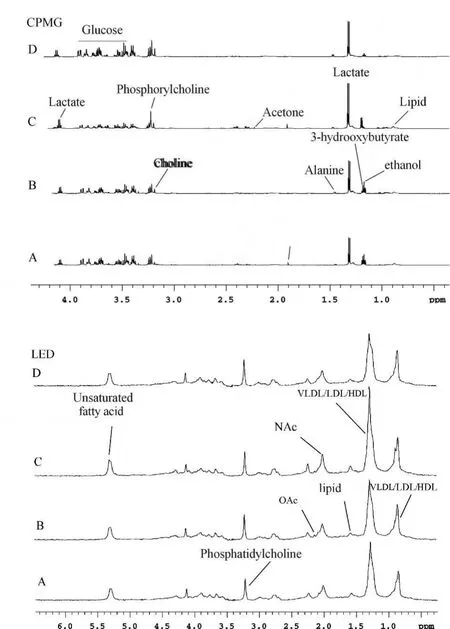
Fig.1 Serum spectra of 600-MHz 1H NMR in rats after different time of loading swimming
3 讨论
用于运动性疲劳研究的模型有多种,本研究以非耐力训练的小鼠为研究对象,采用一次性负重游泳的方式建立疲劳模型,可以直接分析疲劳过程生理、生化改变,避免反复训练过程由于疲劳-恢复-适应等过程带来的影响,结果更适用于针对一般人群或非训练人群的代谢研究需要。

Fig.2 Scores and loading plot derived from CPMG 1H NMR of the mice serum

Fig.3 Scores and loading plot from LED 1H NMR of the mice serum
代谢组分析结果表明,疲劳后血清成分发生显著变化,对代谢表型改变具有明显贡献的化合物主要有三大营养物质及其代谢中间产物如β-羟基丁酸、乳酸、丙氨酸、葡萄糖、脂蛋白、糖蛋白、脂肪酸等,与文献报告基本一致[3]。另外本研究发现运动过程中胆碱、磷酸胆碱和磷脂酰胆碱水平较正常对照组均明显降低,值得关注。运动过程随着糖类物质大量消耗,脂肪动员加强,导致大量游离脂肪酸释放入血,长链脂肪酸必须经活化成脂酰CoA,再通过肉碱脂酰转移酶Ⅰ转运,才能进入线粒体内膜氧化[4]。如果游离脂肪酸不能与肉碱结合,就会通过脂肪酸穿梭作用破坏线粒体膜电位,干扰ATP合成[5]。肉碱的生物合成需要S-腺苷甲硫氨酸提供活性甲基供体。胆碱可以氧化为甜菜碱参与蛋氨酸再甲基化途径,间接参与S-腺苷甲硫氨酸的合成。在蛋氨酸再甲基化途径中,高半胱氨酸在甜菜碱高半胱氨酸甲基转移酶作用下,可由甜菜碱提供活性甲基转变为内源性蛋氨酸,继而在甲硫氨酸腺苷转移酶作用下转变为S-腺苷甲硫氨酸(SAM)参与肉碱合成代谢[6]。因此胆碱可能通过参与肉碱合成而影响脂肪酸氧化。运动后机体胆碱和磷酸胆碱水平均下降可能是制约机体脂肪酸氧化供能的一个关键环节,这可能是导致机体能量合成不足以及出现疲劳的一个重要原因。作为代偿机制,膜结构中的磷脂酰胆碱可能部分分解释放入血,这样又可能导致膜正常结构和功能的异常。本研究所观察到的糖蛋白水平变化可能与之相关。N-乙酰糖蛋白和O-乙酰糖蛋白都是细胞膜正常组分,血中含量变化很可能是细胞膜受损伤的表现。
作为机体重要的甲基供体之一,胆碱类物质还可能通过影响DNA甲基化从而调节运动后基因表达,对机体代谢发挥作用。DNA甲基化是指在DNA甲基转移酶(DNA methyltransferase,DNMTs)的作用下,将SAM提供的甲基共价结合到CpG二核苷酸的胞嘧啶5′碳位上的过程,是最常见的表观遗传(epigenetic)现象[7]。合成SAM需要叶酸、VitB12、甲硫氨酸、胆碱和甜菜碱等营养物质,胆碱缺乏可直接导致SAM水平降低,引起实验动物多种结构或功能基因低甲基化或超甲基化,表达出现异常,并导致机体功能异常改变[8]。运动后机体某些基因表达出现显著改变,这些变化与运动过程机体代谢方式相适应,机体内环境的稳定有赖于不同表达基因间的相互作用与协调[9]。可以推测运动后机体胆碱类水平下降可能也会涉及运动诱发相关基因甲基化异常,表达出现异常,导致机体代谢出现紊乱,这可能是疲劳发生的另一个重要原因。
综上所述,本研究采用1H NMR方法分析了不同时间负重游泳对小鼠血清代谢组的影响,探讨了本研究模型中物质代谢的基本特点及其变化规律。结合运动过程中能量代谢特点以及脂肪动员的特殊意义,针对胆碱类物质代谢规律和作用开展营养抗疲劳研究应该是一项值得考虑的工作。
[1]王瑞元主编.运动生理学[M].北京:人民体育出版社,2002.
[2]Kussmann M,RezziS,Daniel H.Profiling techniques in nutrition and health research[J].CurrOpin Biotechnol,2008,19(2):83-99.
[3]Yan B,A J,Wang G,et al.Metabolomic investigation into variation of endogenous metabolites in professional athletes subject to strength-endurance training[J].J Appl Physiol,2009,106(2):531-538.
[4]Rufer A C,Thoma R,Hennig M.Structural insight into function and regulation of carnitine palmitoyltransferase[J].Cell Mol Life Sci,2009,66(15):2489-2501.
[5]Feldkamp T,Kribben A,Roeser N F,et al.Alleviation of fatty acid and hypoxia reoxygenation induced proximal tubule deenergization by ADP/ATP carrier inhibition and glutamate[J].Am J Physiol Renal Physiol,2007,292(5):F1606-F1616.
[6]Setoue M,Ohuchi S,Morita T,et al.Choline deprivation induces hyperhomocysteinemia in rats fed low methionine diets[J].J Nutr Sci Vitaminol,2008,54(6):483-490.
[7]Mathers J C.Nutritional modulation of ageing:genomic and epigenetic approaches[J].Mech Ageing Dev,2006,127(6):584-589.
[8]Kovacheva V T,MellottT J,Davison JM,et al.Gestational choline deficiency causesglobal andIgf2 gene DNA hypermethylation by up-regulation of Dnmt1 expression[J].J Biol Chem,2007,282(43):31777-31788.
[9]Flueck M.Tuning of mitochondrial pathwaysby muscle work:from triggers to sensors and expression signatures[J].Appl Physiol Nutr Metab,2009,34(3):447-453.

