局部高频电刺激海马对海人酸致痫大鼠海马细胞外谷氨酸和γ-氨基丁酸释放的影响*
林婉挥,黄华品,林明星,陈圣根
(福建医科大学附属协和医院神经内科,福州 350001)
癫痫是一种常见的神经系统疾病,发病率高,近30%发展为难治性癫痫。其中一部分病人可通过手术获得明显效果,但仍有一部分病人不适合手术治疗或者手术治疗无效。而脑深部电刺激(deep brain stimulation,DBS)用来治疗顽固性癫痫已有较长的历史,其治疗结果令人鼓舞。其主要的刺激靶点有小脑、丘脑中央中核、丘脑底核(subthalanuc nucleus,STN)、丘脑前核、尾状核、苍白球、海马、皮质局限性病灶等,其中STN备受关注。近期,Handforth等[1]研究发现,给予双侧丘脑底核电刺激可以减少部分性癫痫患者的发作频率和缓解发作程度,但不能阻止癫痫发作所致的继发性损伤,与抗癫痫药物的疗效相比,并无明显优越性。因此有必要寻找其他刺激部位以提高疗效。通常认为丘脑是大脑皮质兴奋的起搏器,而颞叶癫痫的海马异常放电可引起丘脑的异常电活动,并向上传播使大脑皮质异常放电,导致癫痫发作。电刺激边缘系统已经成功的应用于治疗颞叶癫痫病人,同样也能控制癫痫动物模型的发作[2]。其可能的机制是高频电刺激海马抑制了兴奋性氨基酸神经元的输出,阻止了丘脑向大脑皮质的异常放电的传播,即通过调节兴奋性氨基酸与抑制性氨基酸的平衡起到治疗颞叶癫痫的作用[3]。
本实验在观察高频电刺激海马对海人酸致痫大鼠癫痫发作影响的同时,利用脑微透析技术联合高效液相分析技术动态监测海马细胞外液谷氨酸(Glu)和γ-氨基丁酸(GABA)的浓度变化,以探讨高频电刺激海马治疗癫痫可能的机制。
1 材料与方法
1.1 实验动物与材料
SD清洁级雄性成年大鼠40只,体质量200~250g,2个月龄,购自中国上海斯莱克实验动物有限公司,12 h光照12 h黑暗交替,自由摄取食物和水。海人酸、Glu标准品、GABA 标准品、EDTA、邻苯二甲醛、β-巯基乙醇(均购自美国Sigma公司),甲醇为色谱醇(德国Merk公司)。
1.2 癫痫模型的建立
将动物先分成两大组:空白组(10只)、海人酸组(30只)。海人酸组予腹腔注射海人酸(10mg/kg),30min后如无Ⅳ级(按Racine分级标准[4])以上发作,每隔15 min注射1 mg/kg追加剂量,直至出现3次Ⅳ级以上发作方认为癫痫模型成功。注射后14天内利用视频脑电仪(型号KT-88-2400,北京康泰)大鼠行为学和皮层脑电图变化。空白组则予海人酸相同体积量生理盐水腹腔注射。
1.3 植入刺激电极
海人酸组随机分为3组(n=10):海人酸组未予其他处理,假刺激组予植入刺激电极但未刺激,电刺激组。10%水合氯醛(2 ml/kg)腹腔注射麻醉大鼠后,在脑立体定位仪(Stoelting公司)的帮助下将同心圆式自制电极缓慢插入右侧海马(前囟后4.8 mm,矢状右旁开5.2 mm,水平面下7.0mm,前后囟距离9.0mm),牙托粉固定。连接YC-2型程控电刺激器(成都仪器厂),模型制作成功后予进行电刺激,每天至少30min,直至癫痫波明显减少,刺激参数:强度100UA ,波宽60US,频率130Hz。
1.4 脑微透析方法的建立
在脑立体定位仪的帮助下将微透析引导管植入右侧海马(前囟后4.8 mm,矢状右旁开5.0mm,水平面下4.6 mm,),套上项圈,术后置于单笼饲养,术后3 d开始微透析实验:在大鼠清醒状态下移去引导管针芯,植入CMA/12微透析针(内径0.05 mm,膜长4 mm,瑞典CMA公司),项圈固定在大鼠自由活动装置仪上,微透析针输入端与CMA/102微量注射泵相连,输出端接CMA170冷收集器,微量泵内充满人工脑脊液,以2μl/min速率持续灌注,灌注2 h平衡后开始收集微透析液,每管收集15 min,分别在注射前、注射后30min、第 1天、第 4天、第 7天、第14天连续采集3管,存入-80℃冰箱择期检测。
1.5 高效液相-荧光检测器(美国 Waters公司)柱前衍生法检测透析液中Glu、GABA的浓度
13.5 mg OPA 、500μl MeOH 、5μl β-巯基乙醇加入4.5 ml硼酸盐缓冲液混匀,检测前予硼酸盐缓冲液稀释 2 倍,取 20μl与 35μl硼酸盐缓冲液及 5μl透析样品混匀,静置约1 min待衍生反应完全后,吸20μl注入进样器。色谱条件:检测系统为Multiλ Fluorescence Detector(Waters 2475),反相色谱柱 Nova-pak C18(150mm ×3.9mm ,粒径5μm),利用单泵恒流洗脱,设定柱温30℃,流速1.0ml/min,荧光检测器设定激发波长为Ex330nm,发射波长为Em420nm,流动相为:0.1 mol/L磷酸氢二钠,1 mmol/L EDTA和25%MeOH,调pH值至6.4。检测后采用Empower分析软件对峰下面积积分,再以标准品浓度-峰下面积做校正曲线,计算样品的浓度。
1.6 统计学方法
2 结果
2.1 大鼠行为学和脑电变化
2.1.1 大鼠行为学改变 空白组(KB)大鼠行为学未见癫痫发作;致痫组呈现急性期、静止期、慢性期改变。从图1A看出:与海人酸组(KA)比较电刺激组(DBS)明显减少慢性期反复自发性发作的次数(P<0.05);而假刺激组(Pseudo-DBS)则无明显改变。
2.1.2 大鼠脑电图改变 如图1C中的图(a)所示,海人酸注射前以α波为主,海人酸注射后急性期以阵发性棘波、尖波为主如图(b),静止期以α波为主以及散在慢波如图(c),慢性期出现阵发性的棘慢复合波如图(d)。电刺激能明显减少痫性放电频率(P<0.05);而假刺激组则无明显改变(P>0.05,图1B)。
2.2 不同时间大鼠海马细胞外Glu的浓度变化
如图2所示,注射海人酸前4组的基础值无明显差异,注射海人酸后与空白组(KB)比较海人酸组、假刺激组、电刺激组的Glu均明显升高,以第1天最为显著(250%左右),并持续至第14天(150%左右),与海人酸组比较电刺激组Glu明显下降(P<0.01),而假刺激组则无明显改变;与假刺激组比较电刺激组Glu也明显下降(P<0.01)。
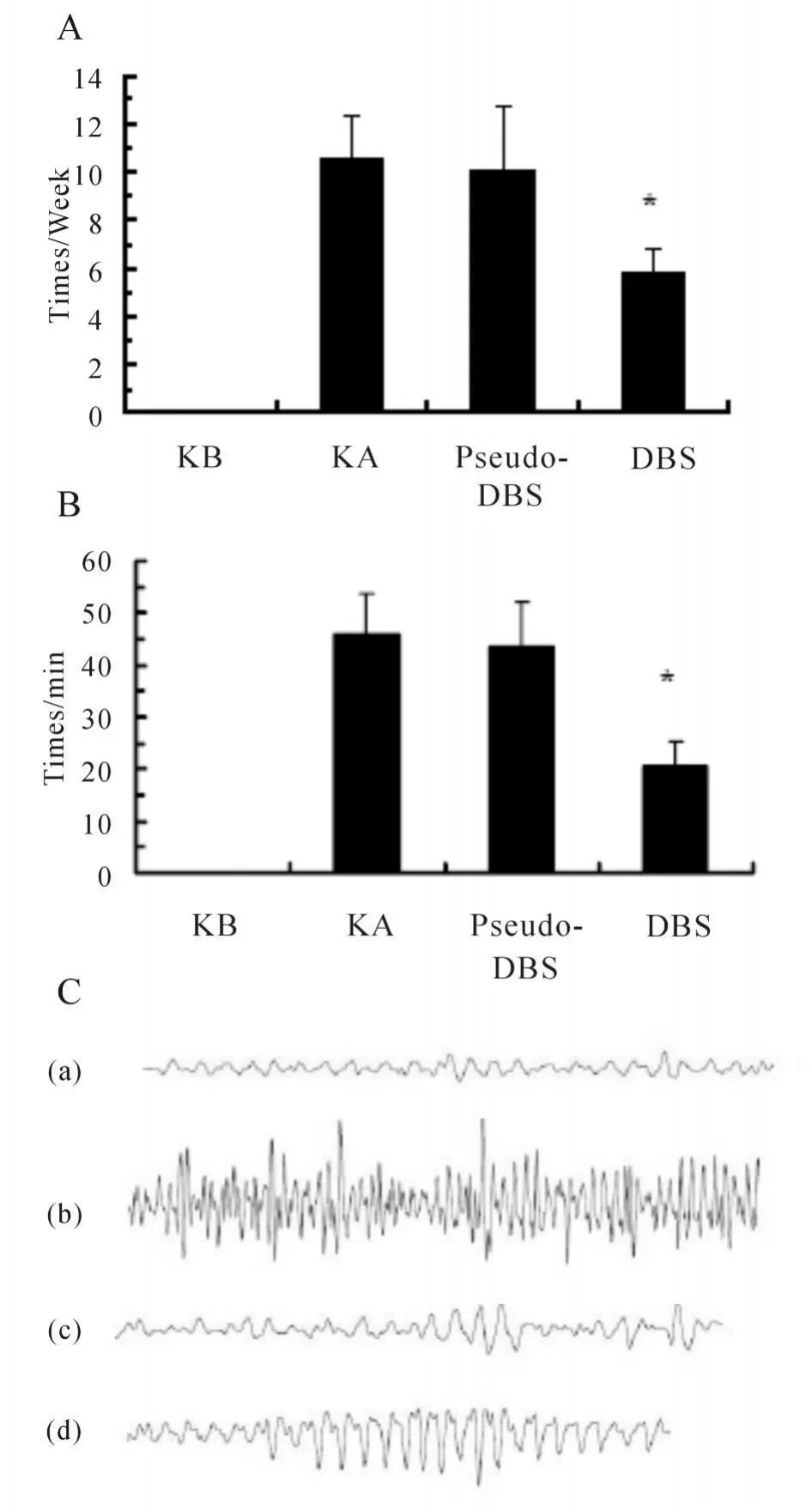
Fig.1 Change of EEG and Behaviour
2.3 不同时间大鼠海马细胞外GABA的浓度变化
如图3所示,注射海人酸前4组的基础值无明显差异,注射海人酸后与空白组比较海人酸组、假刺激组、电刺激组的GABA于第1天明显升高(200%左右,P<0.01),后逐渐下降于第4天保持120%水平;电刺激组与海人酸组、假刺激组比较差别无统计学意义。
2.4 不同时间点海马细胞外Glu/GABA的比值变化
如图4所示,注射海人酸后比值升高,第4天最高,近2倍;电刺激组的比值较海人酸组和假刺激组有所下降(P<0.05),至第14天接近正常水平。

Fig.2 Content of EC glutamate(Glu)in the hippocampus of rats

Fig.3 Content of EC of GABA in the hippocampus of rats
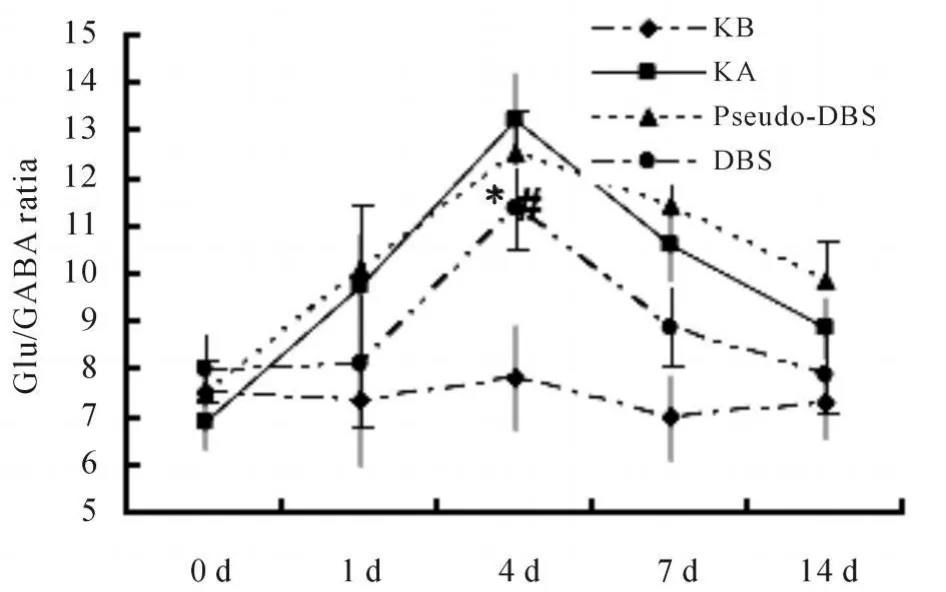
Fig.4 Change of Glu/GABA ratio
3 讨论
本研究在观察高频电刺激海马治疗海人酸致癫痫大鼠效果的同时动态监测海马细胞外神经递质的变化,以探讨高频电刺激治疗癫痫可能的机制。研究结果显示高频电刺激海马能明显减少海人酸致痫大鼠的自发性发作,同样能减少脑电图痫性放电,说明了电刺激海马癫痫灶,可能作为一个有效的控制癫痫发作的方法。
关于癫痫的发病机制目前尚不明确,其机制之一是兴奋性神经递质与抑制性神经递质的失衡。Glu是脑内主要的兴奋性神经递质,致痫后其水平常升高,参与了癫痫的发生发展。GABA是脑内主要的抑制性神经递质,致痫后其改变结果不一,但两者的失衡可能是癫痫发作的机制之一。本结果显示海人酸注射后海马细胞外Glu浓度明显升高,支持了Glu参与了癫痫的启动的论点[3],至慢性期有所下降仍保持较高的水平,这是癫痫活动的结果同时也是维持癫痫所必需的[3]。而海人酸致痫后海马细胞外GABA的浓度也有所升高,至慢性期保持高于正常水平,这和以往的实验似乎不同[5-6],可能是机体自我保护的结果。海马神经元几乎没有GABA囊泡,海人酸刺激后并没有立即引起GABA的大量释放,而是由于Glu大量增加后引起一系列细胞毒性的同时,胶质细胞立即通过转运体对Glu进行重摄取,其代谢产物也能合成GABA,然后转给中间神经元,起到对神经元的保护作用。还有,致痫后Glu/GABA的比值升高,至慢性期出现自发性发作时其比值仍高于空白组,这也说明了主要的兴奋性神经递质与抑制性神经递质的失衡是癫痫形成的机制之一。
本研究结果显示电刺激能降低海马细胞外Glu的水平,使Glu/GABA的比值下降,至第14天趋于正常,而Glu的降低并不伴随着GABA的变化,说明高频电刺激海马控制癫痫并不能简单解释为像电刺激STN产生类似毁损的效果。通常认为,丘脑是大脑皮质兴奋的起搏器,Papez环路(边缘系统)则将海马连接至丘脑、扣带回、内嗅区、海马回。高频电刺激使海马至丘脑的Glu能神经元输出减少,阻断了Papez环路及海马-皮质回路,抑制了海马的过度兴奋及海马向皮质传递异常放电。关于脑深部电刺激治疗癫痫可能作用机制,人们提出了四种假设[7]:(1)去极化阻滞;(2)突触抑制;(3)突触阻抑:高频刺激使得神经递质耗竭,阻碍突触信息传递从而影响了电极周围的神经信号的输出;(4)刺激改变了病理性神经网络功能。本研究结果显示一方面,高频电刺激海马能选择性地耗竭海马突触周围的Glu,使其与海人酸受体结合减少,引起细胞膜对钠、钙离子的通透性降低,减少了钠、钙离子进入神经元内,导致神经元去极化受阻滞,抑制了异常放电的传播;另一方面,电刺激时,电极植入复杂的容积导体中,其周围有神经元胞体、轴突、树突,电刺激可同时影响局部神经元、其传入、传出投射纤维以及与其周围相互连续的神经纤维[8],因此直接或间接地抑制了异常电活动的扩布;还有,海马区兴奋性氨基酸Glu量的减少抑制了病理性的长时程突触增强(LTP),同时高频电刺激(130Hz)能激活了有效的LTP,从而改变病理性神经网络功能[9].因此电刺激治疗癫痫并不能简单解释为神经元的抑制,是多方面同时作用的结果。
关于电刺激对海马细胞外GABA的影响,本研究结果发现电刺激没有改变海马细胞外GABA的浓度。这可能与海马神经元本身几乎没有GABA囊泡有关。但有研究表明海马CA1区GABA神经元与Glu存在着复杂的突触联系[10],本实验研究表明电刺激后Glu/GABA的比值下降,时间越长越趋于正常,说明了电刺激可能通过调节Glu/GABA的比值达到抗癫痫的效果。
总之,本研究结果表明高频电刺激海马能减少癫痫的自发性发作,选择性地耗竭海马细胞外Glu的水平,在高频电刺激海马控制癫痫中起到重要的作用。其机制不能简单解释为神经元的抑制,是多方面同时作用的结果。此外电刺激并不影响GABA的释放。
[1]Handforth A,DeSalles A A,Krahl S E.Deep brain stimulation of the subthalamic nucleus as adjunct treatment for refractory epilepsy[J].Epilepsia,2006,47(7):1239-1241.
[2]Wyckhuys T,Raedt R,Vonck K,et al.Comparison of hippocampal deep brain stimulation with high(130Hz)and low frequency(5 Hz)on afterdischarges in kindled rats[J].Epilepsy Res,2010,88(2-3):239-246.
[3]Szyndler J,Maciejak P,Turzynska D,et al.Changesin the concentration ofamino acids in the hippocampus of pentylenetetrazole-kindled rats[J].Neurosci Lett,2008,439(3):245-249.
[4]Racine R J.Modification of seizure activity by electrical stimulationⅡMotor seizure[J].Electroencephalogr Clin Neurophysiol,1972,32(3):281-294.
[5]Morales-Villagran A,Medina-Ceja L,Lopez-Perez S J.Simultaneous glutamate and EEG activity measurements during seizures in rat hippocampal region with the use of an electrochemical biosensor[J].J Neurosci Methods,2008,168(1):48-53.
[6]Ferraz A C,Anselmo-Franci J A,Perosa S R,et al.Amino acid and monoamine alterations in the cerebral cortex and hippocampus of mice submitted to ricinine-induced seizures[J].Pharmacol Biochem Behav,2002,72(4):779-786.
[7]McIntyre C C,Savasta M,Walter B L,et al.How does deep brain stimulation work?Present understanding and future questions[J].J Clin Neurophysiol,2004,21(1):40-50.
[8]初君盛,张 斌,张建国,等.丘脑底核电刺激对大鼠黑质网状部及苍白球细胞外神经递质的影响[J].中华神经外科杂志,2009,25(8):742-745.
[9]Behrens C J,vanden Boom L P,de Hoz L,et al.Induction of sharpwave-ripple complexes in vitro and reorganization of hippocampal networks[J].Nat Neurosci,2005,8(11):1560-1567.
[10]Xu L,Anwyl R,Rowan M J.Spatial exploration induces a persistent reversal of long-term potentiation in rat hippocampus[J].Nature,1998,394(6696):891-894.

