蓝斑核、中缝大核和迷走神经背核在胃运动调节中的关系*
乔 卉,安书成,徐 畅
(陕西师范大学生命科学学院,西安 710062)
蓝斑(locus coeruleus,LC)和中缝大核(raphe magnus nucleus,NRM)均可参与对胃肠功能的调节,早期的研究表明,刺激LC、NRM均能影响胃活动。而迷走神经背核(dorsal motor nucleus of the vagus,DMV)通过胆碱能-胆碱能兴奋途径以及胆碱能-非胆碱能非肾上腺素能抑制途径调节胃运动[1,2],被认为是迷走神经调节胃运动的“最后公路”。
有研究表明,5-羟色胺(5-hydroxytryptamine,5-HT)可以兴奋DMV中的神经元,其作用由5-HT2A受体介导[3]。脑片全细胞记录发现,DMV中约50%的胃运动相关神经元对去甲肾上腺素(norepinephrine,NE)表现出兴奋性反应[4]。
既然5-HT和NE影响着DMV的胃运动相关神经元的活动,那么,作为脑内主要的5-HT能来源的中缝核团,以及作为脑内主要的NE能来源的蓝斑核是否通过一定的内在功能联系,与DMV共同调控着胃运动,形成了胃运动中枢调控的脑干基本环路呢?本研究通过核团定位刺激、损毁、以及微量注射等方法,探讨了脑干蓝斑核、中缝大核和迷走神经背核对胃运动的调节效应,以及三者在胃运动调节中的相互关系,进一步充实了胃活动的中枢调控机制。
1 材料与方法
1.1 实验动物及药品
本实验选用体质量250~320g SD大鼠,雌雄不拘,由陕西中医药研究院实验动物中心提供。实验前禁食12~18 h,自由饮水。
利醅酮(Ritanserin)为 Sigma公司产品,4μg/μl溶于二甲基亚砜(DMSO);甲磺酸酚妥拉明(Phentoramin)为上海旭东海普药业有限公司生产,4μg/μl溶于生理盐水。
1.2 实验分组
实验进行以下分组:(1)LC对胃运动的调控研究(n=10):①刺激LC;②损毁DMV+刺激LC;③DMV注射NS;④DMV注射酚妥拉明;⑤DMV注射酚妥拉明+刺激LC。(2)NRM对胃运动的调控研究(n=10):①刺激NRM;②损毁DMV+刺激NRM;③DMV注射DMSO;④DMV注射利醅酮⑤DMV注射利醅酮+刺激NRM。(3)NRM与LC之间的相互作用关系研究(n=10):①刺激NRM;②损毁LC+刺激NRM;③LC注射DMSO;④LC注射利醅酮;⑤LC注射利醅酮+刺激NRM。
1.3 胃内压的测定
20%氨基甲酸乙酯(0.6 ml/100g)腹腔注射麻醉动物后做气管插管。打开腹腔,参照 Raybould(1987)的胃内压记录方法,将距胃窦幽门括约肌0.7 cm处的十二指肠结扎并剪口,轻轻冲洗胃内容物。向胃窦插入聚乙烯软管约1 cm,并注入温热生理盐水1.5 ml。软管从腹腔引出,与压力换能器联接,信号经PowerLab/8sp生理信号采集及分析系统进行采集,记录胃内压,经chart软件分析,反映胃收缩幅度的变化。采集参数设置为:采样率20/s,高通滤波DC,低通滤波1 Hz。
刺激或给药前记录胃内压10min,刺激或给药后持续记录40min,每10min为一个计量单位,应用记录胃内压的软件Chart 5计算胃收缩波振幅的平均值。药物及刺激、损毁的处理效应用处理前后胃收缩幅度变化百分比 [(效应值-正常值)/正常值×100%]进行统计。
1.4 核团定位及刺激、微量注射
腹腔手术完成后,大鼠俯卧位,在脑立体定位仪上参照George Paxinos和Charles Watson的大鼠脑立体定位图谱,按照分组需要对蓝斑核(AP=9.8,L=1.35,H=0.85),中缝大核(AP=10.3,L=0,H=9.7)和迷走神经背核(AP=13.6,L=0.7,H=0.75)进行定位。术后先做正常记录,待胃运动波形稳定后,再给予刺激或注射药物。
刺激电极外径0.5 mm,刺激参数为10Hz、100μA、波宽 1 ms、持续时间 45 s;损毁参数为 10Hz、1 mA、波宽1 ms、持续时间2 min。给药时使用1μl微量进样器匀速推注,总剂量为1μl,在1 min内以匀速注射完毕,推注完成后留针2 min。
1.5 统计学处理
2 结果
2.1 LC对胃活动的调节作用
刺激LC后记录胃运动40min,结果显示胃收缩幅度分别下降了22.40%±11.47%(P<0.05,图1A)和34.69%±13.65%、31.78%±5.09%、42.72%±11.01%(n=10,P<0.01,图1A)。损毁DMV后刺激LC,胃收缩幅度与刺激前比较分别下降了15.93%±3.67%、18.19%±4.43%、23.28%±8.22%和21.87%±8.98%,呈显著性差异(n=10,P<0.05,图1A),而与单纯刺激LC组比较,胃收缩幅度在20min内和40min内显著升高(n=10,P<0.05,图 1A)。
DMV注射肾上腺素能α受体阻断剂酚妥拉明,胃收缩幅度分别升高了27.01%±9.17%、19.78%±8.40%(P<0.05)和 41.13%±11.90%、59.13%±11.35%(n=10,P<0.01,图1B),与注射生理盐水组比较也有差异。DMV注射酚妥拉明后再刺激LC,胃收缩幅度也极显著升高了38.59%±9.77%、66.41%±12.40%、76.06%±12.60%和114.03%±29.87%(P<0.01,图1B),与单纯刺激LC组比较有极显著差异(n=10,P<0.01,图1B),而与单纯注射酚妥拉明组比较在后30min也显著升高(n=10,P<0.05)。
2.2 NRM对胃活动的调节作用
刺激NRM后记录胃运动40min,结果显示:胃收缩幅度在刺激后10min降低了23.02%±13.81%,与刺激前比较差异显著(P<0.05,图2A),在刺激后20、30、40min内分别下降了 49.26%±17.32%、58.22%±12.43%和62.06%±17.22%,与刺激前比较差异极显著(n=10,P<0.01,图2A,图3)。损毁DMV后刺激NRM,胃收缩幅度在10、20、30min内与损毁DMV和刺激NRM前比较分别上升了7.98%±3.26%、11.60%±4.75%、1.75%±3.78%,40min内下降了13.80%±6.24%,无显著性差异,而与单纯刺激NRM组比较,胃收缩幅度极显著升高(n=10,P<0.01,图2A)。

Fig.1 Regulation of LC andαreceptor in DMV on gastric motility
DMV注射5-HT2A受体阻断剂利醅酮可以使胃收缩幅度比其自身基础值显著降低42.45%±10.00%、70.50% ±19.28%、72.50% ±22.32%、72.90% ±17.55%(n=10,P<0.01,图 2B),与 DMV内微量注射二甲基亚砜的对照组比较,也有极显著差异。而DMV注射利醅酮后再刺激NRM,胃收缩幅度比其自身基础值显著下降了49.45%±12.03%、57.47% ±15.30%、64.84% ±15.33%和71.30%±9.44%(n=10,P<0.01,图 2B),与单纯注射利醅酮组和单纯刺激NRM组比较均无显著性差异(n=10,P>0.05,图2B)。

Fig.2 Regulation of NRM and 2A receptor in DMV on gastric motility

Fig.3 Gastric motility wave recorded 10min before and 20min after NRM stimulation
这样的结果提示我们,NRM通过DMV发挥了抑胃作用,而DMV的5-HT2A受体却没有参与此效应。结合第一部分结果,我们又设计了以下实验。
2.3 LC在NRM调节胃运动中的作用
损毁LC后刺激NRM,胃收缩幅度在前10min降低了5.27%±6.50%,而在后30min分别升高了4.73%±1.90%、12.65%±4.78%和 18.90%±6.65%,与单纯刺激NRM组比较在前10min内有显著性差异(P<0.05,图4A),而在后30min有极显著差异(n=10,P<0.01,图4A)。
LC内微量注射5-HT2A受体阻断剂利醅酮,在前20min内使胃收缩幅度显著增强了22.37%±7.60%和 16.93% ±5.47%(P<0.05,图 4B);与注射溶剂的对照组比较在40min内幅度均极显著增强(n=10,P<0.01,图4B)。此时再刺激NRM,胃收缩幅度与单纯注射利醅酮组比较无显著性差异(34.41%±11.55%、32.96%±11.20%、26.84% ±9.80%和29.45%±10.06%,P>0.05)。
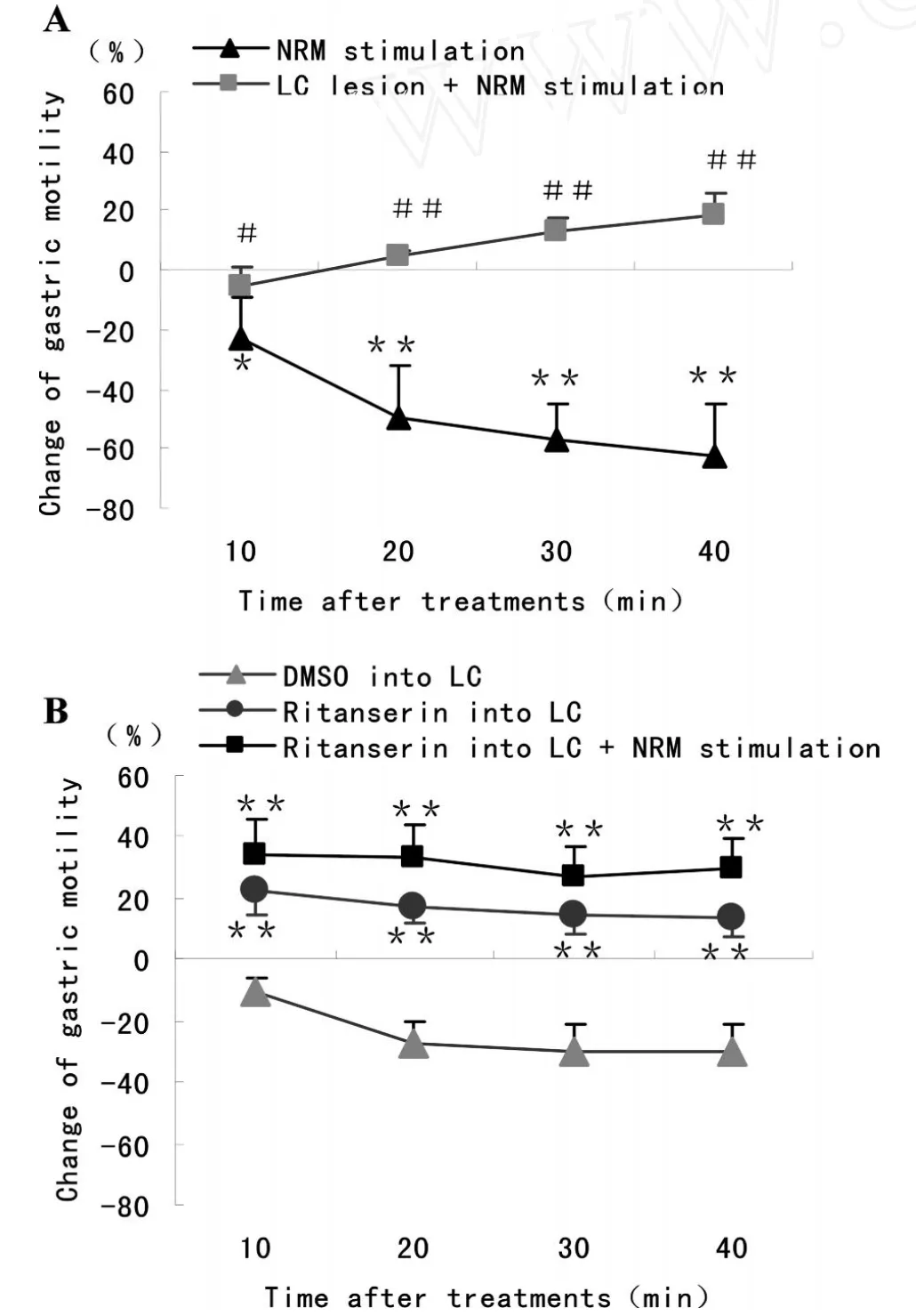
Fig.4 Regulation of NRMon gastric motilityvia5-HT2A receptor in LC
3 讨论
已有研究表明,束缚浸水应激引起的胃运动和分泌功能紊乱与DMV密切相关[5]。而消化道肌间神经丛的神经节内几乎所有的神经元都接受DMV的投射,该迷走末梢多与肌间神经丛内的中型和伸长型神经元联系[6]。DMV微量注射 G lu,可通过胃内肌间神经丛胆碱能或NO/VIP神经元引起胃的收缩和舒张[7]。我们的研究进一步证实了在中枢对胃运动的调控中,DMV综合中枢信息、传出外周信息的重要地位。
胃扩张刺激可引起LC c-fos表达的增强[8],而外周注射Apetin-12对胃酸分泌的调节也有LC的参与[9]。我们的结果显示,刺激LC显著降低胃收缩幅度,而损毁DMV可以减弱此效应,说明LC对胃运动的调节部分通过了DMV(图1A)。阻断DMV的肾上腺素能α受体,发现可以反转刺激LC所引起的抑胃效应,且可以进一步增强胃运动(图1B)。由此可见,LC通过DMV的α受体发挥抑制胃运动的效应,该途径可能是LC-DMV调控胃运动的途径之一。LC对DMV中胃运动神经元具有双重调节作用,除α受体抑制途径外,还可能有兴奋性途径。该兴奋性途径可能是通过肾上腺素能其他受体亚型起作用,也可能是非肾上腺素能中间神经元介导的。因此,当阻断α受体抑制性途径后,刺激LC可以增强胃的运动。
结合第二部分实验得到的结果,阻断DMV上的5-HT2A受体,胃收缩幅度大幅度减弱(图2B),说明DMV中的5-HT2A受体对胃运动的调节尤其在生理条件下正常胃的运动起重要作用。已有的研究显示,LC内有5-HT能神经元存在,因此,源自此处的5-HT能神经元与DMV上的5-HT2A受体系统可能是LC对DMV胃运动神经元的兴奋性途径之一(图5)。
有研究表明,NRM注射5-HT可通过缝脊下行途径抑制胃运动和胃电[10]。我们的研究结果也显示,刺激NRM对胃收缩幅度有显著的减弱效应,但在损毁了DMV后此效应被消除,由此说明NRM对胃运动的减弱效应通过DMV实现(图2A)。但是阻断DMV上5-HT2A受体后再刺激NRM,发现其效应与单纯刺激NRM无显著性差异(图2B),由此可见,NRM并不是通过5-HT能纤维直接投射到DMV,作用于5-HT2A受体来抑制胃运动的。
那么,NRM是如何间接的通过DMV发挥其抑胃效应的?进一步的研究发现,损毁LC后刺激NRM,消除了NRM的抑胃效应(图4A),在LC注射5-HT2A受体阻断剂也可以消除该效应(图4B),推测NRM对胃运动的抑制效应是通过LC上的5-HT2A受体起作用的。而NRM通过LC和DMV抑制胃运动的关键也是依赖于LC上的5-HT2A受体。
综上所述,刺激LC,一方面增加NE在DMV的释放,NE作用于DMV上的肾上腺素能α受体抑制胃活动;另一方面,也可能激活LC的5-HT能神经元释放5-HT,通过5-HT2A受体加强胃活动。在正常生理条件下,两个系统互相牵制、共同协作,在DMV水平调节着胃收缩幅度和平均胃内压,维持着胃的机能状态(图5)。NRM中5-HT能神经元末梢抵达LC,经5-HT2A受体激活LC神经元,LC中NE能神经元释放的NE递质与DMV上的肾上腺素能α受体结合,抑制DMV中的胃运动神经元,从而对胃运动产生抑制作用(图5)。
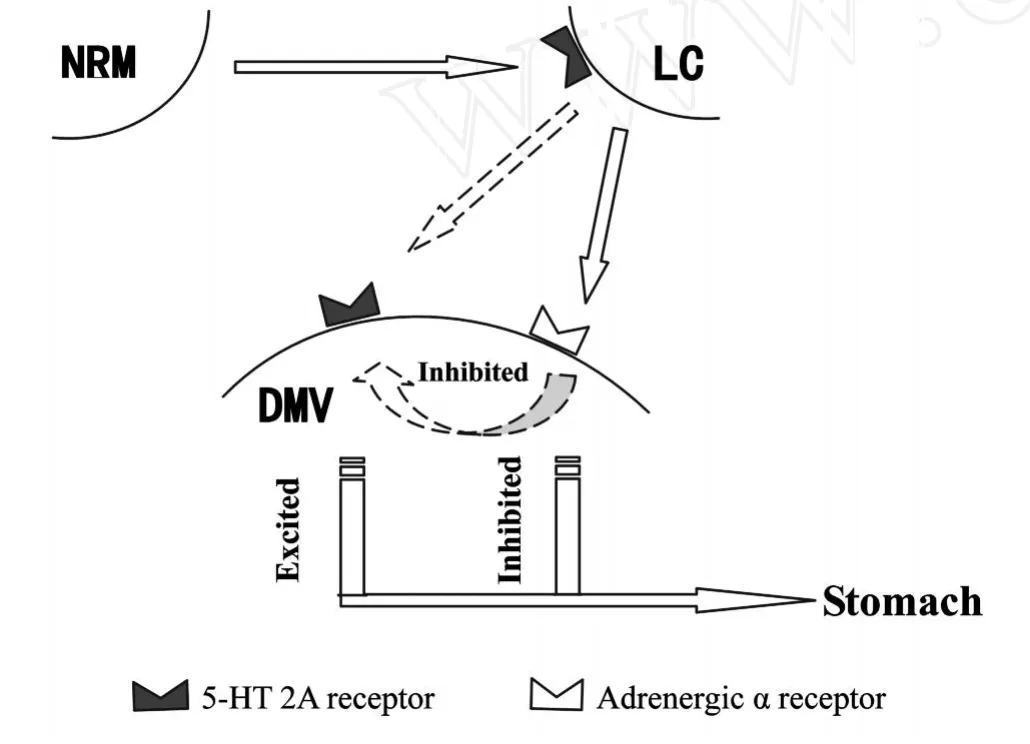
Fig.5 Relationship among LC,NRM and DMV in the regulation on gastric motility
[1]Travagli R A,Hermann G E,Browning KN,et al.Brainstem circuits regulating gastric function[J].Annu Rev Physiol,2006,68:279-305.
[2]Cruz M T,Murphy E C,Sahibzada N,et al.A reevaluation of the effects of stimulation of the dorsal motor nucleus of the vaguson gastric motility in the rat[J].Am J Physiol Regul Integr Comp Physiol,2007,292(1):R291-307.
[3]Browning KN,Travagli R A.Characterization of thein vitro effects of 5-hydroxytryptamine(5-HT)on identified neurones of the rat dorsal motor nucleusof the vagus(DMV)[J].Br J Pharmacol,1999,128(6):1307-1315.
[4]Martinez-Penay V I,Rogers R C,Hermann G E,et al.Norepinephrine effects on identified neurons of the rat dorsal motor nucleus of the vagus[J].Am J Physiol Gastrointest Liver Physiol,2004,286(2):G333-339.
[5]Zhang Y Y,Cao G H,Zhu W X,et al.Comparative study of c-Fos expression in rat dorsal vagal complex and nucleus ambiguus induced by different durations of restraint water-immersion stress[J].Chin J Physiol,2009,52(3):143-150.
[6]Hayakawa T,Kuwahara S,Maeda S,et al.Direct synaptic contacts on the myenteric ganglia of the rat stomach from the dorsal motor nucleusof the vagus[J].J Comp Neurol,2006,498(3):352-362.
[7]Zhou S Y,Lu Y X,Yao H,et al.Spatial organization of neurons in the dorsal motor nucleus of the vagus synapsing with intragastric cholinergic and nitric oxide/VIP neurons in the rat[J].Am J Physiol Gastrointest Liver Physiol,2008,294(5):G1201-1209.
[8]Sabbatini M,Molinari C,Grossini E,et al.The pattern of c-Fos immunoreactivity in the hindbrain of the rat following stomach distension[J].Exp Brain Res,2004,157(3):315-323.
[9]Takayama K,Iwazaki H,Hirabayashi M,et al.Distribution of c-Fos immunoreactive neurons in the brain after intraperitoneal injection of apelin-12 in Wistar rats[J].Neurosci Lett,2008,431(3):247-250.
[10]陈香梅,柳 滨,刘志敏.中缝大核微量注射5-HT等药物对电针抑制胃运动、胃电的影响[J].针灸临床杂志,2004,20(4):47-49.

