阿莫西林口服制剂微生物限度检查方法学验证研究
王艳,李晓平,刘珠,支丽娟,王淑娟(.河北省药品检验所,石家庄市 0500;.河北省儿童医院,石家庄市 0500;.长春工业大学,长春市 00)
阿莫西林为广谱抗菌药物,是目前应用较为广泛的口服青霉素之一。其制剂有胶囊、片剂、颗粒剂、分散片等。对该品种进行微生物限度检查时需要消除样品的抑菌性,才能真实地反映其微生物污染情况。而普遍使用的平皿法不能消除阿莫西林的抑菌性;薄膜过滤法操作过程复杂,有人为污染的危险,同时无法确定每次试验冲洗效果是否完全消除其抑菌性。因此十分有必要探索操作简便、结果可信度高、可应用敏感菌同步验证的微生物限度检查方法。
1 材料
1.1 试药
阿莫西林分散片(张家口圣大药业有限公司,批号:081106、081105、081107,规格:每片0.25 g);阿莫西林颗粒(石药集团中诺药业有限公司,批号:080371,规格:每袋0.25 g;批号:081271,规格:每袋0.125 g;华北制药集团,批号:090303,规格:每袋0.125 g);阿莫西林胶囊(石家庄科迪药业有限公司,批号:071005、070701、070901,规格:每粒0.5 g)。
pH7.0无菌氯化钠-蛋白胨缓冲液、0.9%无菌氯化钠溶液、靛基质试液(河北省药品检验所制备);营养肉汤培养基(批号:0104002)、改良马丁液体培养基(批号:001229)、改良马丁琼脂培养基(批号:011025)、营养琼脂培养基(批号:100105)、玫瑰红钠培养基(批号:010608)、胆盐乳糖培养基(批号:010607)、4-甲基伞形酮葡萄糖苷酸(MUG,批号:010912)均由北京三药科技开发有限公司提供;青霉素酶(张家口市格瑞生物化学科技有限公司,批号:20100402,规格:2400000 u·mL-1)。
1.2 对照菌
枯草芽孢杆菌[CMCC(B)63501]、金黄色葡萄球菌[CMCC(B)26003]、大肠埃希菌[CMCC(B)44102]、白色念珠菌[CMCC(F)98001]、黑曲霉[CMCC(F)98003](中国医学细菌保藏中心)。
2 方法与结果
2.1 菌液的制备
接种细菌计数方法对照菌,取金黄色葡萄球菌、大肠埃希菌、枯草芽孢杆菌的新鲜培养物至5 mL营养肉汤培养基中35℃培养20 h;接种酵母菌计数方法验证用菌株,取白色念珠菌的新鲜培养物至5 mL改良马丁液体培养基中,25℃培养20 h;接种霉菌计数方法验证菌株,取黑曲霉的新鲜培养物至改良马丁琼脂培养基中,25℃培养7 d,加4 mL 0.9%无菌氯化钠溶液洗下霉菌孢子。取上述1 mL各菌培养物或孢子液加0.9%无菌氯化钠溶液9 mL,采用10倍递增稀释法,制备各菌液(菌落数在10~100 cfu·mL-1)。
2.2 试验方法
试验组:取供试液1 mL,注入平皿中,加入“2.1”项下菌液1 mL,每株试验菌平行制备2个平皿;菌液组:取5株试验菌液各1 mL,分别注入平皿中,每株试验菌平行制备2个平皿;供试品对照组:取供试液1 mL,分别注入平皿中,每种供试液平行制备2个平皿;稀释剂对照组:取稀释液1 mL,分别加入各菌悬液1 mL。上述各组,细菌计数检查项注入营养琼脂培养基,霉菌及酵母菌计数检查项注入玫瑰红钠培养基。按规定条件培养后,计算各试验菌的回收率:试验组的菌回收率=(试验组的平均菌落数-供试品对照组的平均菌落数)/菌液组的平均菌落数×100%;稀释剂对照组的菌回收率=稀释剂对照组的平均菌落数/菌液组的平均菌落数×100%。
2.3 供试液的制备及试验结果
2.3.1 未加酶供试液。分别称取9批供试品各10 g,加pH7.0无菌氯化钠-蛋白胨缓冲液至100 mL,45℃保温振摇,使溶散;静置取上清液作为1∶10供试液A,进行平皿法验证试验,结果见表1。
由表1可见,该方法白色念珠菌和黑曲霉的回收率大于70%,因此采用该法可以进行样品的霉菌及酵母菌计数检查;但金黄色葡萄球菌、大肠埃希菌和枯草芽孢杆菌的回收率均为0%,因此需要探索细菌计数方法并验证。
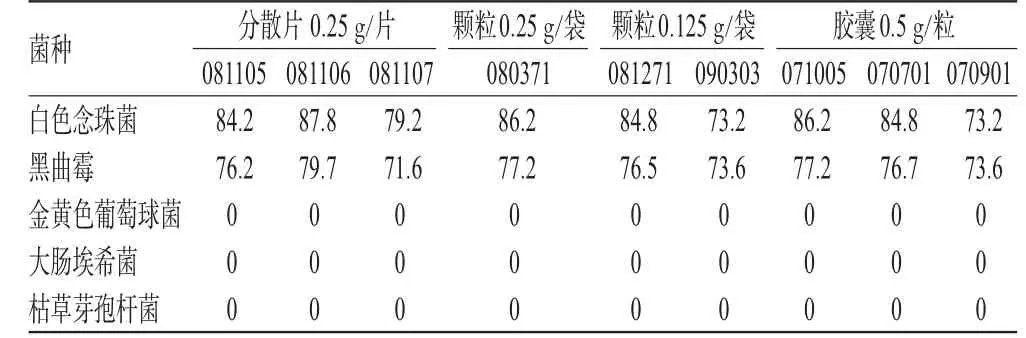
表1 供试液A验证试验结果(回收率,%)Tab 1 Result of validation test of test sample A(recovery rate,%)
2.3.2 加酶供试液。分别称取9批供试品各10 g,加pH7.0无菌氯化钠-蛋白胨缓冲液至98 mL,45℃保温振摇,使溶散后至离心管中,500 r·min-1离心沉淀3 min;取上清液49 mL加青霉素酶1 mL摇匀,静置30 min,作为1∶10供试液B,进行平皿法验证试验,结果见表2。

表2 供试液B验证试验结果(回收率,%)Tab 2 Result of validation test of test sample B(recovery rate,%)
表2结果表明,阿莫西林颗粒和胶囊在该条件下,5株试验菌的回收率均达到70%以上,该方法已经消除了样品的抑菌性,可以进行样品的细菌检查。分散片遇水能迅速崩解形成均匀的黏性混悬液,低速离心不能使不溶性阿莫西林沉降,故其上清液中阿莫西林量较其他2种剂型中的量增加。该试验条件不能使分散片中阿莫西林充分灭活,因此需要进一步加大青霉素酶的用量,重新验证大肠埃希菌的回收率。
2.3.3 加大酶量供试液。取3批分散片供试品各10 g,加pH7.0无菌氯化钠-蛋白胨缓冲液至96 mL,45℃保温振摇,使溶散后至离心管中,500 r·min-1离心沉淀3 min,取上清液48 mL加青霉素酶2 mL摇匀,静置30 min,作为1∶10供试液C,进行验证试验,结果3批样品(081105、081106、081107)大肠埃希菌回收率分别为91.7%、89.6%、96.5%。
阿莫西林分散片的供试液B对金黄色葡萄球菌和枯草芽孢杆菌没有抑菌性,而对大肠埃希菌有抑菌性;加大青霉素酶量酶后制备的供试液C,阿莫西林灭活完全,消除了对大肠埃希菌的抑菌性。该结果表明阿莫西林微量存在时,大肠埃希菌较为敏感,因此,大肠埃希菌可以作为该药品的敏感菌。
2.3.4 稀释剂。取1 mL青霉素酶加49 mL pH7.0无菌氯化钠-蛋白胨缓冲液混匀,作为青霉素酶法的稀释剂对照组D,进行稀释剂验证试验,结果见表3。
由表3可见,该稀释剂各试验菌回收率均大于70%,说明稀释剂对试验结果没有影响。
2.3.5 控制菌大肠埃希菌检查方法验证。取100 mL胆盐乳糖培养基4份,第1份加入10 mL供试液B,第2份加入10 mL供试液B和大肠埃希菌的菌悬液1 mL,第3份加入大肠埃希菌的菌液1 mL、第4份加稀释剂10 mL。35℃培养18~24 h后,各取0.2 mL,分别加至5 mL MUG中,35℃培养5、24 h,将各管置于365 nm紫外灯下观察有无蓝白色荧光,然后加靛基质试液4~5滴于上述MUG管内,观察液面颜色。有荧光(MUG)及呈玫瑰红色(indole)说明检出大肠埃希菌,记为“+”;无荧光及无色说明未检出大肠埃希菌,记为“-”,结果见表4。

表3 稀释剂D验证试验结果(回收率,%)Tab 3 Result of validation test of thinners D(recovery rate,%)

表4 大肠埃希菌检查方法验证结果Tab 4 Validation result of the method of Escherichia coli
由表4可见,供试液B第2份试验组结果表明检出大肠埃希菌,说明该方法可以作为控制菌大肠埃希菌的检查方法。
2.3.6 样品检查。取9批供试品,霉菌及酵母菌计数采用平皿法检查。其细菌计数检查分为2种:胶囊和颗粒按供试液B制备方法采用平皿法检查,分散片按供试液C制备方法采用平皿法检查,结果见表5。
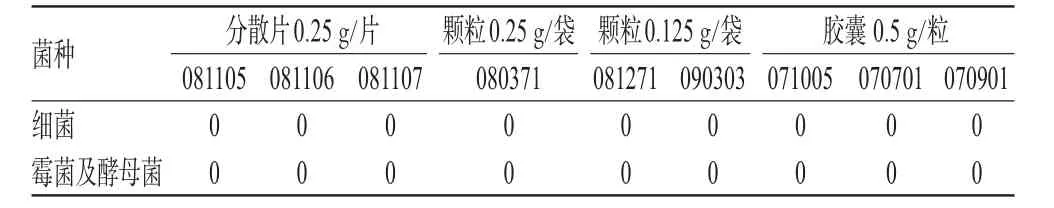
表5 样品检查结果(菌落计数,cfu·g-1)Tab 5 Results of sample test(counts,cfu·g-1)
3 讨论
依据阿莫西林在水中微溶[1]的特性,取10 g供试品加入pH7.0无菌氯化钠-蛋白胨缓冲液至100 mL,溶散后低速离心制备的上清液,大部分主药均在沉淀物中。假设上清液中不含不溶性阿莫西林,理论上其中阿莫西林可能的最大含量为1 g·100 mL-1。因此,上清液中的阿莫西林含量几乎不受样品规格中主药含量的影响,而辅料则是影响上清液中阿莫西林含量的主要因素。
由于上清液中含阿莫西林可能的量为1 g·100 mL-1(1 mg阿莫西林相当于1400 u青霉素),即100 mL的上清液中含1400000 u的青霉素。理论上加2~4倍单位的青霉素酶可使青霉素灭活[2]。供试液C中,50 mL的上清液约含相当于700000 u的青霉素,因此,用2400000 u的青霉素酶1 mL可以使其灭活。
供试液加入青霉素酶后,应使二者充分混匀,并静置约30 min使β-内酰胺完全灭活,观察现象可见溶液由浑浊变为澄清。
阿莫西林分散片在生产过程中,将原料药进行微粉化处理,选用了良好的崩解剂,在水中形成均一的混悬液,因此供试液离心沉淀后上清液中阿莫西林量增加,故青霉素酶的用量需要加倍,才可消除对试验菌的抑菌性。依据该试验结果,应考虑辅料对不同剂型供试品的上清液中阿莫西林含量的影响,对青霉素酶用量进行验证。
阿莫西林口服制剂有胶囊、片剂、颗粒剂、分散片。分散片是在片剂的基础上,添加了以增强其黏性为目的的工序。而片剂供试液的黏性低于分散片,上清液中阿莫西林量不高于分散片。因此本试验中分散片的研究结果可代替普通片剂,故不再选取普通片剂进行试验。本研究结果对阿莫西林口服制剂的微生物限度检查有普遍意义。
对完全灭活的供试液采用平皿法进行细菌计数检查,即可有效检出供试品中污染的微生物。该方法较薄膜过滤法简便易行,操作环节少,并可减少操作过程中的污染机会。
大肠埃希菌为该样品的敏感菌,每批样品检查时应进行大肠埃希菌的回收率试验。回收率大于70%,证明细菌检查结果无误,检验结果准确;如果回收率小于70%,表明没有完全消除供试品的抑菌性,需重新检查。该方法可保证每批次供试品的试验结果可信。
阿莫西林对白色念珠菌和黑曲霉无抑菌作用,因此对于霉菌及酵母菌检查可以采用平皿法检查。
[1]国家药典委员会编.中华人民共和国药典(二部)[S].2010年版.北京:中国医药科技出版社,2010:401.
[2]苏德模,马绪荣.药品微生物学检查技术[M].北京:华龄出版社,2007:265.

