纤维连接蛋白肾小球病 ——临床及病理分析
陈惠萍 曾彩虹 朱小东 朱茂艳 张明超 梁少珊 黄 倩 徐 峰 郑春霞 刘志红
1987年,Tnttle等[1]首先描述一种分叶性肾小球肾炎,蛋白尿、镜下血尿和高血压为其主要临床表现;1995年,Strøm 等[2]证实此种类型的肾小球疾病与纤维连接蛋白(FN)密切相关,并命名为“纤维连接蛋白肾小球病(fibronectinglomerulopathy,GFND)”。此后,国内外均有零星报道,一些作者提出该病与遗传相关,但至今尚不明了其确切的病因[2-4]。我们近年来经肾活检明确诊断 GFND 10例,现将患者的常见临床表现和病理特点作一小结,以飨读者。
对象和方法
病例选择 选自南京军区南京总医院全军肾脏病研究所经肾活检明确诊断的10例GFND患者,其中男性6例,女性4例;年龄16~46岁,平均(28.8±5.8)岁。全部患者均行肾活检术,排除狼疮性肾炎、其他免疫相关的疾病(如冷球蛋白肾损害及心磷脂抗体综合征等)及肝炎相关肾损害等全身疾病引起的肾脏病变。
观察指标
临床资料 收集患者年龄、性别、肾脏病病程、血压、肾脏病的首发临床表现及常见临床体征,询问并收集家族史。
实验室检查
尿液检查 24h尿蛋白定量、尿沉渣红细胞计数、尿 C3、α2巨球蛋白(α2-MG)、视黄醇结合蛋白(RBP)、尿 N-乙酰-β-D-葡萄糖苷酶(NAG)、溶菌酶及禁水13h尿渗透压测定。
血生化及免疫学检查 肝肾功能[部分患者查血胱抑素C(CysC)]、电解质及血脂分析;全部患者均行自身抗体、冷球蛋白及心磷脂抗体等检查。
肾脏B超检查 测量两侧肾脏长径、宽度和厚度。
肾脏病理 全部患者均在B超引导下行经皮肾穿刺活检术。肾穿刺取得的组织分为三部分,按常规方法分别进行光镜、电镜及免疫荧光检查。
光镜 标本以甲醛或酒精-苦味酸-甲醛固定,石蜡包埋后连续切片,组织切片厚1.5~2 μm,分别行 HE、PAS、PASM-Masson,Masson 三色染色。
免疫荧光 采用冰冻切片,切片厚3 μm,以异硫氰酸荧光标记的羊抗人荧光抗体行直接法染色,检测肾组织中免疫球蛋白IgG、IgA、IgM和补体C3、C4、C1q沉积的部位、强度和分布特点。
FN染色:石蜡切片脱蜡至水,0.1%胰酶消化5 min,加一抗 fibronectin(兔多克隆抗体 .DAKO),1∶400室温过夜;PBS冲洗,加FITC二抗(猪抗兔 .DAKO),室温孵育40 min,清水冲洗,吹干,甘油封片置荧光显微镜下观察。
电镜 肾组织以3.75%的冷戊二醛固定,1%四氧化锇后固定,超薄切片厚50 nm,醋酸铀、柠檬酸铅双染色。置日立Hitach 7500透射电子显微镜下观察。
免疫电镜:采取Tokuyasu免疫电镜技术,标本制备后置日立Hitach 7500透射电镜观察。
相关指标定义 高血压定义收缩压≥130 mmHg和(或)舒张压≥90 mmHg;肾功能不全定义血清肌酐(SCr)>109.62 μmol/L;肾病综合症定义尿蛋白定量≥3.5 g/d、血浆白蛋白<30 g/L。
统计学分析 计量资料以均数±标准差表示,计数资料以百分率表示。
结 果
一般资料 10例患者的年龄、性别、病程、首发临床症状及家族史见表1。
实验室检查 肾脏病变的实验室检查结果见表2。10例患者均未见肉眼血尿,仅2例尿沉渣红细胞计数>50万/ml,且为多形型血尿,2例尿沉渣红细胞计数波动在5~20万/ml间。8例患者呈现肾病范围的蛋白尿,同时伴低蛋白血症(表3),全部患者尿中均存在大分子量的蛋白质。
尿NAG酶升高者10例(100%),RBP异常者5例(50%)(1例患者未查),6例(75%)禁水13h尿渗量降低。
由于大量蛋白尿、低白蛋白血症继之发生的高脂血症在GFND患者中也十分普遍。本组所有患者血清总胆固醇均异常,然而三酰甘油异常的发生率仅5例,且升高的幅度不大。本组患者发病时SCr异常者2例,3例SCr波动在临界状况(125.53~133.48 μmol/L),然而CysC异常者较SCr异常者多(表3)。全部患者自身抗体、心磷脂抗体及冷球蛋白等与自身免疫性疾病相关的实验室检查结果均阴性。全部患者空腹、餐后2h血糖及糖化血红蛋白也在正常范围内。
辅助检查 10例患者经B超测量双肾体积,结果发现1例肾脏体积明显增大(左肾135 mm×53 mm×74 mm,右肾128 mm×50 mm×62 mm)。另外8例患者双肾长径>100 mm,仅1例患者双肾体积尚在正常范围内。
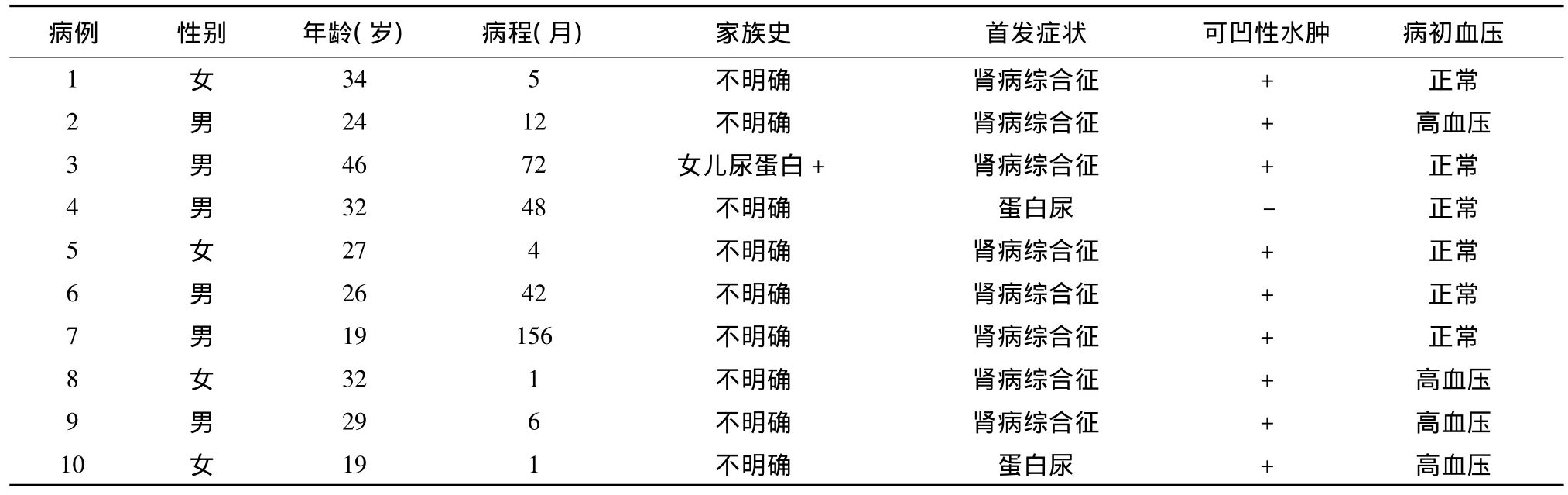
表1 纤维连接蛋白肾小球病患者的一般资料及首发症状
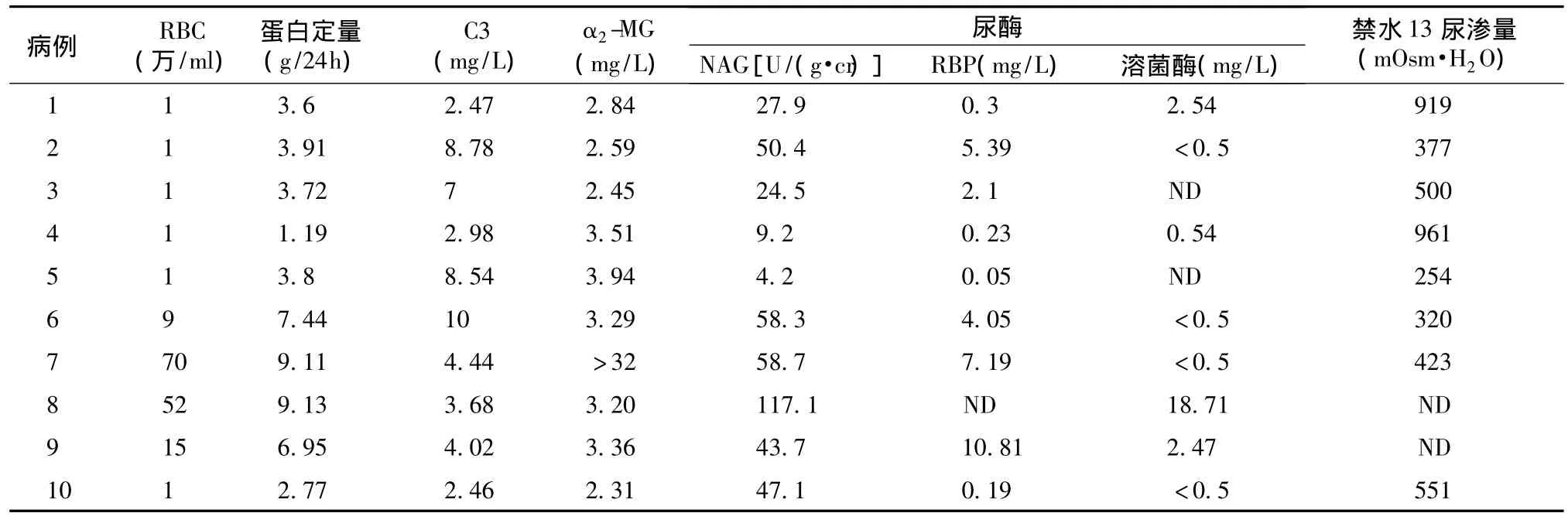
表2 纤维连接蛋白肾小球病患者的尿液检查结果
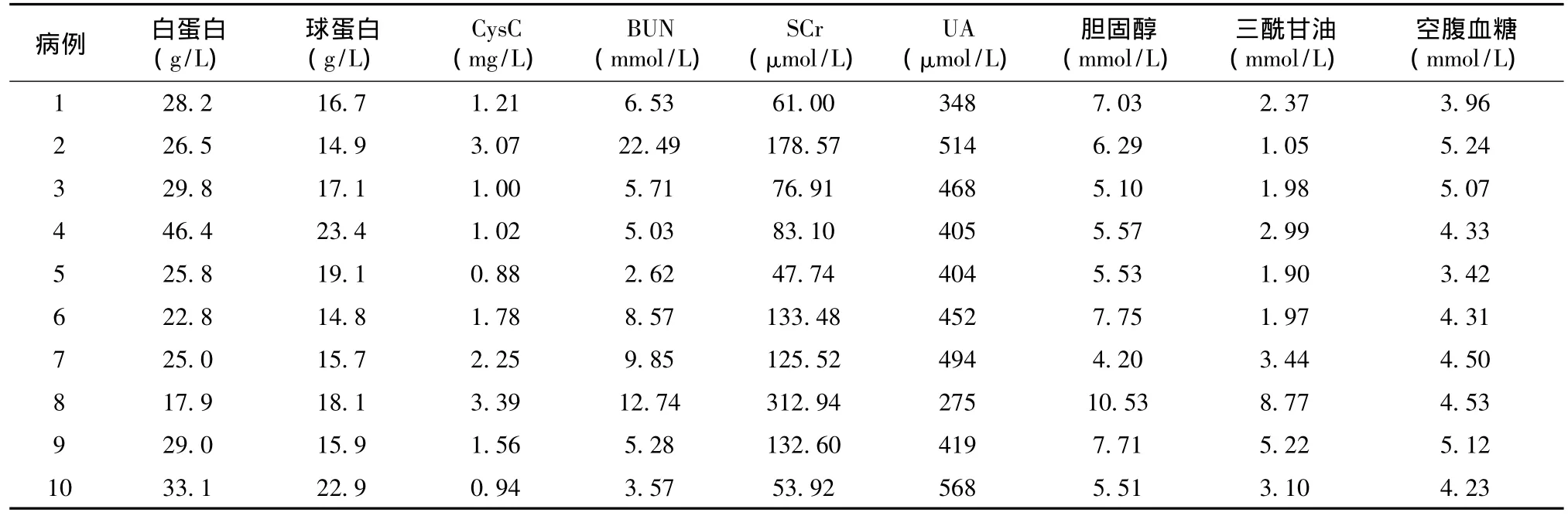
表3 纤维连接蛋白肾小球病患者血生化结果
肾活检病理特点 组织学观察证实全部患者的肾小球体积均增大[本单位形态计量学分析测定肾小球直径正常值为(177±8.4)μm],6例呈分叶状改变(图1);1例见肾小球新月体形成。肾小球系膜区增宽,细胞数增多(最多系膜细胞数达5~7个/系膜区),有的患者则仅见增宽的系膜区而无细胞数增多;肾小球内皮细胞病变较明显,常见内皮细胞成对,约1/3的患者见肾小球内皮细胞泡沫变性;系膜溶解常见,其中3例严重的系膜溶解致使整个肾小球仅见PASM-Masson染色阳性的外周袢(图2);9例患者PAS染色肾小球毛细血管外周袢内皮下嗜复红增加,类似“白金耳”(图3),Masson三色染色则见肾小球外周袢内皮下、节段系膜区大量嗜复红物沉积(图1)。全部患者PASM-Masson染色均见肾小球系膜区弥漫或节段不嗜银(表4)。
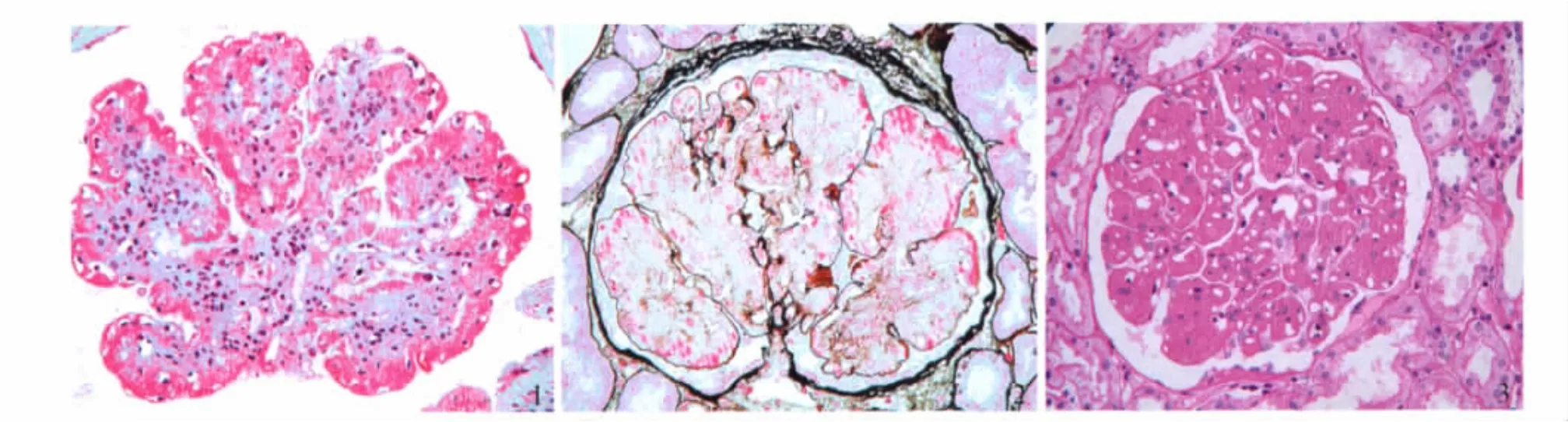
图1 肾小球体积增大,呈分叶状,内皮下及系膜区大量嗜复红物沉积(Masson三色,×400) 图2 肾小球严重系膜溶解,仅见PASM阳性的外周袢(PASM-Masson,×400) 图3 肾小球毛细血管袢内皮下嗜复红增加,呈“白金耳”样改变(PAS,×400)
与肾小球病变相比,肾小管间质病变无特征、非特异,肾小管灶性萎缩,有的患者肾小管腔内见蛋白管型;肾间质见散在分布和(或)灶性聚集的浸润细胞。
10 例患者肾组织免疫荧光染色特点见表4。观察发现尽管免疫球蛋白和补体多沿肾小球外周袢和系膜区分布,但强度不均一,有的似“非特异性”滞留(图4,5),6例Fibrin阳性。10例患者免疫荧光FN染色均呈强阳性沿肾小球毛细血管袢和(或)系膜区分布(图6)。
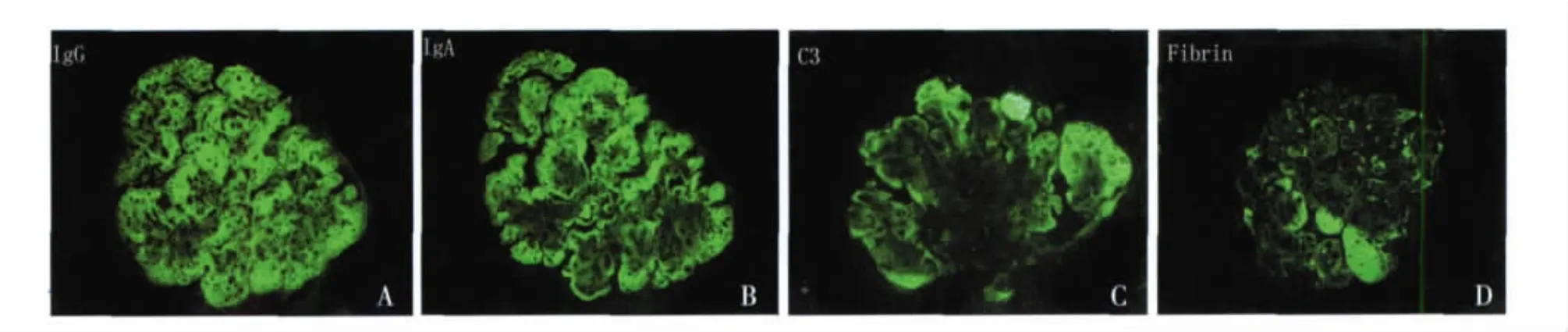
图4 IgG(A)、IgA(B)、C3(C)和Fibrin(D)沿肾小球外周袢和系膜区分布,强度不均一(IF,×400)
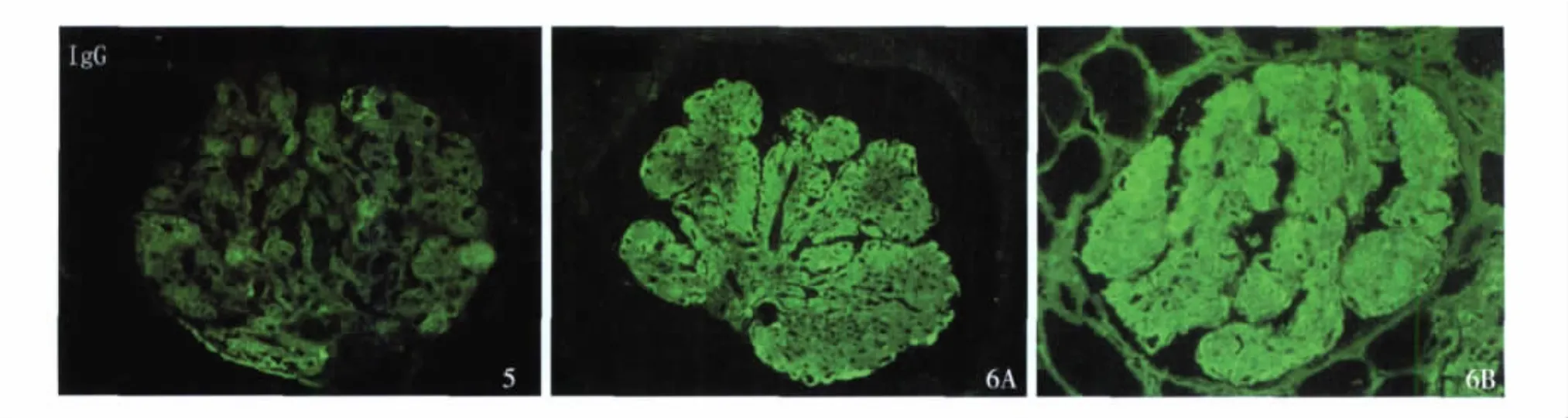
图5 肾小球系膜区及外周袢IgG呈非特异性沉积(IF,×400) 图6 纤维连接蛋白染色沿肾小球外周袢及系膜区弥漫分布(IF,×400)
透射电镜观察证实,10例患者均可见肾小球毛细血管袢内皮下及系膜区大量中等密度、不均匀或含脂质成分的电子致密物(图7),4例患者电子致密物中见管状结构(直径12~16 nm),全部患者基膜膜上未见电子致密物沉积。肾小球毛细血管外周袢系膜基质插入在本病中不典型(2例),亦未见广泛新形成的基膜。
免疫电镜观察证实,肾小球毛细血管袢内皮下及系膜区中等电子密度的致密物中聚集FN标记的直径10 nm胶体金颗粒(图8)。
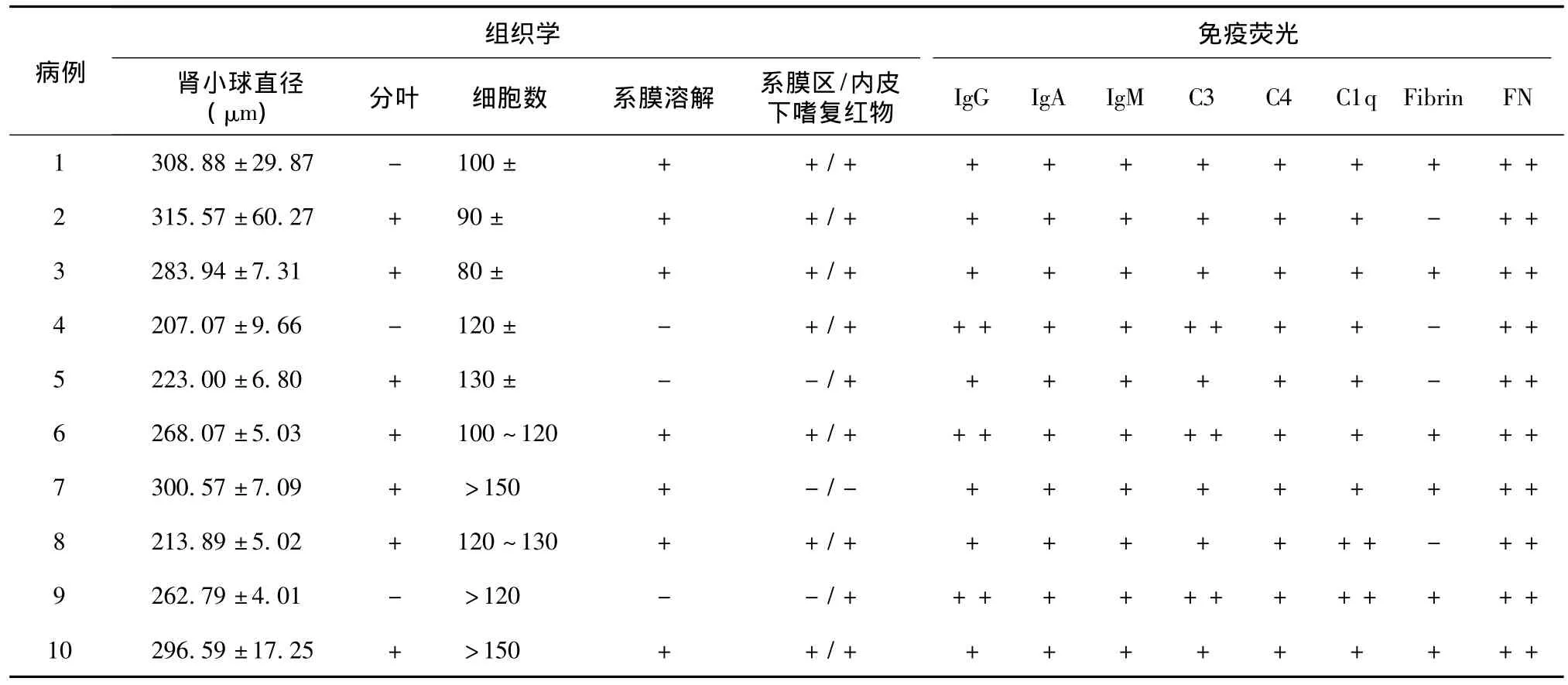
表4 纤维连接蛋白肾小球病患者肾小球组织学及免疫荧光检查
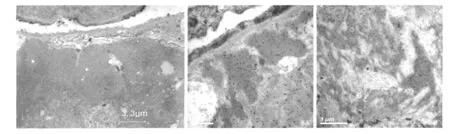
图7 肾小球血细血管袢内皮下块状中-高密度、含少量脂质的电子致密物(EM) 图8 肾小球毛细血管袢内皮下及系膜区中等电子密度的致密物中聚集纤维连接蛋白标记的直径10nm胶体金颗粒(IEM)
讨 论
GFND是1995年命名的一种不常见的肾小球病,其确切的发病机制不详,一些作者认为与常染色体显性遗传相关,患者存在肾脏疾病的家族史,但也有提出可能有其他遗传方式[2-4]。
尽管GFND相对少见,但了解其临床病理特点不失为避免遗漏、延误诊断的基础。
GFND临床表现及实验室检查特点 文献报告GFND患者男性居多,发病年龄无特征,可见于任何年龄,但30岁以下者居多(约>50%);部分患者有肾脏病家族史[5-8]。本组男性患者6例(60%),<30岁者6例(60%),年龄19~46岁,仅1例追溯到明确肾脏病家族史。
GFND患者蛋白尿最常见,尤其是肾病范围的蛋白尿;多数患者存在镜下血尿而无肉眼血尿发作;一般起病时肾功能状态良好,较长时间内(15~20年)进展到终末期肾病。高血压多,且与年龄无明显关联[5-8]。
本组患者80%存在肾病范围的蛋白尿,病初仅4例(40%)存在高血压。与文献报告不同的是,本组患者镜下血尿者占40%(仅2例尿沉渣红细胞计数>50万/ml)。病初SCr升高者2例,临界状态3例,10例行CysC检查者证实6例异常。
CysC为理想的肾小球滤过率(GFR)内源性标记物,直接反映GFR,评价肾功能。且其不受年龄、性别、身高和身体状况的影响。成人用CysC评价GFR效果优于SCr。本组患者CysC升高,可以作为GFR早期异常的标记物。
本组患者脂质代谢异常十分常见,10例患者血胆固醇均升高,三酰甘油异常者6例。肾脏B超检查证实9例患者肾脏体积增大。
总之,病初即存在高血压、肾病范围蛋白尿、脂代谢异常、B超检查肾脏体积增大为本组患者常见的临床表现及实验室检查特点。
肾活检病理特点 GFND患者的肾活检组织学、免疫荧光及超微结构改变并非具特征性,因此极易漏诊和误诊[5-11]。
GFND患者的光镜改变虽类似膜增生性肾炎Ⅰ型,但也不十分相似。患者虽然肾小球体积增大,呈分叶状,但肾小球增生性病变不突出,肾小球细胞总数多在正常范围,少有浸润细胞。肾小球系膜区虽增宽,但无系膜细胞增生;由于系膜区被大块状的嗜复红物占据,因此致使PASM-Masson染色时系膜区不嗜银;系膜溶解较常见,但系膜基质插入不明显,油镜观察外周袢“双轨”亦不明显。一些肾小球系膜区嗜复红物沉积不典型的患者,PASM-Masson染色仍见系膜区嗜银。我们认为,肾小球系膜区是否嗜银与FN沉积的量有一定关系。
肾小管-间质改变无特征性,与病程及肾小球病变程度轻重相关。
免疫荧光检查证实GFND患者存在强弱不一的免疫球蛋白和补体沉积(表4),但其最大特点是免疫球蛋白和补体阳性程度与光镜下肾小球系膜区和毛细血管袢内皮下嗜复红物沉积的多少不相符,此时应注意与一些免疫介导的肾小球疾病相鉴别。
电镜观察发现GFND患者肾小球毛细血管袢内皮下电子致密物疏松、大块状,致密物不均一,呈颗粒状,有时掺有脂质成分,高倍镜观察致密物中似有结构。文献报告,有的GFND患者肾小球电子致密物中见直径12~16 nm的中空管状改变,此时需与免疫管状肾小球病鉴别[12]。
诊断及鉴别诊断 只要充分认识GFND患者的临床表现、实验室检查特点和肾活检病理特征,认识此病,诊断及鉴别诊断不十分困难。
临床如遇高血压、大量蛋白尿、B超检查肾脏体积增大者必需行肾活检,因为GFND的确诊手段是肾活检病理。
尽管正常肾小球的细胞外基质中存在FN,一些肾小球疾病系膜区和(或)肾小球上皮细胞FN染色也可阳性,但其源于局部细胞产生过多;GFND患者肾小球内的沉积则因基因缺陷,肾小球处理FN能力障碍所致[9,13,14]。
有作者提出GFND必须与肾小球内伴丝状物沉积的疾病相鉴别[12],但我们则建议发现下述病理改变,则必须申请FN染色,以明确诊断:(1)光镜肾小球体积增大,轻分叶状,肾小球系膜区和(或)毛细血管袢内皮下大量嗜复红物沉积,致使系膜区非嗜银或“双轨征”不明显;(2)免疫荧光染色如存在免疫球蛋白阳性程度与组织学的嗜复红物沉积不相符;(3)电镜观察肾小球内电子致密物疏松、密度不一,沉积部位局限(肾小球毛细血管袢内皮下和系膜区)。
需鉴别的疾病包括膜增生性肾炎Ⅰ型(患者肾小球毛细血管袢内皮下的致密物量小,范围局限,多伴系膜基质插入及新形成的基膜)和狼疮性肾炎,因为GFND患者肾活检免疫荧光检查免疫球蛋白和补体均阳性,极易与狼疮性肾炎混淆;此外,还应与组织学观察可见肾小球存在大量嗜复红物沉积的疾病相鉴别。
除上述提及的临床表现和肾活检病理改变特征外,要重视临床资料(如是否存在系统损害的证实)、实验室检查指标(如自身抗体等),即使自身抗体阴性也应随访监测。我们有一例曾诊断狼疮性肾炎,并使用正规、足量免疫抑制剂治疗,但重复肾活检光镜观察仍见肾小球毛细血管袢内皮下较多嗜复红物沉积,重新审视临床及实验室资料,最终免疫荧光FN染色阳性,从而确诊GFND。
本病FN沉积是关键,因此,有作者提出FN基因缺陷与发病可能相关。Vollmer等[15]对一个家系确诊GFND的13例和55例无症状者行全基因组扫描连锁分析,发现GFND的基因座定位在人染色体1q32的—4.1cM的遗传距离,但还未确定候选基因[15-17]。近来,Castelletti等[18]报告的 GFND 患者,40%以 FN1为主的基因突变;但至今尚未明了GFND的致病基因。
总之,多数作者认为该病非免疫相关,激素和免疫抑制剂治疗无效,因此,正确诊断就更为重要。
1 Tuttle SE,Sharma HM,Bay W,et al.A unique familial lobular glomerulopathy.Arch Pathol Lab Med,1987,111(8):726 -731.
2 Strøm EH,Banfi G,Krapf R,et al.Glomerulopathy associated with predominant fibronectin deposits:anewly recognized hereditary disease.Kidney Int,1995,48(1):163 -170.
3 Gemperle O,Neuweiler J,Reutter FW,et al.Familial glomerulopathy with giant fibrillar(fibronectin-positive)deposits:15-year follow-up in a large kindred.Am J Kidney Dis,1996,28(5):668 -675.
4 Vollmer M,Krapf R,Hildebrandt F.Exclusion of the uteroglobin gene as a candidate for fibronectin glomerulopathy(GFND).Nephrol Dial Transplant,1998,13(9):2417 -2418.
5 Niimi K,Tsuru N,Uesugi N,et al.Fibronectin glomerulopathy with nephrotic syndrome in a 3-year-old male.Pediatr Nephrol,2002,17(5):363-366.
6 Assmann KJ,Koene RA,Wetzels JF.Familial glomerulonephritis characterized by massive deposits of fibronectin.Am J Kidney Dis,1995,25(5):781 -791.
7 Sato H,Matsubara M,Marumo R,etal.Familiallobular glomerulopathy:first case report in Asia.Am J Kidney Dis,1998,31(6):E3.
8 Uesugi N,Katafuchi R,Taguchi H,et al.Clinicopathological and morphometrical analysis of 5 cases from 4 families of fibronectin glomerulopathy.Nihon Jinzo Gakkai Shi,1999,41(2):49 -59.
9 van Vliet AI,van Alderwegen IE,Baelde HJ,et al.Fibronectin accumulation in glomerulosclerotic lesions:self-assembly sites and the heparin II binding domain.Kidney Int,2002,61(2):481 -489.
10 Yong JL,Killingsworth MC,Spicer ST,et al.Fibronectin non-amyloid glomerulopathy.Int J Clin Exp Pathol,2009,3(2):210 -216.
11 曾彩虹,刘志红,郑春霞,等.纤维连接蛋白肾小球病.肾脏病与透析肾移植杂志,2007,16(5):488 -493
12 Iskandar SS,Herrera GA.Glomerulopathies with organized deposits.Semin Diagn Pathol,2002,19(3):116 - 132.
13 Hildebrandt F,Strahm B,ProchoroffA,etal.Glomerulopathy associated with predominant fibronectin deposits:exclusion of the genes for fibronectin,villin and desmin as causative genes.Am J Med Genet,1996,63(1):323 - 327.
14 Moyano JV,Maqueda A,Albar JP,et al.A synthetic peptide from the heparin-binding domain III(repeats III4-5)of fibronectin promotes stress-fibre and focal-adhesion formation in melanoma cells.Biochem J,2003,371(Pt 2):565 - 571.
15 Vollmer M,Jung M,Rüschendorf F,et al.The gene for human fibronectin glomerulopathy maps to 1q32,in the region of the regulation of complement activation gene cluster.Am J Hum Genet,1998,63(6):1724 -1731.
16 WalkerR,Dixon S,Ruger B,et al.Familial fibronectin glomerulopathy:analysis of chromosome 1q32 and uteroglobin gene loci in a large New Zealand family.Nephrology,2001,6(5):191-197
17 Vollmer M,Kremer M,Ruf R,et al.Molecular cloning of the critical region for glomerulopathy with fibronectin deposits(GFND)and evaluation of candidate genes.Genomics,2000,68(2):127 -135.
18 Castelletti F,Donadelli R,Banterla F,et al.Mutations in FN1 cause glomerulopathy with fibronectin deposits.Proc Natl Acad Sci U S A,2008,105(7):2538 -2543.

