组织块法与传统破骨细胞培养方法对骨吸收功能的比较研究
王正东,颜南,曾亮,刘自力,臧晋,姜海波
(1.沈阳医学院基础医学院解剖学教研室,辽宁 沈阳 110034;2.医学应用技术学院康复教研室)
破骨细胞体外培养对从细胞与分子水平上来研究骨吸收机理与筛选骨质疏松症防治药物等有很重要的意义。单独纯化培养的破骨细胞没有骨吸收功能,只有与成骨细胞共培养时,破骨细胞才具有骨吸收功能。本文应用组织块法与传统破骨细胞培养方法来研究对破骨细胞骨吸收功能的影响。
1 材料和方法
1.1 实验动物与材料 实验动物:1 d龄Wistar大鼠6只 (雄雌均可)由沈阳医学院实验动物部提供。材料:高糖Dulbecco's Modified Eagle Medium(DMEM)培养基为Sigma公司产品,胎牛血清为GIBCO公司产品,1%甲苯胺蓝染液、萘酚AS-BI磷酸酯 (Sigma公司),副品红 (上海新中化学厂)。
1.2 薄骨片及玻片制备与处理 薄骨磨片的制备及处理:取新鲜成年牛股骨皮质-20℃贮存。临用前锯成1 cm宽条后,用磨片机磨成厚50μm的1 cm×1 cm骨片,蒸馏水清洗10次,置于体积分数为0.75的乙醇浸泡24 h,自然晾干,紫外线照射消毒骨片的两面,放于DMEM中4℃备用。玻片的制备:将玻片切成1 cm×1 cm大小,泡酸过夜,自来水冲洗干净,蒸馏水洗3遍,烤箱烤干,高压消毒灭菌后备用。
1.3 细胞分组培养 取6只1 d龄Wistar大鼠断颈处死,无菌取其四肢长骨,在磷酸盐缓冲液中尽可能去除附着在其表面的软组织。将骨干置于DMEM培养基 (含体积分数为0.15的胎牛血清[1],4μmol/L谷氨酰胺)中,纵行剖开,刮骨髓腔及靠近干骺端处内表面直至骨干成为极微小的碎片,组织块组直接接种于24孔板,而传统组则接下来将刮取的极微小碎片进行2.5 g/L胰蛋白酶消化5 min,300目筛网过滤,吸管反复吹洗筛网上残渣,吸取滤过悬液,4℃ 1 000 r/min离心10 min,弃上清,加4 ml DMEM培养基吹打均匀,接种于24孔板,置37℃、体积分数为0.05的CO2培养箱内培养,隔日更换培养液,每孔2 ml,继续培养[2]。培养液每24 h时换1次。
1.4 活体观察 应用相差倒置显微镜观察培养细胞的形态与运动情况,并摄影记录。培养成功后进行标志酶染色。
1.5 破骨细胞特异性酶活性检测 抗酒石酸酸性磷酸酶 (tartrate-resistant acid phosphatase,TRAP)染色 :孵育液A液:0.1 mol/L醋酸缓冲液,B液:六偶氮副品红,C液:取萘酚AS-BI磷酸酯加入N,N-二甲基甲酰胺溶解。将3种孵育液等比例混匀,调pH5.0,加入酒石酸钾钠配成TRAP孵育液,以不含萘酚AS-BI磷酸钠的孵育液作为阴性对照。玻片上培养3d的破骨细胞经25 g/L戊二醛4℃固定后放入孵育液内,37℃孵育50 min,10 g/L甲苯胺蓝复染,甘油明胶封固。
1.6 骨片吸收陷窝定量分析 (1)骨片吸收陷窝计数:参照文献[3],在培养第3天取出各组骨片,2.5%戊二醛固定液固定7 min,0.25 mol/L氢氧化铵中超声清洗5 min×3次,系列酒精脱水,自然晾干。1%甲苯胺蓝染液室温染色3~4 min,蒸馏水清洗后光镜下观察,100倍下对整张骨片作陷窝计数,结果以陷窝数/骨片表示。(2)吸收陷窝面积分析:以上各组经甲苯胺蓝染色骨片于400倍光镜下随机选取5个视野拍摄照片,采用计算机MetaMorph/Dp10/BX41分析系统勾画出骨陷窝轮廓,计算并比较各组陷窝面积。(3)吸收陷窝深度分析:以上各组经甲苯胺蓝染色骨片于400倍光镜下随机选取5个视野拍摄照片,由于陷窝着色深浅与其深度有关,采用计算机MetaMorph/Dp10/BX41分析系统计算各组骨片上陷窝染色的平均光密度值,并以此比较各组陷窝深度的差异。
1.7 统计学分析 数据以 (均值±标准差)表示,采用SPSS10.0统计软件进行统计学分析,采用t检验分析。
2 结果
2.1 相差倒置显微镜观察 在培养3 d组织块组的成骨细胞数量明显多于传统组 (图1、2),破骨细胞含几个到十几个细胞核。细胞形态随培养时间延长而不断变化。


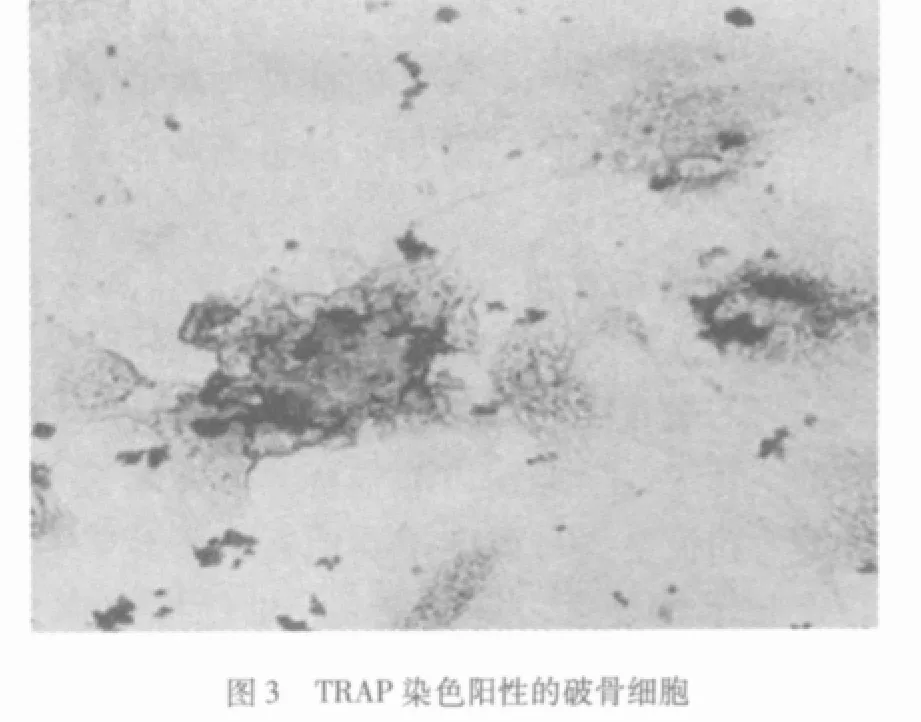
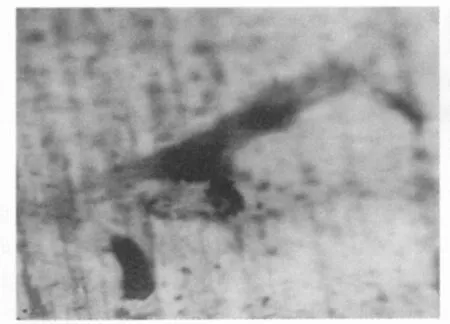
图4 光镜下观察去除细胞的骨片经甲苯胺蓝染色
2.2 TRAP染色光镜观察 破骨细胞形态各异,酶活性部位呈红色颗粒样沉淀,分布于全部或大部分胞浆,细胞核呈阴性,同片的其他细胞不着色 (图3),传统组不显色。
2.3 骨片吸收陷窝的形态特征 取培养3 d的骨片甲苯胺蓝染色后在光镜下观察,可见吸收陷窝呈蓝紫色圆形、椭圆形、腊肠形等多种形态,边界清楚,陷窝底纤维纹路隐约可辨 (图4)。
2.4 骨片吸收陷窝定量分析 骨片吸收陷窝计数、面积、深度分析见表1。

表1 骨片吸收陷窝定量分析
3 讨论
破骨细胞骨吸收功能有关的酶为酸性磷酸酶,组织化学染色证实破骨细胞胞浆内含有丰富的酸性磷酸酶,可是成骨细胞也含有少量的酸性磷酸酶,只有TRAP是破骨细胞的酸性磷酸酶同功酶,为破骨细胞所特有,作为鉴别破骨细胞的重要标志。本文TRAP染色结果显示破骨细胞胞浆呈红色,核呈阴性。
破骨细胞在骨片上形成吸收陷窝,其数量、大小和深度直接反映破骨细胞骨吸收的能力大小。观察陷窝的数量和测量陷窝的大小、深度是检测破骨细胞骨吸收功能的可靠指标。高建军等[3]研究表明:扫描电镜可清晰准确地观察骨片吸收陷窝,但技术较复杂,花费较大,难以推广应用。发现甲苯胺蓝的观察效果与破骨细胞的吸收程度有关并经扫描电镜观察所证实。骨片上吸收陷窝计数同扫描电镜计数结果也基本一致。因而可以应用甲苯胺蓝染色技术结合普通光镜观察替代传统的扫描电镜技术对骨片上吸收陷窝数目定量计数,方法简便、快速、可靠。
本实验选择细胞与细胞直接接触的方式,以研究成骨细胞对破骨细胞分化、成熟及其活性的影响。1,25(OH)2D3作为破骨细胞成熟的主要激活因子,具有明显促进骨吸收的作用,其信号转导方式为维生素D3受体转导途径[4],但其特异性受体只存在于成骨细胞及前成骨细胞的细胞膜上,破骨细胞膜上并无其受体。因此,它对体外分离培养的破骨细胞并无作用,只有在成骨细胞存在时,才能刺激破骨细胞性骨吸收的形成。
激活核因子NFκB受体的配体 (receptor activator of nuclear kappa B ligand,RANKL)、骨保护素 (osteoprotegerin,OPG)和NFκB受体活化因子(receptor activaror of NFκB,RANK)形成一个调节系统,影响破骨细胞的生成。当胞外刺激因素作用于成骨/基质细胞,诱导其膜上表达RANKL分子,通过与破骨细胞膜上的RANK直接结合,而后破骨细胞内的肿瘤坏死因子受体关联因子 (TNFR assiated factors,TRAF)与RANK的胞内区结合,将信号传入前体细胞,引起级联瀑布反应,使破骨细胞分化成熟[5]。而 OPG则由成骨/基质细胞旁分泌发挥作用,竞争性与RANKL结合,封闭RANKL与RANK的结合,抑制破骨细胞的分化、成熟[6]。
本实验中,无论是组织块法还是传统法都是成骨细胞和破骨细胞的共培养,只不过组织块法培养方法中成骨细胞的比例高,组织块法共培养体系中破骨细胞的数量急剧减少,可能与成骨细胞比例高有关。那么组织块法共培养体系中由于破骨细胞不能增殖和传代而成骨细胞是不断增殖的,所以共培养体系中成骨细胞的数量在培养过程中增加较快,成骨细胞旁分泌OPG与RANKL的相对比例增加,竞争性与RANKL结合,封闭RANKL与RANK的结合,使信号无法传入,从而抑制了破骨细胞的分化和成熟,导致了破骨细胞骨吸收功能下降。然而,对于成骨细胞是如何抑制破骨细胞分化的生物学机制仍需要进一步的研究。
[1]柴立民,王正东,颜南.不同体积分数血清对培养原代破骨细胞噬骨能力的影响[J].中国组织工程研究与临床康复,2007,11(28):5485-5487.
[2]王正东,颜南,李文海,等.新生鼠股骨破骨细胞存在位置的确定及其噬骨能力验证[J].中国组织工程研究与临床康复,2007,11(19):3698-3700.
[3]高建军,金慰芳,王洪复.骨片吸收陷窝光镜计数法定量测定破骨细胞功能 [J].上海医科大学学报,1998,25(1):71-73.
[4]王正东,柏树令,范军.1,25二羟基胆钙化醇诱导大鼠骨髓单核细胞向破骨细胞转化的机制[J].解剖学杂志,2008,31(2):148-150.
[5]颜南,王正东,金韵,等.异丙肾上腺素对大鼠骨髓单核细胞向破骨细胞转化的影响[J].中国组织工程研究与临床康复,2008,12(20):3818-3821.
[6] Boyce BF,Xing L.Functions of RANKL/RANK/OPG in bone modeling and remodeling [J].Arch Biochem Biophys,2008,473(2):139-146.

