壳聚糖对大肠杆菌攻毒仔猪生长性能和免疫力的影响
肖定福 唐志如 印遇龙 张 彬 冯泽猛 冉茂良
(1.湖南农业大学动物科学技术学院,长沙 410128;2.中国科学院亚热带农业生态研究所,长沙 410125;3.西南大学动物科技学院,重庆 400715)
壳聚糖对大肠杆菌攻毒仔猪生长性能和免疫力的影响
肖定福1,2唐志如2,3*印遇龙2张 彬1冯泽猛2冉茂良1
(1.湖南农业大学动物科学技术学院,长沙 410128;2.中国科学院亚热带农业生态研究所,长沙 410125;3.西南大学动物科技学院,重庆 400715)
本试验旨在探讨饲粮中添加壳聚糖对早期断奶仔猪生长、腹泻和免疫力的影响。试验选择50头21日龄、平均体重(6.62±0.59)kg的断奶仔猪,随机分为5组,每组10个重复,每个重复1头猪。预试期采用大肠杆菌攻毒(1×109个细胞/头),对照组饲喂基础饲粮,试验组分别在基础饲粮中添加50 mg/kg金霉素和200、300、400 mg/kg壳聚糖。试验期21 d。结果表明:1)与对照组相比,各试验组平均日采食量提高(P>0.05),料重比和腹泻率降低,平均日增重分别提高了 15.8%、9.2%、16.8%和21.1%(P>0.05)。2)与对照组相比,各壳聚糖组血清免疫球蛋白G(IgG)和免疫球蛋白M(IgM)水平以及回肠黏膜白介素1β(IL-1β)、白介素6(IL-6)和肿瘤坏死因子α(TNF-α)mRNA相对表达量均升高,金霉素组均下降,其中300和400 mg/kg壳聚糖组的血清IgG和IgM水平与金霉素组差异显著(P<0.05),400 mg/kg壳聚糖组血清IgG水平还与对照组差异显著(P<0.05),壳聚糖组IL-1β和TNF-αmRNA相对表达量与金霉素组差异显著(P<0.05),300和400 mg/kg壳聚糖组IL-6 mRNA表达量与金霉素组差异显著(P<0.05)。结果提示,饲粮中添加壳聚糖能促进仔猪生长,降低腹泻率,提高非特异性免疫力,且作用效果随饲粮中壳聚糖浓度的增加有增强的趋势。
壳聚糖;仔猪;生长性能;免疫力;细胞因子
畜产品安全性己受到全球范围日益广泛的关注,禁止使用抗生素添加剂成为一种必然的趋势,研究和开发无污染、无公害、无残留的新型绿色添加剂来替代饲用抗生素已成为当今动物营养领域研究的热点之一。壳聚糖带正电荷,具有良好的生物相容性、无毒、无免疫抗原性、无刺激性及可降解性等特点[1]。壳聚糖的溶解性与其分子量和脱乙酰度有关,适当低分子量和高脱乙酰度的壳聚糖在机体内可被胃酸、溶菌酶、卵磷脂分解酶等降解,降解过程中产生的低分子寡聚糖大部分能被机体吸收[2]。因壳聚糖具有抗菌[3-4]、增强免疫[5]、抗氧化[6]及促生长[7-8]等作用,在生物学领域被广阔的研究应用。壳聚糖以丰富的资源及优良的性质为其在饲料中的运用创造了良好的条件。在我国,壳聚糖作为猪饲料添加剂的研究还处于探索阶段。本研究就饲粮中添加不同水平壳聚糖对21日龄断奶仔猪平均日增重(ADG)、平均日采食量(ADFI)、料重比(F/G)、腹泻率、血清免疫球蛋白G(IgG)和免疫球蛋白M(IgM)水平以及回肠黏膜白介素1β(IL-1β)、白介素6(IL-6)和肿瘤坏死因子α(TNF-α)mRNA表达量的影响进行研究,以探讨饲粮中添加壳聚糖对早期断奶仔猪生长性能和免疫力的调控效果。
1 材料与方法
1.1 试验材料
壳聚糖,由中科院大连化学物理研究所提供,经本实验室纯化,用酸碱滴定法[9]测得其脱乙酰度(D.D)为91.25%,分子量22 ku,外观为淡黄色粉末。
试验用攻毒大肠杆菌(E.coli)菌株为3种导致仔猪下痢的大肠杆菌典型病原菌株,其血清型分别为E.coli09、0141、064,从中国兽医药品监察所选购。每种菌株在LB培养基中振荡培养12 h,以适应环境达到生长平台期,按1∶1∶1混合后,于预试期第4天按每头猪总大肠杆菌1×109个细胞给服,分早晚2次给服。
1.2 试验动物及试验设计
选购胎次相近,平均体重(6.62±0.59)kg的21日龄健康“杜×长×大”三元杂交去势断奶仔猪50头,随机分为5组,每组10个重复,每个重复1头猪,单栏饲养。
试验采用单因素完全随机分组试验设计,分为5个组,对照组(A组)饲喂基础饲粮,试验组分别在基础饲粮中添加50 mg/kg金霉素(B组)和200、300、400 mg/kg壳聚糖(C 组、D 组、E 组)。预试期7 d,正试期21 d。
基础饲粮参照NRC(1998)断奶仔猪营养需要配制,基础饲粮组成及营养水平见表1。
1.3 饲养管理
试验在全封闭高床猪舍进行,每日于08:00、12:00和18:00共投料3次,自由饮水,次日清晨称剩余料重。
1.4 样品采集
饲养试验结束后50头仔猪清晨空腹用前腔静脉采血10 m L于真空采血管中,编号后分离血清,每个血样用1.5 m L Eppendorf管分装成5份,置于-20℃冰箱保存备用,用于测定血清生化指标。
饲养试验结束后,5个组各随机取6头仔猪准备待宰,将待宰的30头仔猪剖杀前12 h禁食,采用颈静脉放血的方法处死,打开腹腔,取出回肠,用冰浴的PBS溶液冲洗外壁和内容物。取回肠中段50 cm,沿纵轴剪开肠道,用玻片刮下黏膜,编号后用锡箔纸包裹,迅速浸入液氮中,转入-80℃冰箱保存备用,用于测定回肠黏膜 IL-1β、IL-6和TNF-αmRNA相对表达量。

表1 基础饲粮组成及营养水平(干物质基础)Table 1 Composition and nutrient levels of the basal diet(DM basis) %
1.5 指标测定
1.5.1 生长指标
正试期第1天08:00空腹称重并记录(始重),正试期第22天08:00空腹称重并记录(末重)。记录正试期所耗饲粮重,计算ADG、ADFI及F/G,正试期每次喂料时观察粪便,稀软粪判为腹泻。
腹泻率(%)=100×腹泻仔猪头次/仔猪总头次。
1.5.2 血清生化指标
采用免疫投射比浊法检测血清中IgM和IgG水平,试剂盒购自深圳迈瑞生物医疗电子股份有限公司。
1.5.3 回肠黏膜 IL-1β、IL-6 和 TNF-α mRNA相对表达量
荧光定量PCR(Real-time PCR)法检测回肠黏膜IL-1β、IL-6和TNF-αmRNA相对表达量。
将-80℃保存的仔猪空肠和回肠黏膜样品置于盛有液氮的研钵中研成粉末,分装到1.5 m L的Eppendorf管中,每管50 mg左右,加1 m L Trizol(Invitrogen公司),冻存于-80℃冰箱备用。根据猪3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogease,GAPDH)、IL-1β、IL-6 和 TNF-αmRNA的基因序列,用 Primer Prem ier 5.0引物设计软件设计引物。并用NCBI中Blast初步检测引物的特异性。引物由宝生物(大连)工程有限公司合成。各引物序列见表2。
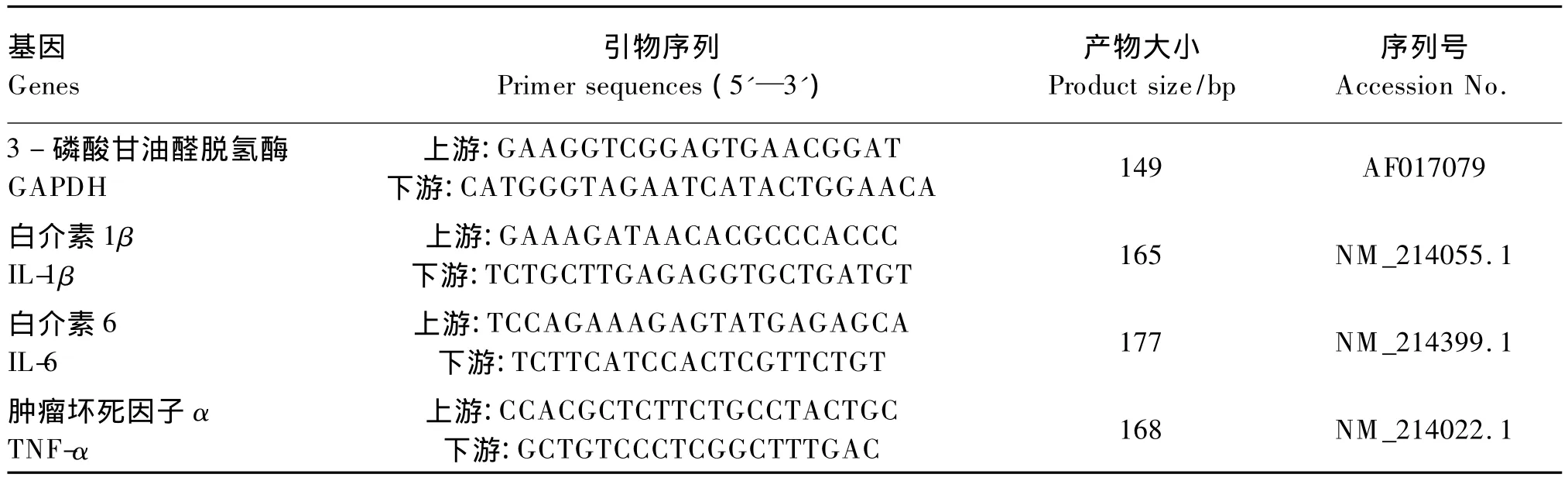
表2 仔猪IL-1β、IL-6、TNF-α和GAPDH m RNA引物序列Table 2 Primer Sequences of IL-1β,IL-6,TNF-α and GAPDH genes
RNA提取:按照 Trizol说明提取组织总RNA,并用核酸测定仪测量OD值,OD260/280在1.8~2.2的样品用于下一步试验,并将RNA稀释到1μg/μL,分装 -80℃保存备用。cDNA合成按Promega反转录试剂盒说明操作,反转录产物于-20℃保存备用。
每个样品做2个重复,Real-time PCR反应体系(10μL):cDNA 1 μL,SYBR(2×)5 μL,ROX 0.2 μL,Primer S(10 μmol)0.2 μL,Primer A(10 μmol)0.2 μL,DEPC-H2O 3.4 μL。反应程序:95℃,30 s;95℃,5 s;60℃,30 s;40个循环。
1.6 数据处理
采用SAS 9.1统计软件GLM程序进行方差分析,差异显著性分析用Duncan氏法进行多重比较,数据采用平均值±标准差表示;基因表达量分析以内参为对照,采用2-△△Ct法进行比较。
2 结果
2.1 壳聚糖对仔猪生长性能及腹泻率的影响
由表3可见,各组ADG和ADFI平均值高低顺序都为E组>D组>B组>C组>A组,各组间差异不显著(P>0.05),其中ADG平均值E组、D组、B组和C组分别比A组提高21.1%、16.8%、15.8%和9.2%;各组F/G平均值高低顺序为 A组>C组>D组>B组>E组,其中A组与B组、D组、E组差异显著(P<0.05),其余各组间无显著性差异(P>0.05)。这说明饲粮中添加壳聚糖能促进仔猪生长,提高采食量,降低F/G,作用效果与壳聚糖添加剂量的增大有增强的趋势,添加400 mg/kg壳聚糖组促生长效果优于金霉素组。
各组仔猪试验开始前腹泻率为0,大肠杆菌攻毒后腹泻率为100%。试验期间各组仔猪腹泻情况如图1所示,A组仔猪腹泻率下降缓慢,到饲养试验结束时仍有4头仔猪处于腹泻状态,B组仔猪腹泻率前期下降速率高于3个壳聚糖组,但8 d后比E组下降慢,10 d后比D组下降慢,14 d后一直有2头仔猪处于腹泻状态,而C组17 d后仅1头猪腹泻,D组和 E组分别于16、14 d后无腹泻仔猪。

表3 仔猪生长性能Table 3 The growth performance of weanling pigs
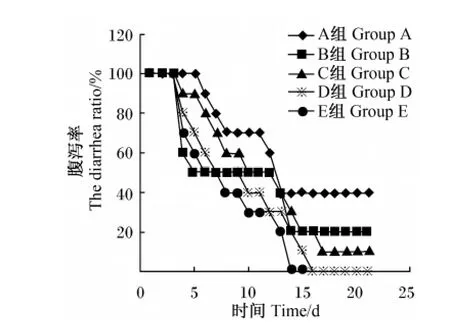
图1 仔猪腹泻率Fig.1 The diarrhea ratio of weanling pigs
2.2 仔猪血清IgM和IgG水平测定结果
由表4可见,金霉素组IgM和IgG水平与对照组相比有所下降,壳聚糖组IgM和IgG水平与对照组相比均有不同程度的提高,D组和E组IgM 水平与B组差异显著(P<0.05),E组IgG水平与A组和B组均差异显著(P<0.05),D组IgG水平与B组差异显著(P<0.05)。
2.3 仔猪回肠黏膜IL-1β、IL-6和TNF-αm RNA相对表达量
如图2所示,仔猪回肠黏膜 IL-1β、IL-6和TNF-αmRNA相对表达量C组、D组、E组与对照组相比均有不同程度的升高,B组比对照组有所下降。其中IL-1βmRNA相对表达量B组与其他4组差异显著(P<0.05);IL-6 mRNA相对表达量D组、E组与 B组差异显著(P<0.05);TNF-α mRNA相对表达量C组、D组、E组与B组差异显著(P<0.05)。结果说明,与对照组相比,仔猪饲粮中添加壳聚糖引起回肠黏膜中 IL-1β、IL-6和TNF-αmRNA表达量增加,但未引起大量增加。

表4 仔猪血清IgM和IgG水平Table 4 The serum IgMand IgG levels of weanling pigs
3 讨论
3.1 壳聚糖对仔猪机体免疫力的影响
在体液免疫中,IgG、IgM和免疫球蛋白 A(IgA)浓度的大小代表体液免疫功能的水平,浓度大时代表体液免疫功能强。IgG是血清中含量最高的免疫球蛋白抗体,约占血清免疫球蛋白总量的85%,在动物体内不仅含量高,而且持续时间长,是介导体液免疫的主要抗体,也是动物机体抗感染免疫的主力。本研究表明,饲粮中添加200、300和400 mg/kg壳聚糖均可提高21日龄断奶仔猪血清中IgG和IgM水平,而金霉素组IgG和IgM水平降低,添加300和400 mg/kg壳聚糖组与金霉素组还存在显著性差异,说明随仔猪饲粮中壳聚糖添加浓度增大血清中IgG和IgM水平有上升趋势。
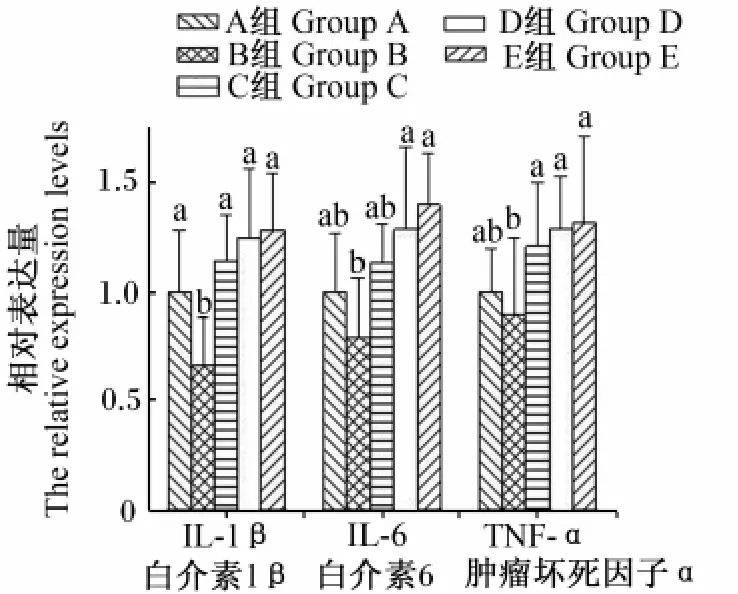
图2 仔猪回肠黏膜IL-1β、IL-6、TNF-a mRNA相对表达量Fig.2 The relative expression levels of IL-1β,IL-6 and TNF-αmRNA in the ileum mucosa of weanling pigs
消化道黏膜免疫系统在抵御病原菌的入侵,维护机体的健康方面起着非常重要的作用。在细胞免疫中,白介素1(IL-1)主要由巨噬细胞和上皮细胞产生,具有活化血管内皮、组织损伤、发热、淋巴细胞活化和诱导急性期蛋白质合成等活性。IL-6和TNF-α是被激活的巨噬细胞分泌的2种重要的细胞因子,IL-6可以促进淋巴细胞的增殖并参与T淋巴细胞、细胞毒T细胞(CTL)、自然杀伤(NK)细胞和淋巴因子激活的杀伤细胞(LAK)的活化。IL-1、IL-6和TNF-α在提高机体免疫机能的同时,可促进炎症反应,是具有抗炎和促炎双重作用的细胞因子,但其过量释放导致机体过度的炎症反应,从而引起多器官损害,因此也是应激性损伤的直接介导物,血清中IL-6和IL-1β水平是应激时炎症反应最具代表性的指示物[10]。壳聚糖分子结构中胺基可被机体免疫系统识别,激活巨噬细胞,趋化白细胞,刺激其产生淋巴因子和炎性介质[2,11]。Tang 等[7]报道,饲粮中添加250 mg/kg壳寡糖可通过启动肠相关淋巴免疫系统促进细胞因子IL-1基因表达,提高血液中IL-1、白介素2(IL-2)、IL-6及IgA、IgM、IgG浓度。本研究表明,壳聚糖可提高21日龄断奶仔猪回肠黏膜中IL-1β、IL-6和TNF-αmRNA表达量,还得出其与壳聚糖添加浓度呈一定的递增关系,但3个壳聚糖组只与金霉素组差异显著,与对照组无显著性差异,更未见引起极显著差异,提示添加壳聚糖未引起细胞因子大量释放,在抗炎症和提高免疫力的同时不会造成组织损伤。因此,可以认为壳聚糖能增强仔猪非特异性免疫力。
3.2 壳聚糖对仔猪生长性能的影响
肉仔鸡饲粮中分别添加 0.02%、0.05%、0.10%、0.30% 、0.50% 的壳聚糖,饲喂小剂量壳聚糖(0.02% ~0.30%)饲粮时,均呈现不同程度的促生长作用,尤以添加0.05%时促生长作用最明显,添加更高水平时,免疫功能有所增强,但生长性能却有下降趋势,添加3%的壳聚糖对肉仔鸡的生产性能有负效应[12],饲粮中添加不同水平(50、100、150 mg/kg)壳聚糖均能提高肉仔鸡ADG和免疫器官重量,以添加100 mg/kg壳聚糖效果最好[13]。在断奶仔猪饲粮中分别添加0.01%、0.02%、0.04%、0.06% 的壳聚糖,进行21 d饲养试验,得出壳聚糖能提高仔猪ADG和ADFI,降低仔猪 F/G[14]。Tang 等[7]认为壳聚糖促生长机理为促进垂体分泌生长激素(GH),提高肝脏生长激素释放激素(GRH)特异结合活性,从而促进胰岛素样生长因子-Ⅰ(IGF-Ⅰ)基因表达,提高血液中IGF-Ⅰ浓度,并通过介导而起促生长作用。本研究表明,饲粮中添加 200、300、400 mg/kg壳聚糖能促进仔猪生长,提高采食量,降低料重比,且随壳聚糖添加剂量的增加对生长性能的作用效果增强,其中添加400 mg/kg壳聚糖组促生长效果优于金霉素组。
仔猪早期断奶后,一方面由于母源抗体的逐渐减少,以及断奶应激降低了仔猪自身循环抗体水平并抑制了细胞免疫力和免疫水平,使仔猪抗病能力减弱而易感染病原微生物;另一方面由于断奶后消化酶活力下降,胃酸分泌不足及胃肠道上皮组织萎缩,使断奶仔猪消化道发生紊乱,容易发生腹泻。壳聚糖对大肠杆菌和金黄色葡萄球菌(St.aureus)具有很好的抑制作用,目前关于壳聚糖抑菌机理主要有以下2种观点:一种是根据壳聚糖的聚阳离子性质提出的以细菌带负电荷的细胞膜为靶位的机制,壳聚糖有正电荷的质子化铵,通过吸附在细胞表面,形成一层高分子膜,阻止营养物质向细胞内的运输,同时使其发生凹陷、变形和泄漏,从而起到抑菌杀菌作用;另外一种是以细菌分子中的DNA为靶位的抗菌机制,分子量小的壳聚糖通过渗透进入细胞体内,吸附细胞体内带有阴离子的细胞质,并发生絮凝作用,扰乱细菌DNA分子的转录,使之由内部瓦解衰亡,从而杀灭细菌[15]。本试验所用仔猪是经大肠杆菌攻毒引起腹泻的,200、300和400 mg/kg壳聚糖均能降低仔猪腹泻率,且随壳聚糖浓度的递增降低腹泻率效果增强,证实了壳聚糖的抑菌作用,其作用机理有待进一步研究。
4 结论
①壳聚糖能促进仔猪生长,提高采食量,降低F/G和腹泻率,且随浓度的增大有增强的趋势,添加300和400 mg/kg壳聚糖作用效果无明显差异,添加400 mg/kg壳聚糖促生长效果优于50 mg/kg金霉素。
②壳聚糖能提高仔猪血清中IgG和IgM水平,对回肠黏膜中 IL-1β、IL-6和 TNF-αmRNA相对表达量有一定的提高,且随壳聚糖添加浓度的增大有升高的趋势,并可提高仔猪非特异性免疫力。
[1]ZHONG Z,LIP,XING R,et al.Antim icrobial activity of hydroxyl benzene sulfonailides derivatives of chitosan,chitosan sulfates and carboxymethy chitosan[J].International Journal of Biological Macromolecules,2009,45(2):163-168.
[2]SEFERIAN P G,MARTINEZ M L.Immune stimulating activity of two new chitosan containing adjuvant formulations[J].Vaccine,2000,19:661 - 668.
[3]CHUNG Y C,CHEN C Y.Antibacterial characteristics and activity of acid-soluble chitosan[J].Bioresource Technology,2008,99:2806-2814.
[4]KONG M,CHEN X G,LIU C S,et al.Antibacterialmechanism of chitosan m icrospheres in a solid dispersing system againstE.coli[J].Colloids and Surfaces B:Biointerfaces,2008,65:197 -202.
[5]肖伟伟,冯琳,刘扬,等.壳聚糖对水生动物免疫能力的影响及其可能的调节机制[J].动物营养学报,2010,22(3):544 -550.
[6]QIAO Y,BAIX F,DU Y G.Chitosan oligosaccharides protectm ice from LPS challenge by attenuation of inflammation and oxidative stress[J].International Immunopharmacology,2011,11(1):121-127.
[7]TANG Z R,YIN Y L.Effects of dietary supplementation of chitosan and galacto-mannan oligosaccharide on serum parameters and the insulin-like growth factor-1 mRNA expression in early-weaned piglets[J].Domestic Animal Endocrinology,2005,28:430 -441.
[8]张彩芬,史彬林,金晓,等.壳聚糖对仔猪生长性能及血清中类胰岛素生长因子-Ⅰ和生长激素水平的影响[J].动物营养学报,2008,20(2):191 -195.
[9]蒋挺大.壳聚糖[M].北京:化学工业出版社,2001.
[10]ADREW S,MARK H,YOICHIC.The effects of acute psychological stress on circulating inflammatory factors in human:a review and meta-analysis[J].Brain Behavior and Immunity,2007,21:901-912.
[11]YANG Y,CHEN J,LIH,etal.Porcine interleukin-2 gene encapsulated in chitosan nanoparticles enhances immune response of m ice to piglet paratyphoid vaccine[J].Comparative Immunology,Microbiology and Infectious Diseases,2007,30(1):19 -32.
[12]RAZDAN A,PETTERSSON D,PETTERSSON J.Broiler chicken body weight feed intakes,plasma lipid and small intestinal bile acid concentrations in response tofeeding of chitosan and pectin[J].The British Journal of Nutrition,1997,78(2):283 -291.
[13]刘梅.壳聚糖对肉仔鸡生长性能和免疫器官指数的影响[J].枣庄学院学报,2010,27(2):117 -120.
[14]赵燕,周杰,陈安国.壳聚糖对断奶仔猪生产性能和非特异性免疫功能的影响[J].中国饲料,2006,21:26-28.
[15]LIX F,FENG X Q,YANG S,et al.Effects ofmolecular w eight and concentration of chitosan on antifungal activity against aspergillus niger[J].Iranian Polymer Journal,2008,17(11):843 -852.
*Corresponding author,professor,E-mail:tangzhiru2326@yahoo.com.cn
(编辑 武海龙)
Effect of Chitosan on G row th Perform ance and Imm unity in Weanling Pigs Challenged withEscherichia coli
XIAO Dingfu1,2TANG Zhiru2,3*YIN Yulong2ZHANG Bin1FENG Zemeng2RAN Maoliang1
(1.College of Animal Science and Technology,Hunan Agricultural University,Changsha410128,China;2.Subtropical Agriculture Ecological Research Institute,Chinese Academy of Sciences,Changsha410125,
China;3.College of Animal Science and Technology,Southwest University,Chongqing400715,China)
The experimentwas conducted to study effects of chitosan on growth performance and immunity in weanling piglets.Fifty pigletswith an average body weight of(6.62 ±0.59)kg were challenged with enterotoxigenicEscherichia coli(1×109cell per head)during adaptation period and random ly assigned to 5 groups with 10 replicates per group and 1 piglet in each replicate.The piglets in control group were fed basal diet,and the others in experimental groups were fed the basal diet supplemented with 50 mg/kg chlortetracycline,200,300 or 400 mg/kg chitosan,respectively.The experiment lasted for 21 days.The results showed as follows:1)compared with the control group,in every experimental group,average daily feed intake was improved(P>0.05),the ratio of feed to gain and diarrhea ratio were decreased,and the average daily gain was increased by 15.8%,9.2%,16.8%and 21.1%(P> 0.05),respectively.2)Compared with the control group,the serum immunoglobulin G(IgG)and immunoglobulin M(IgM)levels,relative expression levels of interleukin-1β (IL-1β),interleukin-6(IL-6)and tumor necrosis factor-α (TNF-α)mRNA in ileum mucosa were improved in the chitosan groups,but decreased in the chlortetracycline group.The IgG and IgM levels in the 300 and 400 mg/kg chitosan groups were significant higher than those in the chlortetracycline group(P<0.05),and the IgG level in the 400 mg/kg chitosan group was significant higher than that in the control group(P<0.05).The relative expression level of IL-1β and TNF-α mRNA in the three chitosan groupswas significant higher than those in the chlortetracycline group(P<0.05),and the relative expression levels of IL-6 mRNA in the 300 and 400 mg/kg chitosan groups were significant higher than that in the chlortetracycline group(P<0.05).These results indicate that supplemented with 200,300 and 400 mg/kg chitosan in diets can improve growth performance,decrease diarrhea ratio and enhance non-specific immunity of weanling piglets,furthermore,those effects have enhancing trend with increasing the concentration of chitosan in diets.[Chinese Journal of Animal Nutrition,2011,23(10):1783-1789]
chitosan;weanling pigs;growth performance;immunity;cytokine
S828
A
1006-267X(2011)10-1783-07
10.3969/j.issn.1006-267x.2011.10.019
2011-04-25
湖南省自然科学基金青年项目(10JJ4013);西南大学博士基金(SWU111002);国家863项目(2008AA10Z316)
肖定福(1977—),女,湖南娄底人,博士研究生,从事动物营养生理研究。E-mail:xiaodingfu2001@yahoo.com.cn
*通讯作者:唐志如,教授,硕士生导师,E-mail:tangzhiru2326@yahoo.com.cn

