利用α-淀粉酶和β-淀粉酶制备缓慢消化淀粉
于国萍,连 莲
(东北农业大学食品学院,哈尔滨 150030)
淀粉是人体营养的主要碳水化合物并能提供一定范围的生理性能。淀粉的结构和加工决定了淀粉的营养品质[1]。Englyst等根据人体对淀粉消化释放葡萄糖时间快慢将其分成三种,其中抗性淀粉(RS)是不被人体小肠内酶水解的、最终到达人体大肠的那部分淀粉[2];缓慢消化淀粉(SDS)和快速消化淀粉(RDS)都是在人体小肠内被消化完全并吸收的那一部分淀粉,但缓慢消化淀粉被淀粉酶降解的速度要比普通淀粉慢得多。SDS具有多种生理功能,SDS作为低血糖生成指数的食物可以缓慢释放葡萄糖有效改善餐后血糖负荷[1],缓解高血糖和高胰岛素症状,改善脂质代谢,降低心脑血管疾病的发生。由于SDS在胃肠道中缓慢消化吸收,缓慢释放能量,较长时间保持饱腹感[3],有利于控制肥胖、保持适宜体重[4-5]。SDS可以改善肠道运动,促进毒素排出,减少结肠癌等肠道疾病的发病率[4-6]。SDS作为一种新型的功能性食品,具有缓慢消化吸收、持续释放能量、维持餐后血糖稳态、预防与饮食相关慢性疾病的特殊生理学功能,因此成为食品科学和现代营养学领域的一个研究热点。目前,国外一些学者对SDS制备工艺等方面进行了研究。Shin等用异淀粉酶水解蜡质高粱淀粉制备含有SDS的产品[7]。Hamaker用糊化后的淀粉通过控制α-淀粉酶水解程度制备SDS[8]。Guraya等采用普鲁兰酶脱支处理大米淀粉制备SDS[9]。Zihua Ao等通过α-淀粉酶、β-淀粉酶及分别添加转移葡萄糖苷酶水解普通玉米淀粉,增加淀粉的分支结构,降低淀粉的消化率[10]。本文利用普通玉米淀粉为原料,在一定条件下,利用α-淀粉酶、β-淀粉酶进行酶处理,从而提高缓慢消化淀粉的产率,并通过正交试验结果优化工艺条件,为SDS的酶解法的制备提供参考。
1 材料与方法
1.1 材料与仪器
普通玉米淀粉;磷酸氢二钠、磷酸二氢钠、柠檬酸、硼酸、硼砂、3,5-二硝基水杨酸、氢氧化钠、酒石酸钾钠、结晶酚、麦芽糖,均为分析纯;α-淀粉酶4 000 U·g-1(北京奥博星生物技术有限责任公司);β-淀粉酶50 000 U·g-1(Sigma公司);猪胰腺α-淀粉酶(Sigma公司)。
电子天平(北京赛多利斯仪器系统有限公司);722-2000型分光光度计(山东高密度彩分析仪器有限公司);DHG-924OA型电热恒温鼓风干燥箱(上海恒科学仪器有限公司);FE20型pH计(梅特勒-托利多仪器(上海)有限公司);DH5000A型电热恒温培养箱(中国天津泰斯特仪器有限公司);电子恒温水浴锅(中国天津泰斯特仪器有限公司);LD4-2A型离心机(北京医用离心机厂)。
1.2 方法
1.2.1 缓慢消化淀粉的制备
α-淀粉酶法:在Zihua Ao法[10]的基础上稍作修改。取普通玉米淀粉16 g,加入200 mL pH 4.0~9.0的磷酸盐缓冲溶液,搅拌均匀,于80℃的水浴中糊化30 min,自然冷却降温,α-淀粉酶添加量为40~480 U,在30~80 ℃下酶解 10~180 min,沸水浴酶活 20 min,4 000 r·min-1离心 10 min,收集沉淀于4℃冷藏回生2 d,60℃烘干12 h,粉碎后过160目筛。测定SDS的产率。各因素平行试验3次,试验重复3次。
β-淀粉酶法:在Zihua Ao[10]法的基础上稍作修改。取普通玉米淀粉16 g,加入200 mL pH 3.0~9.0磷酸盐缓冲溶液,搅拌均匀,于80℃的水浴中糊化30 min,自然冷却降温,β-淀粉酶添加量为250~3 000 U,在 30~80 ℃下酶解 10~240 min,沸水浴酶活 20 min,4 000 r·min-1离心 10 min,收集沉淀于4℃冷藏回生2 d,60℃烘干12 h,粉碎后过160目筛。测定SDS的产率。各因素平行试验3次,试验重复3次。
1.2.2 缓慢消化淀粉产率的测定
以Guraya法[9]为参考。该法的测定原理是样品在37℃下用猪胰腺α-淀粉酶分别作用1 h后和10 h,采用3,5-二硝基水杨酸法,在540 nm下比色测定麦芽糖含量。具体计算公式如下:
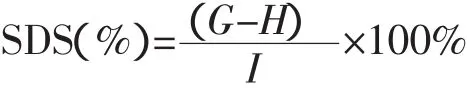
式中,G,脱支改性淀粉在某一时间间隔内麦芽糖含量无变化时的量(g);H,脱支改性淀粉在时间间隔1 h内产生的麦芽糖量(g);I,总淀粉量(g,以麦芽糖计)。
1.2.3 制备SDS最佳工艺条件的确定
为了确定两种酶处理的最佳工艺条件,根据单因素试验结果,设计正交试验L9(34)。
2 结果与分析
2.1 酶添加量对缓慢消化淀粉产率的影响
如图1~2所示,随着淀粉酶加入量的增大,SDS产率也在增加,当α-淀粉酶加入量为200 U时,SDS产率较高;β-淀粉酶加入量为750 U时,SDS产率较高。因为酶的用量和淀粉的黏度大小紧密相关,在淀粉酶的作用下,淀粉分子的分子链相对变短,加入酶量少时,淀粉分子被切断的程度不够,淀粉糊的黏度仍然很大,不利于其相互接近形成结晶;但随着加酶量的增大,短淀粉链的分子增多,并且分支密度增加,在冷却处理中利于回生,使淀粉分子重结晶过程中更容易结晶,从而有效形成SDS。当加酶量继续增加时,淀粉糊黏度过低,相互接近的概率减小,不利于冷却回生后结晶,影响SDS的形成,使得SDS产率下降。β-淀粉酶法制备SDS产率高于α-淀粉酶法,这是因为α-淀粉酶是随即切开淀粉内部α-1,4糖苷键,但不能切开α-1,6糖苷键,也不能水解分支点附近的-1,4糖苷键,而β-淀粉酶虽然不能水解α-1,6糖苷键也不能跨越分支点继续水解,但β-淀粉酶是从淀粉的非还原端依次切开α-1,4糖苷键,使得淀粉分子的链长一部分被缩减,故形成较多的小分子链,在冷却回生过程中容易形成SDS。
2.2 温度对缓慢消化淀粉产率的影响
如图3所示,随着温度的增加,反应体系逐渐达到适宜温度,使得此时的淀粉在回生过程中易于聚集成结晶结构,生成SDS,但反应体系温度过高,影响了淀粉分子的聚集,从而不利结晶结构的形成,造成SDS产率下降。当α-淀粉酶酶解温度为60℃时SDS产率较高,当β-淀粉酶酶解温度为50℃时SDS产率为较高。
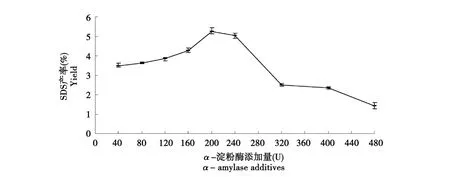
图1 α-淀粉酶酶添加量对缓慢消化淀粉产率的影响Fig.1 Effect of α-amylase additives on yield of SDS
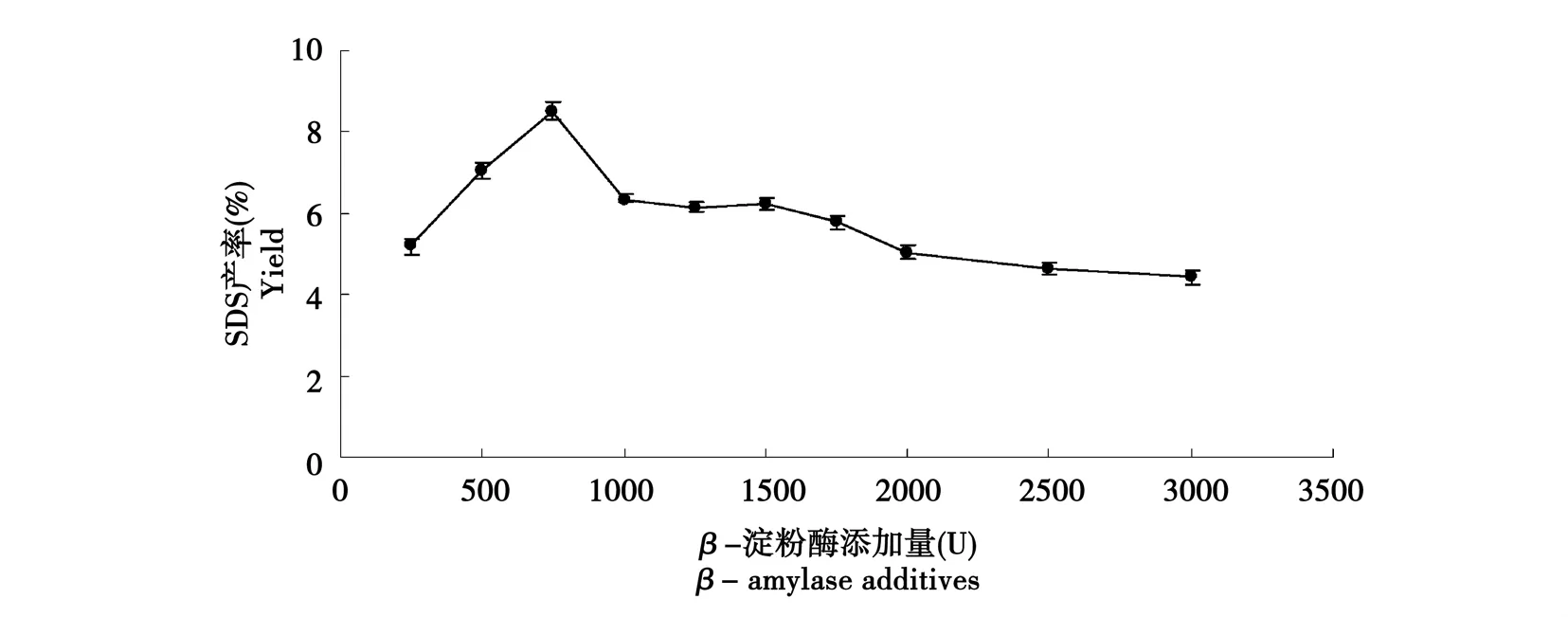
图2 β-淀粉酶酶添加量对缓慢消化淀粉含产率量的影响Fig.2 Effect of β-amylase additives on yield of SDS
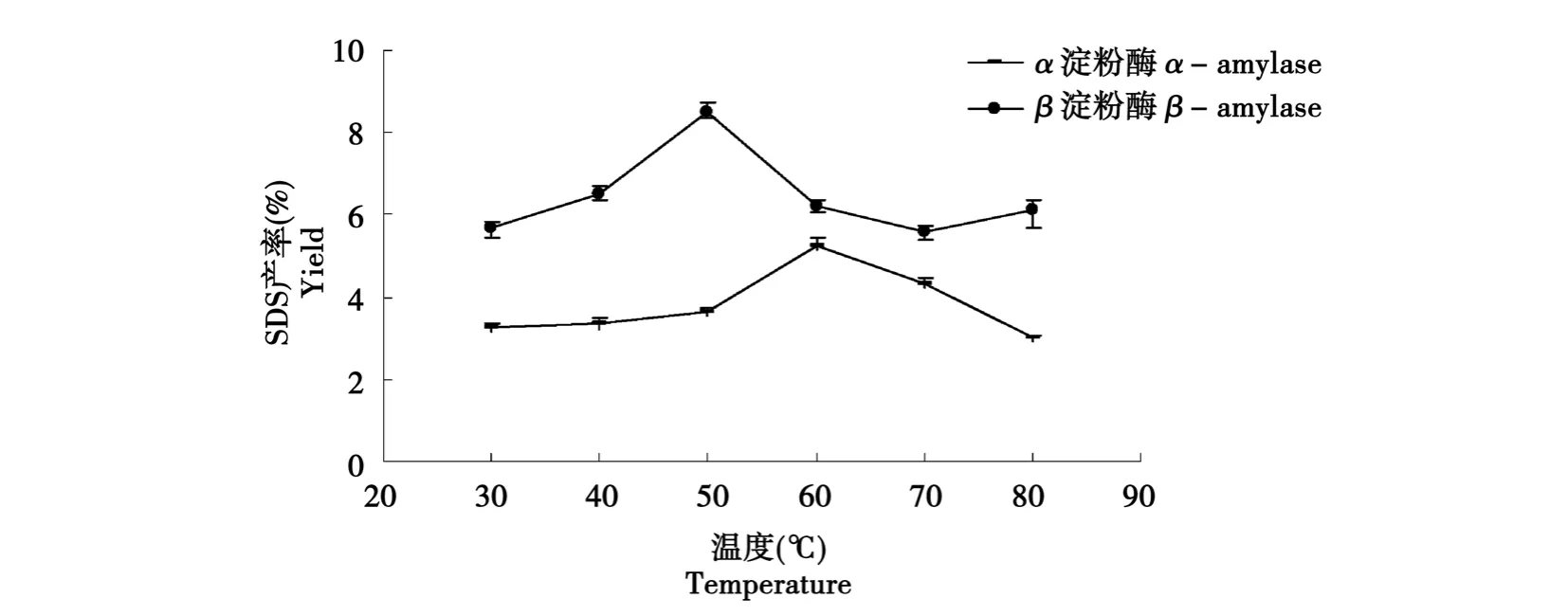
图3 温度对缓慢消化淀粉产率的影响Fig.3 Effect of temperature on yield of SDS
2.3 时间对缓慢消化淀粉产率的影响
如图4所示,酶解时间相对较短时,糊化淀粉中含有较少的短链淀粉,较多的长链淀粉分子冷却回生比较缓慢,不利于SDS的生成;而酶解时间相对较长,短链淀粉分子活动剧烈也不利于结晶形成SDS[11],因此酶解时间对SDS的形成影响很大。当α-淀粉酶酶解30 min时SDS产率提高,当β-淀粉酶酶解60 min时SDS产率较高。
2.4 pH对缓慢消化淀粉产率的影响
结果见图5。

图4 时间对缓慢消化淀粉产率的影响Fig.4 Effect of time on yield of SDS
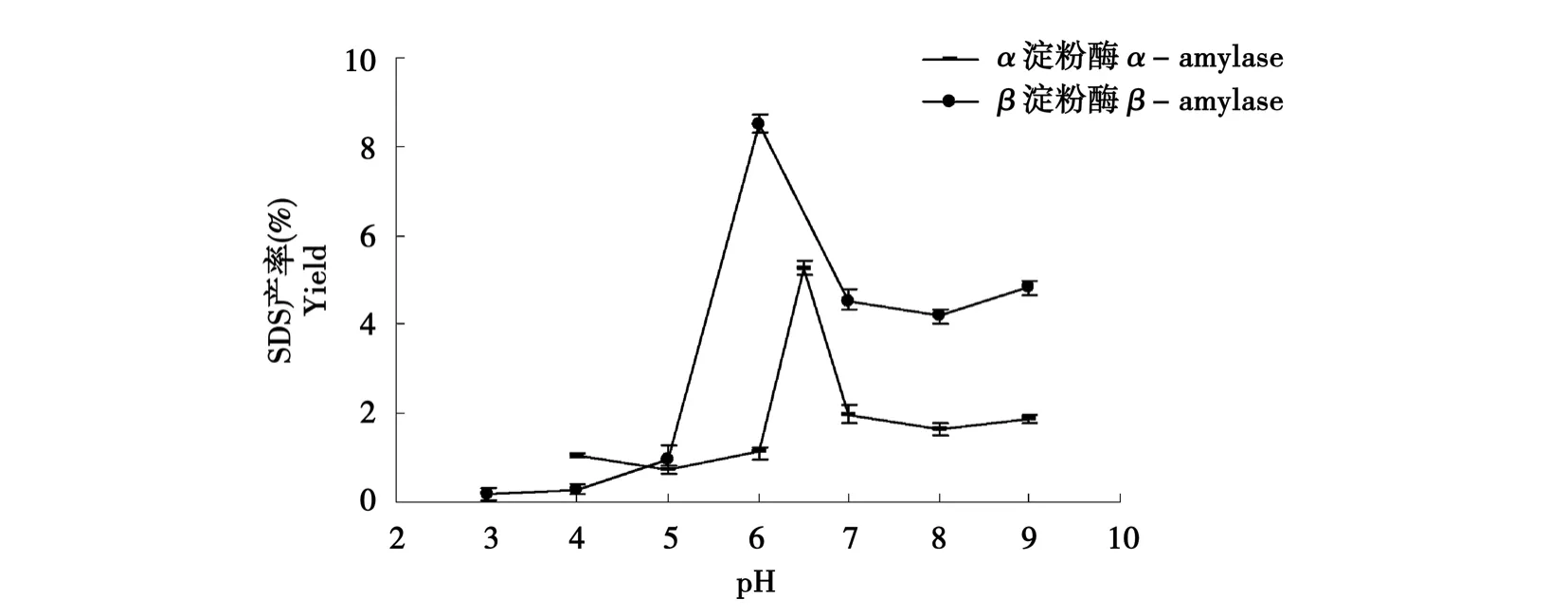
图5 pH对缓慢消化淀粉产率的影响Fig.5 Effect of pH on yield of SDS
如图5所示,随着反应体系pH的增加,逐渐到最适环境,有利于生成较多的SDS,当pH超过最适值时,淀粉酶活性在一定程度上受到影响,SDS产率也随之降低。当α-淀粉酶反应体系为pH 6.5时,SDS含量达到5.26%;当β-淀粉酶反应体系为pH 6.0时,SDS产率达到8.51%。
2.5 正交试验结果
结果见表1、2。
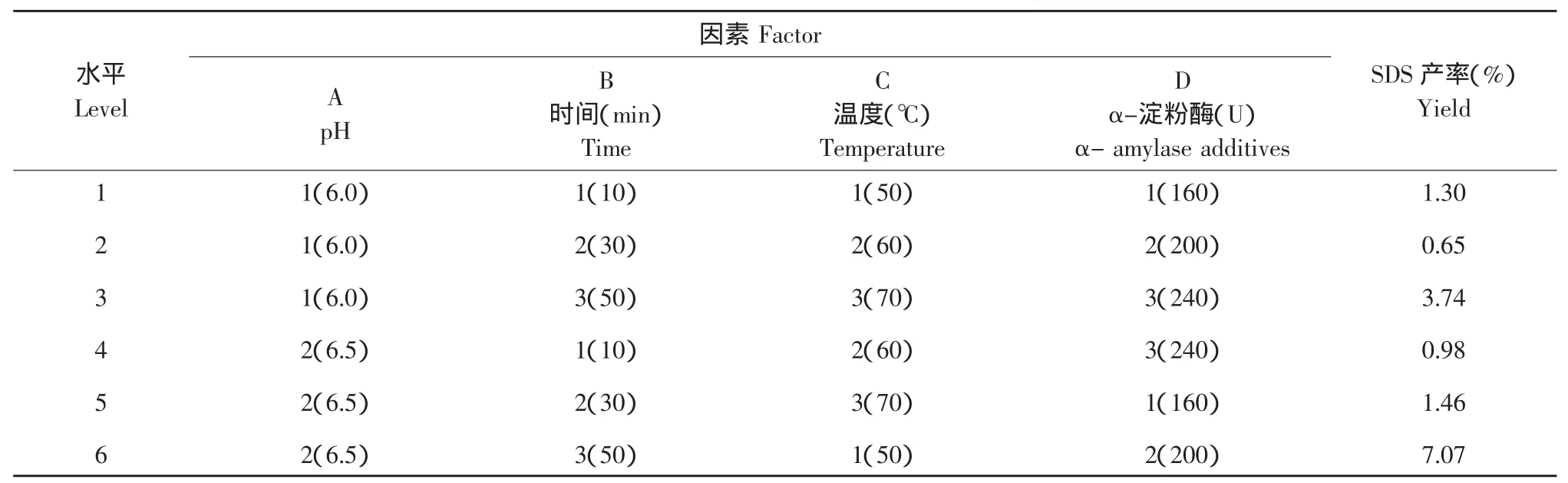
表1 α-淀粉酶法L9(34)试验方案及试验结果分析Table 1 L9(34)trial schemes and test results of using α-amylase
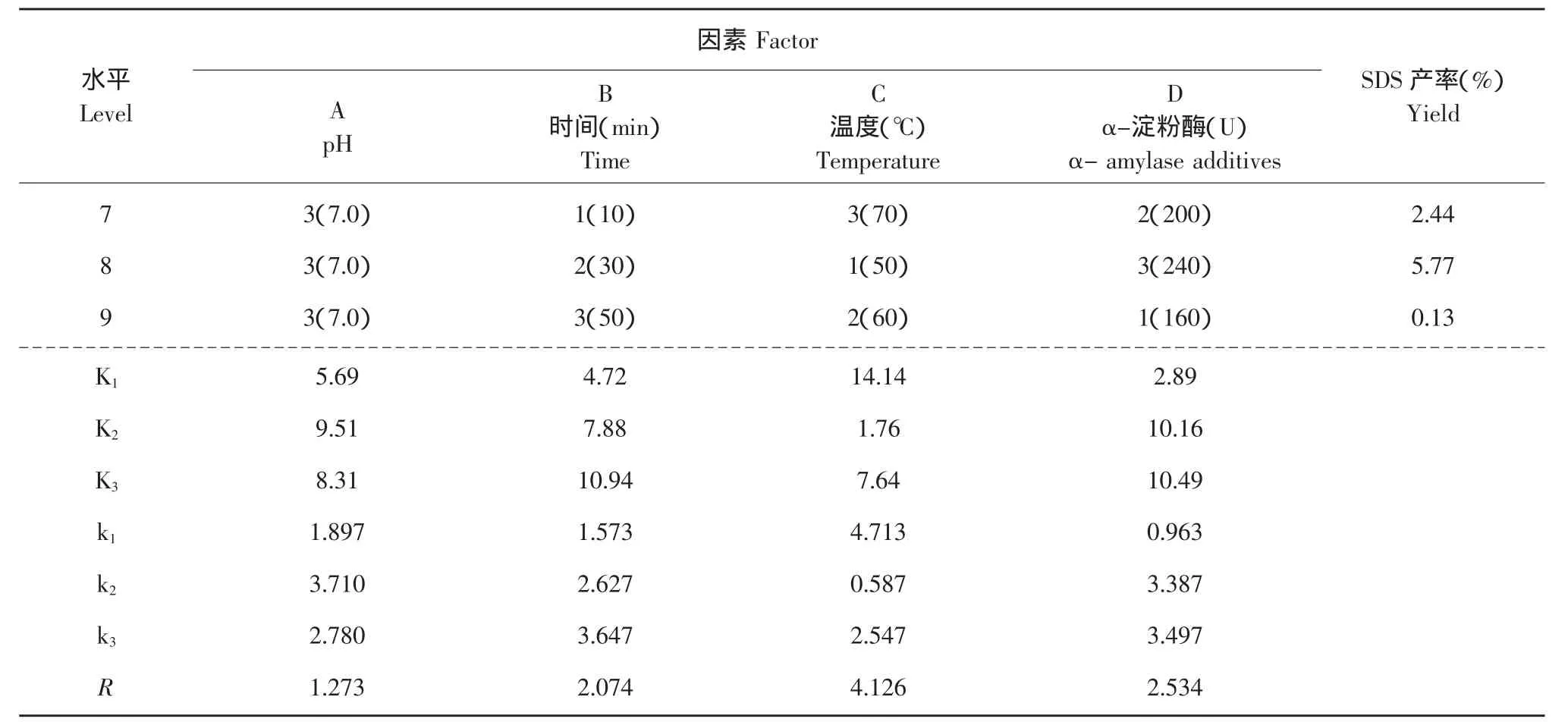
续表
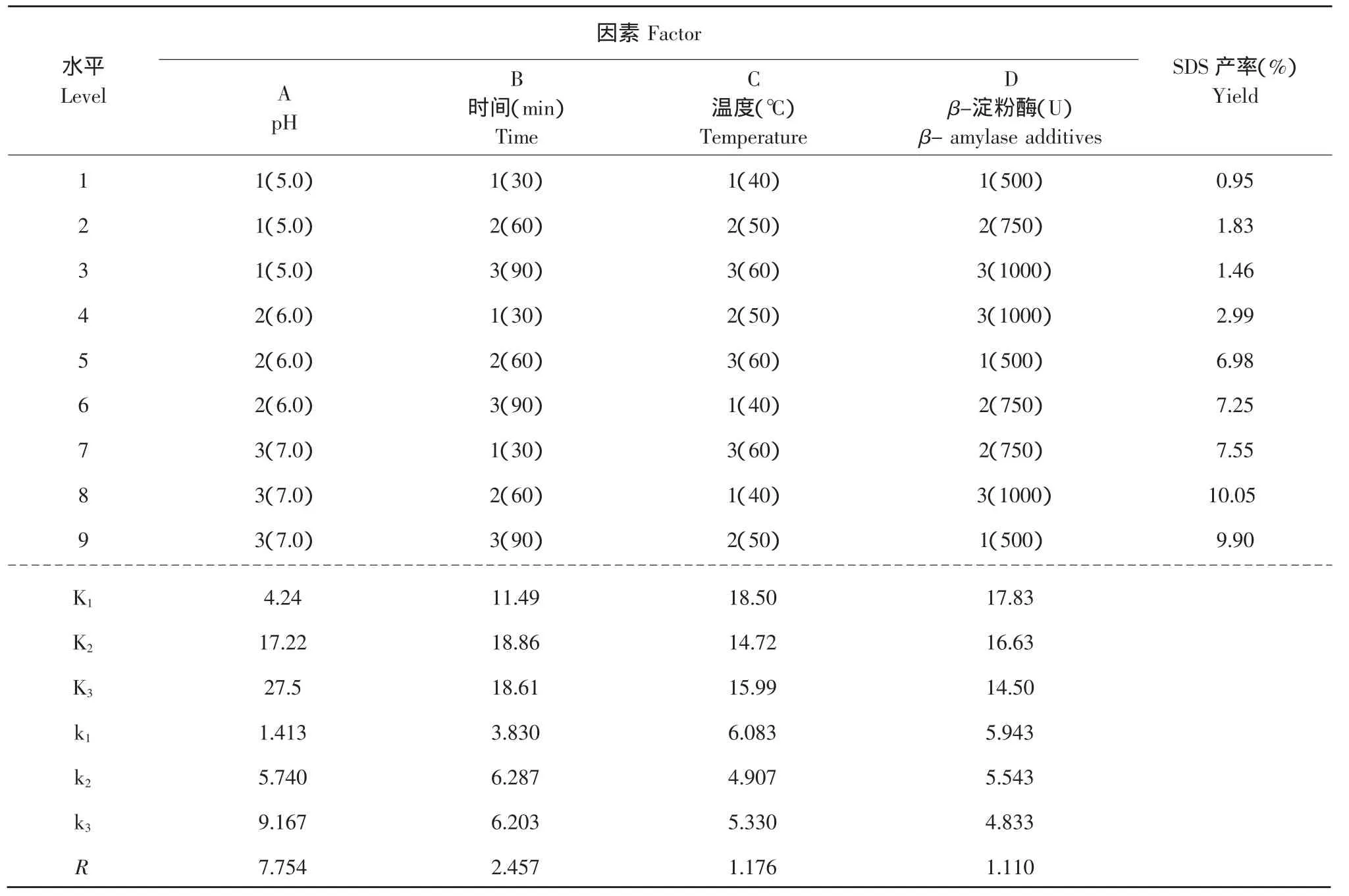
表2 β-淀粉酶法L9(34)试验方案及试验结果分析Table 2 L9(34)trial schemes and test results of using β-amylase
由表1可知,通过正交试验对α-淀粉酶法制备SDS的工艺参数的优化,确定各因素的影响顺序为:酶解温度(C)>α-淀粉酶用量(D)>酶解时间(B)>pH(A)。经极差分析确定的α-淀粉酶法制备SDS的最佳工艺组合为A2B3C1D3,即pH 6.5,酶解时间50 min,酶解温度50℃,α-淀粉酶用量240 U时,SDS产率最高,达到7.11%。
由表2可知,通过正交试验对β-淀粉酶法制备SDS的工艺参数的优化,确定各因素的影响顺序为:pH(A)>酶解时间(B)>酶解温度(C)>β-淀粉酶用量(D)。经极差分析确定的β-淀粉酶法制备SDS的最佳工艺组合为A3B2C1D1,即pH 7.0,酶解时间60 min,酶解温度40℃,β-淀粉酶用量500 U时,SDS产率最高,达到10.12%。
3 讨论
采用α-淀粉酶法、β-淀粉酶法水解玉米淀粉可以制备SDS,通过正交试验法确定了α-淀粉酶和β-淀粉酶水解玉米淀粉制备SDS的适宜工艺条件,由于两种制备方法的最佳工艺条件差别不大,而β-淀粉酶法制备的产品产率较高,但其所得产品的功能性质有待于进一步的研究。酶法制备缓慢消化淀粉国内多数研究是利用脱支酶法进行脱支处理,本研究利用淀粉酶法处理玉米淀粉,在参照国外淀粉酶制备缓慢消化淀粉的工艺条件的基础上进行了优化,从而提高了缓慢消化淀粉的产率,为酶解法制备缓慢消化淀粉的工艺条件提供了参考。同时利用淀粉酶法制备SDS的工艺条件较为简单、便于操作,同时也为进一步开发控制血糖类的功能性食品奠定了理论基础。
4 结论
本文分别采用α-淀粉酶法、β-淀粉酶法处理玉米淀粉制备缓慢消化淀粉,α-淀粉酶最佳工艺条件为体系pH 6.5,酶解时间50 min,酶解温度50℃,α-淀粉酶用量240 U;β-淀粉酶最佳工艺条件为体系pH 7.0,酶解时间60 min,酶解温度40℃,β-淀粉酶用量500 U,其SDS最高产率分别为7.11%和10.12%。
[1] Lehmann U,Robin F.Slowly digestible starch-its structure and healthimplications:areview[J].FoodScienceandTechnology,2007,18:346-355.
[2] Englyst H N,Kingman S M,Cummings J H.Classification and measurement of nutritionally important starch fractions[J].Eur J Clin Nutr,1992,46(Suppl.2):33-50.
[3] Campfield L A,Smith F J.Blood glucose dynamics andcontrol of meal initiation:a pattern detection and recognition theor y[J].Physiological Reviews,2003,83:25-58.
[4] Chung H J,Shin D H,Lim S T.In vitro starch digestibility and estimated glycemic index of chemically modified corn starches[J].FoodResearchInternational,2008,41:579-585.
[5] 赵凯.淀粉非化学改性技术[M].北京:化学工业出版社,2008.
[6] Wolever T,Mehling C,High-carbohydrate-low-glycaemic index dietary advice improves glucose disposition index in subjects with impaired glucose tolerance[J].British Journal of Nutrition,2002,87:477-487.
[7] Shin S I,Choi H J,Chung K M,et al.Slowly digestible starch from debranched waxy sorghum starch:Preparation and properties[J].Cereal Chem,2004,81(3):404-408.
[8] Hamaker B R,Zhong H X.Slowly digestible starch[R].WHO,2004066955,2004-08-12.
[9] GurayaHS,JamesC,ChampagneET.Effectofenzyme concentration and storage temperature on the formation of slowly digestible starch from cooked debranched rice starch[J].Starch/Starke,2001,53:131-139.
[10] Ao Zihua,Simsek S,Zhang G,et al.Starch with a slow digestion property produced by altering Its chain length,branch density,and crystalline structure[J].Agricultural and Food Chemistry,2007,55:4540-4547.
[11] 胡耀辉,李彩霞,朴春红,等.普鲁兰酶和α-淀粉酶法制备缓慢消化淀粉的比较研究[J].淀粉工程技术,2010(6):72-96.

