酯交换植物油中甾醇测定方法研究
窦巍巍,胡立志,朱秀清*,陈 昊,于殿宇
(1.东北农业大学食品学院,哈尔滨 150030;2.国家大豆工程技术研究中心,哈尔滨 150050)
甾醇是一种从植物油工业副产物中得到的天然活性物质,能有效降低有害低密度胆固醇(LDL)的水平,而不影响有益高密度胆固醇(HDL)的水平[1-3],人体内有益高密度胆固醇(HDL)能将组织及动脉壁上多余的胆固醇运输到肝脏进行代谢,在机体中起着“清道夫”的作用[4]。甾醇具有降低血胆固醇、抗癌、防治心血管疾病等生理功能[5-6]。在脂肪酶的催化下,通过酯交换反应可大大增加甾醇的脂溶性,能比较方便地添加到油脂或含油脂食品中,近年来在西方国家被广泛应用[7]。
植物油中甾醇含量的测定方法很多,早期的分析方法有毛地黄皂苷法、Lieberman-Burchard比色法,毛地黄皂苷法所测得含量稍有偏高,且操作安全性要求较高[8]。目前,主要分析方法有气相色谱法和高效液相色谱法。这些方法分析精度高,可检测总甾醇含量及甾醇的组成,但仪器操作和维护要求高、标准品价格昂贵[9]。为寻求一种简单、快捷、准确且低成本的测定方法,对适用于食品中胆固醇检测的国标铁矾显色法进行了试验研究,依据为:从结构上看,甾醇和胆固醇的结构非常相似,所不同的只是C17支链上的结构,实际上两者发生颜色反应的显色基团是相同的[10]。本试验确定显色反应的最佳测定条件,最终对酯交换植物油中甾醇的含量进行测定。本研究目的是提出一种测定酯交换植物油中甾醇含量的方法,旨在为测定酯交换植物油中甾醇的含量提供快速而简单的分析方法。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
油脂样品:高油酸葵花籽油一级油(购自大连圣基生物制品有限公司),大豆油一级油(购自九三集团哈尔滨惠康食品有限公司),酯交换植物油。
甾醇(纯度≥95%)(购自西安蓝天生物工程有限责任公司),毛地黄皂甙(购自Sigma公司),其他药品均为分析纯。
1.1.2 国标铁矾显色法试剂配制
铁矾储备液:将 4.463 g NH4Fe(SO4)2·12H2O溶解于100 mL 85%磷酸中,贮于干燥器内,此液在室温中稳定。
铁矾显色液:吸取铁矾储备液10 mL,用浓硫酸定容至100 mL。贮于干燥器内,以防吸水。
1.1.3 仪器
TU-1901双光束紫外可见分光光度计,北京普析通用仪器有限公司;DK-2000-ⅢL数显恒温水浴锅,天津市泰斯特仪器有限公司;电子天平,北京赛利多斯仪器系统有限公司。
1.2 方法
甾醇总含量的测定:采用国标铁矾显色法[11]、Lieberman-Burchard 比色法[12]和毛地黄皂苷法[13]测定酯交换植物油中甾醇的含量。
1.2.1 国标法铁矾显色法甾醇标准曲线的测定
根据国标铁矾显色法[11],吸取甾醇标准常备液0.0、0.5、1.0、1.5、2.0 mL分别置于10 mL试管内,在各管内加入冰乙酸使总体积皆达4 mL。沿管壁加入2 mL铁矾显色液,混匀,室温下显色15 min后,于最大吸收波长下测定吸光度,每个点重复3次。以甾醇标准浓度为横坐标,吸光度值为纵坐标,绘制标准曲线。
1.2.2 酯交换植物油中甾醇的测定
取酯交换植物油3~4滴,置于25 mL试管内,准确记录其重量,65℃恒温水浴中皂化1 h。冷却后加入3 mL 5%氯化钠溶液,10 mL石油醚,振摇2 min,静置分层。取上层石油醚液2 mL,氮气吹干后,加入4 mL冰乙酸,2 mL铁矾显色液,混匀,放置15 min后在最大吸收波长下比色,测得吸光度,在标准曲线上查出相应的甾醇含量。
2 结果与分析
2.1 国标铁矾显色法最大吸收波长的确定
取浓度为2 mg·mL-1的甾醇标准样品适量,按照国标铁矾显色法进行处理,并通过分析选择扫描波长范围为500~700 nm。采用双光束紫外可见分光光度计于500~700 nm范围内扫描,在556 nm处有最大吸收峰,因此,选择556 nm作为测定吸收波长。吸收曲线见图1。

图1 植物甾醇的吸收谱Fig.1 Visible absorption spectrum of phytosterol
2.2 国标铁矾显色法测定甾醇总含量标准曲线
根据参考文献[11],以甾醇作为标样绘制标准曲线,结果见图2。计算其回归方程为:Y=0.21001X+0.01216,R2=0.9974。相关系数为正,说明吸光值随甾醇含量增大而增大,其绝对值接近1,两个变量间的直线相关密切。曲线回归性好,可用于定量分析。
2.3 国标铁矾显色法稀释倍数的确定
植物油与甾醇酯交换后,植物油中甾醇的含量较高,不在标准曲线可检测到的范围内,通过稀释的方法加以调整。?
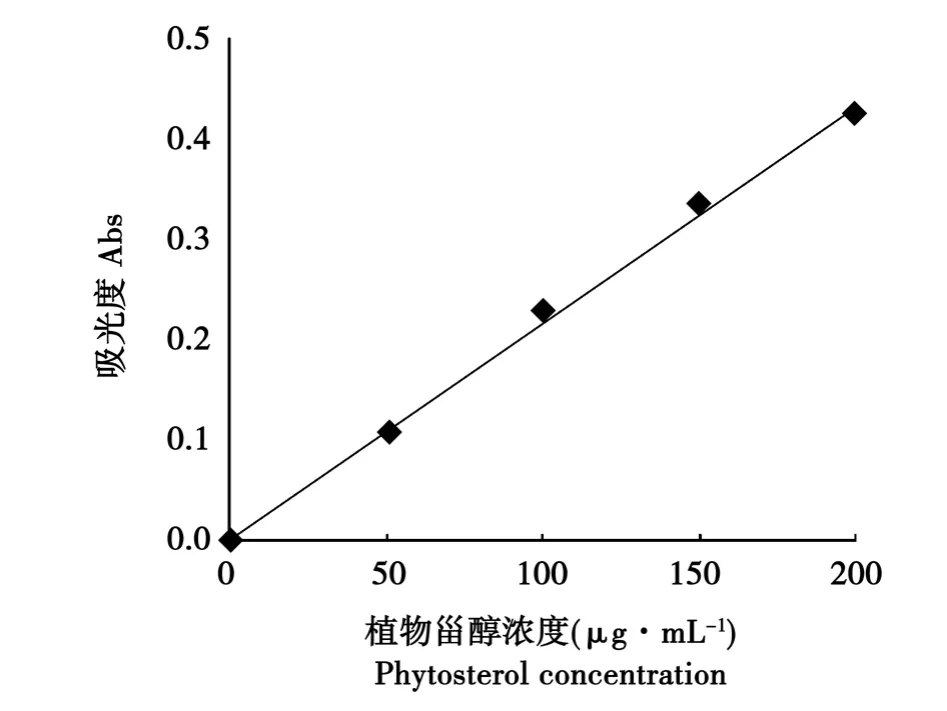
图2 植物甾醇标准曲线Fig.2 Standard curve of phytosterol concentration
酯交换植物油中甾醇含量较高,进行显色处理使用乙酸稀释,稀释倍数为10倍时标准偏差S=0.001,相对标准偏差RSD=1.09%,为最佳稀释倍数。结果见表1。
2.4 国标铁矾显色法最优显色条件的确定
选取3个对显色过程影响较大的因素(即显色时间、显色剂用量、显色剂的组成比例-铁矾储备液:浓硫酸)为研究对象,以甾醇含量为考察指标进行正交试验,其因素水平见表2。
2.5 正交试验设计
选择适宜的因素和水平进行正交试验设计,分别准确称取油样100.0 mg,改变反应的时间、显色剂用量、显色剂组成比例3个因素,按照表2给出的因素水平编码表,以酯交换植物油中甾醇含量为指标,进行正交试验设计,优化显色反应条件。
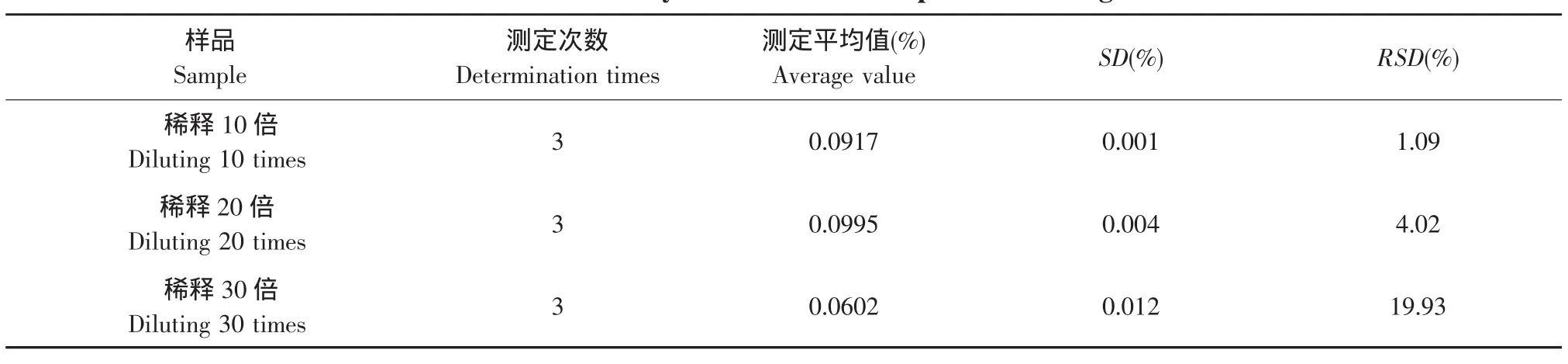
表1 稀释倍数分析结果Table 1 Influence analysis of dilution multiple on detecting results

表2 因素水平Table 2 Factors and levels of orthogonal test
2.6 正交试验结果分析
由表3可以看出,影响显色反应的因素的主次关系为:显色剂用量B>显色剂组成比例(C)>显色时间A。其中显色剂用量(B)是影响显色反应的最主要因素。其次,影响显色反应的因素为显色剂组成比例(C),显色剂组成中浓硫酸含量较高,操作时应注意安全。显色时间(C)对显色反应也有一定的影响,最佳显色时间为15 min。通过以上分析可确定最佳反应条件为A1B2C1,即显色剂用量2 mL,显色剂组成比例1∶9,显色时间15 min,在最佳反应条件下进行验证试验,所得甾醇含量为0.0914%。
2.7 国标铁矾显色法测定植物甾醇总含量
采用国标铁矾显色法、Lieberman-Burchard比色法和毛地黄皂甙法测定了4种油样(A高油酸葵花籽油,B大豆油,自制油样C、D为油样A、B分别对应的高含量甾醇的酯交换植物油),三种方法测得的结果见表4。由表4可以看出,三种方法的测定结果的精密度都较高。
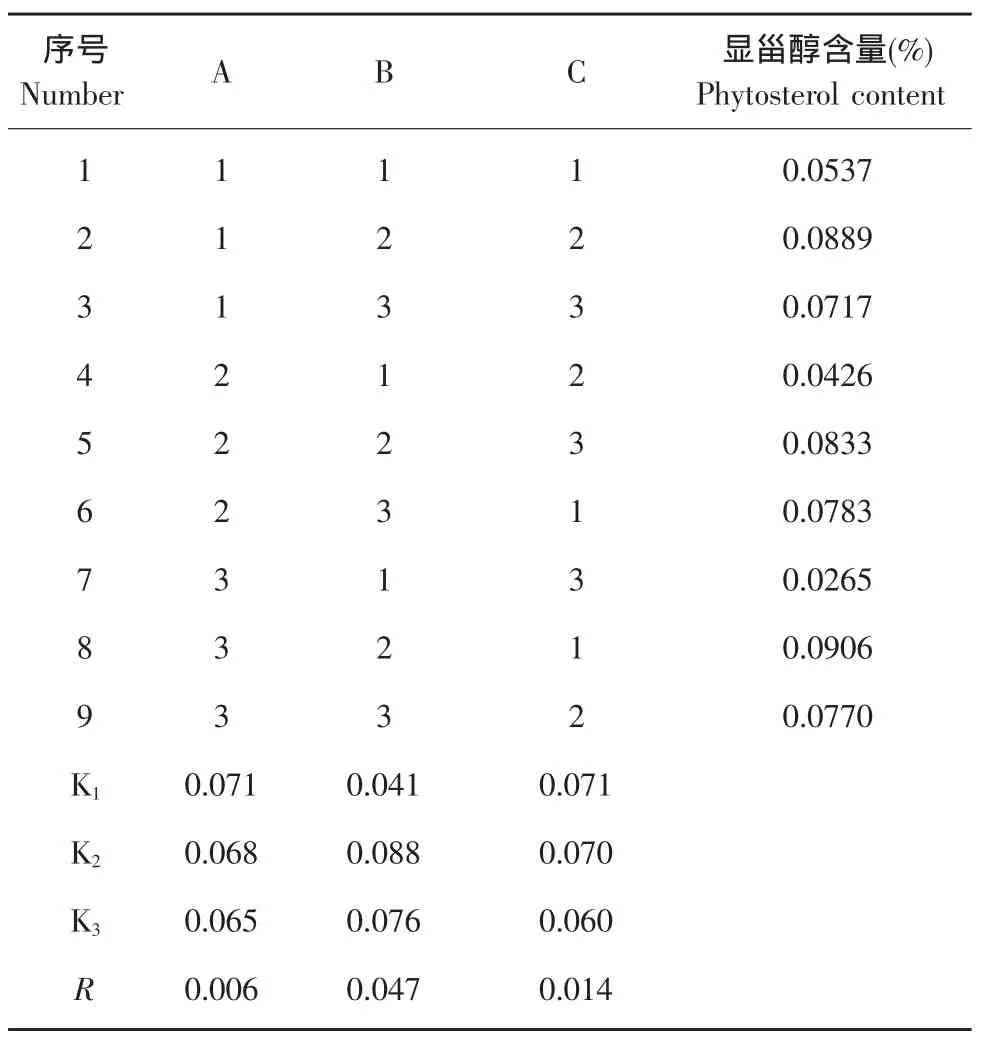
表3 正交试验结果及分析Table 3 Results and range analysis of orthogonal test
三种方法测定A和B油样时的平均误差分别为11.63%、4.85%、5.27%,可见国标铁矾显色法测定低含量甾醇平均误差较大,Lieberman-Burchard比色法适用于低含量甾醇的测定;三种方法测定C和D油样时的平均误差分别为4.54%、9.00%、4.82%,国标铁矾显色法测定高含量甾醇的平均相对误差较小,国标铁矾显色法适用于酯交换植物油中高含量甾醇的测定。按照国标法对植物油进行皂化,对于高含量甾醇酯交换植物油可稀释后测定,最佳稀释倍数为10倍,显色稳定后,在15 min测定吸光值。
2.8 国标铁矾显色法回收率试验
采用加样回收法。取同批酯交换植物油样品5份约2.2 mg,精密量取浓度为5.0 mg·mL-1甾醇对照品溶液2 mL,分别加入上述5份样品中。按国标铁矾显色法处理,加2 mL显色剂,于最大吸收波长处测定吸光度,计算回收率(见表5)。
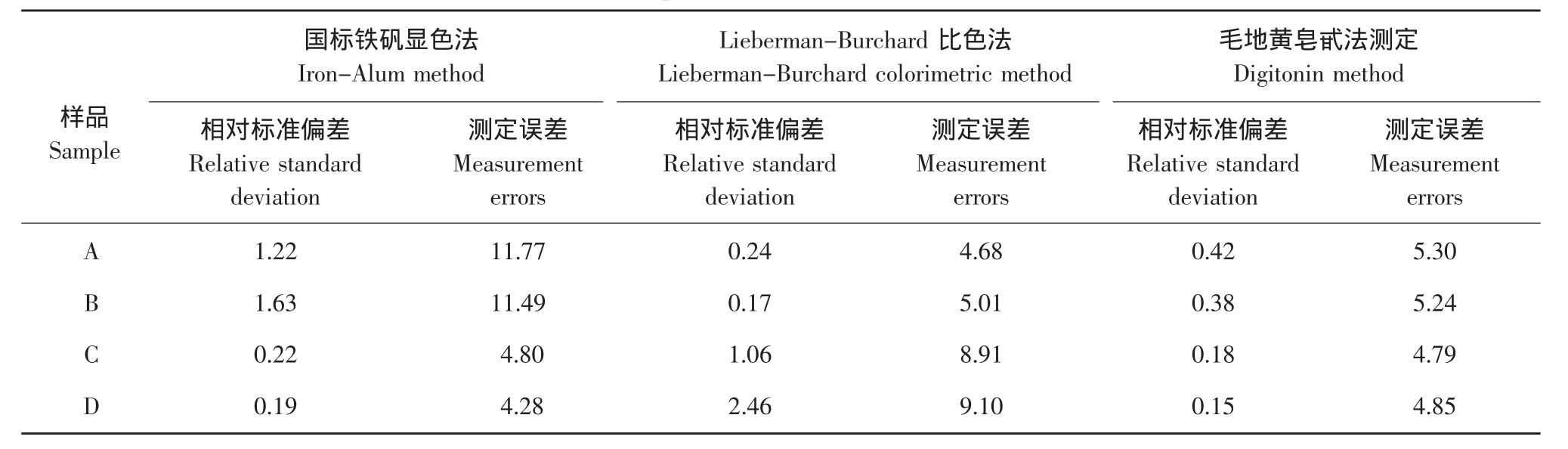
表4 三种测定方法的比较分析Table 4 Comparative analysis of three methods (%)
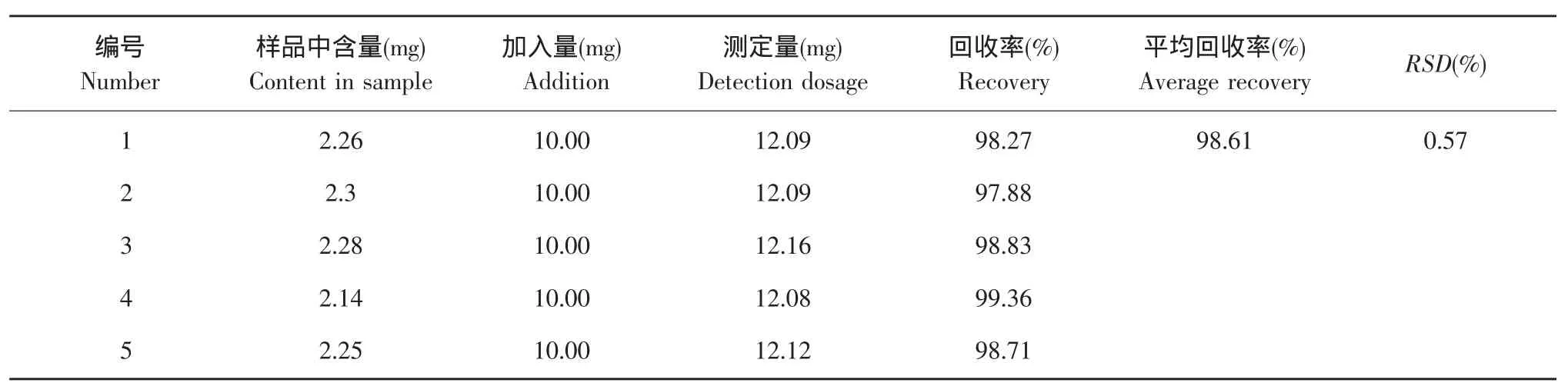
表5 回收率测定结果Table 5 Result of fortified recoveries
从表5可见,平均回收率为98.61%,相对标准偏差为0.57%,表明加样回收可满足要求,本方法测定结果准确可靠。
3 讨论
a.高含量甾醇的酯交换植物油在油脂领域引起了高度重视和关注,具有降血脂、防治心血管疾病的功能。本研究尝试将测定胆固醇的国标方法,用来测定酯交换植物油中甾醇的含量,甾醇结构上与胆固醇非常相似,两者产生颜色反应的显色基团是相同的,以往甾醇的研究方法多由测定胆固醇的方法衍生来。
b.影响显色反应的因素有稀释倍数、显色时间、显色剂用量、显色剂的组成比例,其中显色剂的组成为铁矾储备液和浓硫酸,经过正交实验结果分析得出的最佳显色剂的组成比例为1∶9,其中浓硫酸浓度较高,在实际操作中需注意。
c.参考不同物质中甾醇含量的检测方法,在国标铁矾显色法基础上改进后建立了一种新的快速、准确的检测方法,适用于酯交换植物油中高含量甾醇的检测,并且与另外两种检测方法进行了对比分析,分析结果显示此方法具有较好精确度和回收率,不需昂贵的标准品,操作简便快捷,适用于实际研究和产业生产监测,是一种值得推广的检测方法。
4 结论
以高含量甾醇的酯交换植物油为检测对象,探索了国标铁矾显色法、Lieberman-Burchard比色法和毛地黄皂甙法测定酯交换植物油中高含量甾醇的可行性,研究结果证明Lieberman-Burchard比色法适用于低含量甾醇的植物油的测定。
通过对国标铁矾显色法(食品中胆固醇测定法)的研究,在此基础上改进后,可适用于酯交换植物油中高含量甾醇的测定。通过正交试验得出国标铁矾显色法最佳显色条件:显色剂用量2 mL,显色剂组成比例1∶9,显色时间15 min,并试验得出最佳稀释倍数为10倍,平均误差为4.54%,平均回收率为98.61%。具有较好的精度、准确性和回收率,操作方法简便,为酯交换植物油中甾醇含量的测定提供了一种快速而有效的方法。该方法可为添加甾醇功能性油脂的研究提供参考,并可为产业化生产提供快捷和简便的监测手段。
[1] Weber N.Cholesterol-lowering food additives:lipase-catalysed preparation of phytosterol and phytostanol esters[J].Food Research International,2002,35(1):177-181.
[2] Nashed B,Yeganeh B,Hayglass K T,et al.Antiatherogenic effects ofdietary plantsterolsare associated with inhibition of proinflammatory cytokine production in Apo E-KO mice[J].J Nutr,2005,135:2438-2444.
[3] Villeneuve P,Turon F,Caro Y,et al.L ipase-catalyzed synthesis of canola phytosterols oleate esters as cholesterol lowering agents[J].EnzymeandMicrobialTechnology,2005,37(1):150-155.
[4] 贺亮,李锐,邓旭明.极度高甘油三脂高胆固醇血症动物模型的建立[J].东北农业大学学报,2009,40(2):79-82.
[5] 韩军花,杨月欣.植物甾醇的性质、功能及应用[J].国外医学卫生学分册,2001,28:285-291.
[6] 文镜,樊蓉.植物甾醇和植物甾烷醇降胆固醇的功效和安全性[J].食品科学,2005,26(8):437-442.
[7] 陈茂彬,黄琴,吴谋成.植物甾醇油酸酯产品的合成工艺研究[J].中国油脂.2005,30(6):63-65.
[8] 高瑜莹,裘爱泳,潘秋琴,等.植物甾醇的分析方法[J].中国油脂,2001,26(1):25-28.
[9] 吴时敏,吴某成,付志高.两种测定植物甾醇总含量的方法初探[J].中国粮油学报,2003,18(6):86-88.
[10] 吴时敏.功能性油脂[M].北京:中国轻工业出版社,2001:180-181.
[11] 中国预防医学院营养与食品卫生研究所.GB/T 5009.128-2003食品中胆固醇的测定[S].北京:中国标准出版社,2003.
[12] 刘蕾,陈星,李晓丽,等.分光光度法测定大豆总甾醇含量的研究[J].中国油脂,2005,30(4):45-47.
[13] 周宝兰.米糠油甾醇组成的研究[J].中国粮油学报,1990,5(1):28-35.

