低温催化水解二硫化碳技术的研究进展
何 丹,易红宏,唐晓龙,王红妍,赵顺征
(昆明理工大学环境科学与工程学院,云南 昆明 650093)
CS2是一种有毒的有机硫化合物,不仅在天然气、焦炉气、煤制气、水煤气、炼厂气和克劳斯尾气中广泛存在,而且在化纤行业中也存在少量的CS2[1-2],不同种类的气源导致CS2的含量有所不同[3]。另外,目前人类活动已成为大气中CS2最主要的来源[4]。由于CS2具有毒性大、挥发性强和沸点低等特点,在生产和使用过程中容易散发到空气中,对环境和人体造成严重的污染和危害[5]。不断排放的CS2在平流层中易被氧化成二氧化硫,从而导致酸雨。王琳等[6]研究发现,CS2在颗粒物表面可被催化氧化,产生毒性更大的COS,该反应在工业城市低层大气中发生会极大影响大气环境;微量的CS2存在于工业原料气中存在则会使化工生产中各种催化剂中毒失活,严重影响其催化效果和使用寿命[7]。同时由于CS2会缓慢水解生成H2S,腐蚀生产设备[8],增加了设备投资和产品成本。因此CS2的脱除对保护环境和减少工业生产中的经济损失都有重要的意义[9],已成为气体深度净化中必须解决的问题[10]。目前,在合成甲醇、氨、费托合成油、聚丙烯、食品级CO2和低碳醇生产中均涉及到CS2的脱除问题[11]。
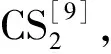
本文将从CS2水解催化剂的研究与开发、催化水解的反应动力学和反应机理、催化剂中毒失活3方面来介绍CS2水解技术的研究状况。
1 水解催化剂的研究与开发
1.1 载体
催化剂的制备过程中,载体的选择是一个关键步骤,一种优良的催化剂载体应该具有较大的表面积、好的耐热性和高的机械强度,有的载体还能担当催化剂和助催化剂的角色[16]。
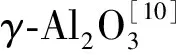
具有较大的孔容量和比表面积的活性炭[27]也是常用的CS2水解催化剂载体[10],它作为一种特殊的催化剂载体,具有良好的电子传导性和丰富的微孔结构、较弱的金属载体相互作用等特点[28],这种发达的中孔和微孔结构有利于CS2的吸附[14]。王丽等[29]研究了低温(85~125 ℃)环境中,在Ce-K-AC(活性炭)催化剂下催化水解-氧化耦合脱除CS2的过程,发现该过程中,中间产物H2S被完全地转化成单质硫或硫酸盐。
1.2 活性组分
在载体上负载活性组分可以提高催化剂的水解催化活性和延长其使用寿命,负载活性组分使催化剂从原来的酸碱中心共存变为碱中心占主导地位[30]。碱金属氢氧化物或碱金属碳酸盐是调变γ-Al2O3碱性活性中心、提高催化活性的优良组分。近年来,越来越多的水解催化剂采用1种或几种碱金属、碱土金属、稀土金属及过渡金属的化合物浸渍,取得了良好的效果,这些金属或复合金属的水溶性流失也小于单纯的碱金属作用[31]。
刘伟等[32]研究表明,纳米钛粒子在空气中于500 ℃下焙烧后转变为金红石型TiO2,在不同条件下进行CS2的水解试验,结果表明,TiO2的负载量(质量分数)为2%的TiO2/A12O3的催化剂比活性氧化铝具有明显的耐硫酸盐化中毒能力,有机硫水解能力也高于活性氧化铝。LYT-511型中温耐硫有机硫水解剂是以TiO2为主要活性组分,添加其它活性组分为促进剂制得,该催化剂可以在150~350 ℃、高硫高氧条件下使用,对COS、CS2等有机硫的转化率可达96%,具有较好的应用前景[33]。余春等[1]考察了以γ-Al2O3为载体,分别浸渍TiO2和V2O5为活性组分,在一定的试验条件下,得到催化水解CS2的转化率分别为40%和30%以上,而且这2种催化剂都具有较好的抗氧中毒能力。
多种活性组分的加入可调变催化剂表面碱性点的分布,延长催化剂使用寿命[17]。张菊等[13]以γ-Al2O3为载体制备了含有不同活性组分的水解催化剂,结果表明双组分贵金属Pt-Pd/Al2O3具有较好的催化水解活性,在150 ℃以上可使CS2的水解效率达到99%以上。但活性组分的含量应该适当,过高不经济,过低会影响其催化活性。上官炬等[34]发现在30~80 ℃低温条件下K2O和Pt能够增强COS、CS2的水解催化剂的活性和稳定性,而且Pt-K2O/A12O3有最好的催化效率。汪晓梅[35]研制了1种以γ-Al2O3为载体,负载质量分数为5%~10%的铵盐(硝酸铵、氯化铵、硫酸铵和碳酸氢铵)的催化剂,对COS、CS2等有机硫的脱除效率可以达到95%以上,对于含量特别高的原料气,可以二次水解转化。
王丽等[10]在以活性炭为载体的情况下,考察了金属氧化物种类、含量、不同种类的碱金属化合物和含量4种因素对催化水解CS2的影响,最后得出水解CS2的催化剂最适宜组成为5 %Ce,14 %K2CO3(质量分数),在一定的试验条件下,其水解转化率可达到91%。
2 催化水解的反应机理和反应动力学
2.1 反应机理
相关研究显示,CS2的水解发生在催化剂的碱性位上,而COS为其水解中间体[36]。以氧化铝为催化剂,文献[37]利用傅里叶变换红外光谱(FT-IR)研究了CS2在催化剂上的吸附情况,认为CS2在催化剂碱性位上有2种可能的吸附:一种是CS2的活化吸附,CS2与催化剂上已经吸附活化的H2O反应使得部分CS2水解生成产物;另一种为解离吸附,先生成的中间产物COS,继而进一步与H2O反应生成产物。
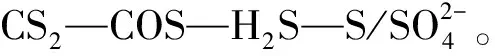
上官炬等[39]认为CS2水解是碱催化反应,弱的表面碱性中心是CS2水解活性中心,同时次弱的碱性中心也参与CS2水解。氧化铝基催化剂表面碱性中心类型、强度和数目是不同的,K2O和Pt的负载都可以改变表面碱性中心分布,提高弱碱性中心的数目和强度。由于催化剂表面能量分布不均匀,CS2催化水解在低温时存在补偿效应。邹丰楼等[40-41]针对CS2催化水解反应提出了修正的阿累尼乌斯公式,指出了补偿效应中的补偿项,对补偿效应作了解释。Tsybulevskii等[42]提出碱性是影响CS2水解的主要因素。这是因为碱是CS2水解的活性中心,随着碱质量分数的增加,CS2水解的速度随之增加[40]。张文郁等[43]指出对于CS2的水解反应,其活性明显依赖于水解催化剂的比表面积。
2.2 反应动力学
上官炬等[44]指出CS2的催化水解反应为平行连串反应,COS为其水解中间产物,但CS2直接水解成H2S占主要步骤。王丽等[10]认为CS2水解宏观历程为串联过程,从整个实验对尾气硫化合物的组分分析表明:虽然尾气中COS的浓度变化规律与CS2相同,但是COS的平衡浓度比CS2和H2S分别低2~3个数量级,这表明COS为CS2水解中间产物,且其水解生成H2S的速度远高于CS2水解生成COS的速度,意味着CS2水解生成COS是整个串联水解反应的控制步骤。王丽还利用稀土金属氧化物CeO2为活性组分,在低温(100~130 ℃)下催化水解-氧化耦合一步法脱除CS2,也得出了相同的结论。
上官炬等[34]指出,CS2的水解反应是一级反应,负载K2O和Pt在Al2O3上会降低水解反应的活化能,还可以阻止催化剂氧中毒。Huisman等[45]指出当温度低于252 ℃,水解反应对水是负级,在252~327 ℃时,对水是正级,大于等于327 ℃时,对水是零级,而CS2则不受温度的影响;且给出了127~327 ℃时CS2水解的反应速率方程:
RCS2=keEa/RTPCS2θH2O(1-θH2O)
(1)
其中,Ea为反应活化能;k为反应速率常数;R为气体常数;T为反应温度;PCS2为原料气中CS2的分压;θH2O为生成硫代碳酸盐所需水的覆盖率;1-θH2O为水阻碍CS2吸附的活性中心。
Wang等[29]是从试验中得到的催化水解-氧化耦合过程的速率方程。
(2)
其中RCS2为CS2的反应速率;kCS2为CS2的外部传质系数;cCS2为催化剂外表面CS2的浓度;cH2O为催化剂外表面水的浓度;KH2O为水的吸附常数;φ(ms)为失活函数。
王丽等[46]建立了一个以轴的色散,内、外传质阻力,催化剂内表面单质硫的沉积为基础的动力学模型,且模型结果与CS2的试验穿透曲线结果相符。
3 催化剂失活机理
水解催化剂的失活一般认为是硫沉积或硫酸盐化导致催化剂活性表面积下降所致[17]。催化剂表面碱中心的碱量和生成的硫酸盐对催化剂的活性有较大的影响[39],在催化剂表面生成的高含量的硫酸盐会降低催化剂的比表面积和CS2的水解活性[47]。
黄镕[33]认为,低温时CS2难以脱除,温度过高则水解催化剂容易发生硫酸盐化中毒。当反应温度逐渐上升时,硫酸盐生成速率随着温度增加而增加,从而导致催化剂的活性降低。当反应温度到达160 ℃时,硫酸根离子在硫的形态分布中占据了91%,严重影响了催化剂的脱硫效果。这主要是因为生成的硫酸盐导致催化剂碱量的减少,影响了CS2水解效率。Laperdrix等[20]指出,对于γ-Al2O3和TiO2这2种催化剂而言,二氧化硫的存在会急剧降低反应活性,O2也会对催化剂活性有轻微的影响,但是在加入H2S以后,即使是SO2存在的情况下,也可以阻止活性降低。在硫酸盐存在的条件下,TiO2比γ-Al2O3更容易失活,但是硫酸盐在γ-Al2O3上更容易形成。
4 技术展望
现有的各种CS2的脱除方法均存在一些不足,且各种脱硫剂的负荷都较低,而低温催化水解法和其它脱除方法相比具有能耗低、副反应少且不受气源的限制等优势,因此开发和完善低温条件下催化水解CS2的深度脱除技术势在必行。
催化剂失活的主要原因是由于硫酸盐化导致碱含量降低,降低反应温度可以克服催化剂的失活,未来CS2水解催化剂的研制将主要集中于低温(低于100 ℃)催化剂的开发,通过提高催化剂的碱性和比表面积、增加表面亲水性制备低温条件下能耗小、稳定性好、抗毒能力强和负荷高的新型CS2一步脱除水解催化剂将有广阔的应用前景。
参考文献:
[1]余春,上官炬,梁丽彤,等.TiO2和V2O5改性Al2O3催化剂催化有机硫化物水解的性能[J].石油化工,2009,38(4):384-388
[2]邱晓林.炼油厂LPG脱硫技术新进展[J].化工进展,2000,20(20):55-59
[3]王丽,吴迪镛,王树东,等.稀土氧化物CeO2脱除二硫化碳的研究[D]. 上海:中国科学院上海冶金研究所材料物理与化学博士论文,2000
[4]汪海涛,胡长江,牟玉静.二硫化碳气体近紫外吸收截面积测定[J].光谱学与光谱分析,2009,29(6):1 586-1 589
[5]金谷大.化纤行业废气的污染及治理[J].环境保护,1994,15(10):19-21
[6]王琳,张峰,宋国新,等.CS2在大气颗粒物表面上的催化氧化反应研究[J].宁夏大学学报(自然科学版),2001,22(2):169-171
[7]郭波,李春虎,谢克昌.活性炭吸附二硫化碳的红外研究[J].煤炭转化,2004,(1):54-57
[8]孔渝华,王国兴,王先厚,等.常温精脱硫工艺的新进展及其应用[J].中氮肥,1995(2):8-12
[9]贾丽丽,胡典明,孔渝华.脱除二氧化硫的研究进展[J].辽宁化工,2008,3(3):184-186
[10]王丽,李福林,吴迪镛,等.低温催化水解二硫化碳的研究[J].天然气化工,2005,30:1-5
[11]肖建华,彭勇,肖安陆.COS、CS2低、常温水解脱除技术进展[J].气体净化,2004,4(1):2-5
[12]王晓鹏.中温二硫化碳水解催化剂制备及动力学研究[D].太原:太原理工大学,2007
[13]王祥光.COS、CS2水解技术[J].小氮肥设计技术,2005,26(5):1-8
[14]RHODES C, RIDDLE S,WEST J,etal.The low-temperature hydrolysis of carbonyl sulfide and carbon disulfide:A review[J].Catalysis Today,2000,59(3):443-464
[15]王国兴,孔渝华,叶敬东,等.活性炭精脱硫剂及制备:CN,961180137 [P].1996-11-13
[16]王会娜.中温羰基硫水解催化剂制备及动力学研究[D].太原:太原理工大学,2007
[17]王会娜,上官炬,王晓鹏,等.羰基硫催化水解研究进展[J].工业催化,2007,15(2):18-21
[18]李新学,刘迎新,魏雄辉.羰基硫脱除技术[J].现代化工,2004,24(8):19-22
[19]于丽丽,唐晓龙,易红宏,等.中低温羰基硫催化水解技术研究进展[J].工业催化,2009,17(5):21-26
[20]LAPERDRIX E,JUSTIN I,COSTENTIN G,etal.Comparative study of CS2hydrolysis catalyzed by alumina and titania[J].Applied Catalysis B:Environmental,1998,17:167-173
[21]CLARK P D, DOWLING N I, HUANG M,etal.Conversion of CS2over alumina and titania under Claus process conditions:Reaction with H2O and SO2[J].Applied Catalysis B:Environmental,2001,31:107-112
[22]YUE Y,ZHAO X, HUA W,etal.Nanosized titania and zirconia as catalysts for hydrolysis of carbon disulfide[J].Applied Catalysis B:Environmental,2003,46:561-572
[23]BOULAYT A A,MAUGE F, HOGGAN P E,etal.Combined FTIR,reactivity and quantum chemistry investigation of COS hydrolysis at metal oxide surfaces used to compare hydroxyl group basicity [J].Catalysis Letter,1996,39(2):213-218
[24]BRUNELLE J,NORTIE P,QUEREME E,etal.CeO2catalytic desulfurization of industrial gases: US,4857296 [P].1989-08-15
[25]NORIVOSHI K,HARONOBU O,TAKANORI M.Temperature program med reduction studies on CeO2-containing catalysts[J].Journal of Rare Earths,2004,22:1-8
[26]王艳荣,邱克辉,邓昭平.纳米CeO2制备方法的研究进展[J].中国稀土学报,2003,21(增刊):62-66
[27]金国杰,樊惠玲,上官炬,等.活性炭对二硫化碳和水的共吸附动力学的热重研究[J].环境科学学报,1999,19(4):379-381
[28]张金昌,李学令,王树东,等.改性活性炭低温脱除COS的实验研究 [J].辽宁化工,1998,27(2):102-104
[29]WANG L, WANG S,YUAN Q,etal.Removal of carbon disulfide via coupled reactions on a bi-functional catalyst:Experimental and modeling results [J].Chemosphere,2007,69:1 689-1 694
[30]王 辉,谈世韵,郭汉贤.羰基硫在TGH催化剂的表面化学研究[J].太原工业大学学报,1991,22(3):56-61
[31]柯明,许赛威,刘成翠,等.常温羰基硫水解催化剂的研究进展[J].石油与天然气化工,2007,36(4):271-274
[32]刘伟,宣中伟,崔作林,等.氢电弧等离子体法制备纳米钛粒子脱硫性能研究[J].分子催化,2004,18(3):224-230
[33]黄镕.LYT-511氧化钛基中温有机硫水解剂的开发与应用[C].贵阳:全国气体净化信息站2006年技术交流会论文集,2006
[34]SHANGGUAN J,LI C,GUO H. Hydrolysis of carbonyl sulfide and carbon disulfide over alumina based catalysts I.Study on activities of COS and CS2hydrolysis[J].Natural Gas Chemistry, 1998, 7(1): 24-30
[35]汪晓梅.一种COS和CS2水解催化剂及其应用:CN,1704145 [P].2005-12-07
[36]赵西平.纳米氧化物与CS2催化水解和VOC光催化氧化[D].上海:复旦大学,2003
[37]郭晓汾.CS2在氧化铝基催化剂上的吸附行为和水解机理的研究 [D].太原:太原工业大学,1996
[38]王丽,李福林,吴迪镛,等.催化水解-氧化耦合一步法脱除二硫化碳的研究[J].燃料化学学报,2004,32(4):466-470
[39]上官炬,郭汉贤.氧化铝基COS、CS2水解催化剂表面碱性和催化作用[J].分子催化,1997,11(5):337-342
[40]邹丰楼,李春虎,沈芳,等.CS2水解催化剂活性与表面碱分布的研究 [J].燃料化学学报,1998,26(3):234-237
[41]邹丰楼,李春虎,郭汉贤.CS2水解催化反应动力学补偿效应[J].分子催化,1997,11(2):138-144
[42]TSYBULEVSKII A M, KAPUSTIN G I, BRUEVA T R.The nature of activity of the alumina catalysis in the reaction of carbon disulfide hydrolysis [J].Kinetics and Catalysis,1998,39(1):138-145
[43]张文郁,解秀清,孙予罕.焙烧温度对TiO2-AlO3催化剂制备的影响[J].燃料化学学报,2001,29(增刊):77-79
[44]上官炬,郭汉贤.氧化铝基催化剂上二硫化碳水解反应性的研究[J].燃烧化学学报,1997,25(3):277-283
[45]HUISMAN H M, VANDER BERG P, DILLEN A J.Hydrolysis of carbon sulfides on titania and alumina catalysts:The influence of water[J].Applied Catalysis A:General,1994,115:157-171
[46]WANG L, WANG S,YUAN Q.Removal of carbon disulfide:Experimental and modeling results[J].Fuel,2010,(87):1 716-1 720
[47]WANG L,WU DG,WANG S,etal.Coupling catalytic hydrolysis and oxidation for CS2removal[J].Journal of Environmental Sciences,2008,20:436-440

