NaBr, NaCl和KBr在几种有机溶剂中活度系数的测定
姜 波, 王利生,李弥异
(北京理工大学化工与环境学院,北京 100081)
电解质溶液的热力学性质在溶液理论和化学工程计算中有着十分重要的意义。例如:萃取蒸馏过程的设计[1],食品加工[2-3],海水的预处理[4]都需要有这些电解质溶液的有关热力学数据。其中电解质在溶液中的活度系数及其相对偏摩尔性质是溶液热力学研究的重要参数,活度系数反映了指定溶剂中离子之间及离子与溶剂分子之间的相互作用。有关活度系数数据及其相关的热力学性质的研究对离子溶剂化、离子缔合及溶液结构理论的研究具有十分重要的意义[5]。此外,在现有的文献中,有关电解质溶液的性质数据中,含水的体系数据较多,电解质在有机溶剂中的活度系数数据还很缺乏。
在测定电解质溶液活度系数时一般采用电动势法、凝固点降低法和电导法等。资料[6]中认为电动势法、凝固点降低法测量数据虽精确,误差小,但操作繁琐,其中电导法相对于其它方法来说具有仪器简单、易于操作和精确性较高等优点。本文采用电导法,在 298.15~323.15 K 温度范围内分别测定了 NaBr 在甲醇、乙醇、正丙醇和异丙醇中, NaCl和KBr在甲醇和乙醇中(物质的量的浓度在0.1 mol/L范围内)的电导率,对电导法计算活度系数的原理进行了理论推导,并利用Debye-Hücker和Osager-Falkenhangen 公式计算,并讨论了以上3种电解质在有机溶剂中的平均离子活度系数。并将试验结果与发表的文献中的数据进行对比,对电导法测定混合溶剂中电解质溶液活度系数的方法的可行性进行了论证, 讨论了温度和浓度对电解质溶液活度系数的影响。
1 理论部分
Debye-Hücker 理论是电解质溶液理论的基础,具有十分重要的理论意义。活度系数的计算采用由Debye-Hücker公式和Osager-Falkenhangen公式进行计算[7]:
(1)
对于实用的活度系数(电解质正、负离子的平均活度系数)的对数值可由式(2)得到[8]:
f±=γ±(1+0.001νmM)
lgγ±=lgf±-lg(1+0.001νmM)
lgγ±=α(λ-λ0)-lg(1+0.001νmM)
(2)
这里ν是电解质的正负离子电荷的总数,也就是ν=ν++ν-;M是溶剂的摩尔质量,g/mol;m是电解质溶液的物质的量的浓度,mol/kg。
应当指出的是,这个公式只适用于非缔合的电解质溶液,且浓度低于0.1 mol/L,其中:
(3)
相关的参数A,B1,B2分别由式(4)~(6)计算:
(4)
(5)
(6)
式(5)中的q由式(7) 计算:
(7)
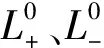
lgη=a+b/T+cT+dT2
(8)
相对介电常数ε取自相关文献[10-12]。这些数据的值均列于表1。
2 试验部分
2.1 试剂和仪器
溴化钠,上海晶纯化学试剂公司,纯度高于99.0%;氯化钠,天津福晨化学试剂公司,纯度高于99.8%;溴化钾,天津光复精细化工研究院,纯度高于99.8%;甲醇,天津四友精细化学公司;乙醇,天津福晨化学试剂公司;正丙醇,天津光复精细化工研究院;异丙醇,天津福晨化学试剂公司。以上有机溶剂均为色谱纯,纯度都高于99.9%。
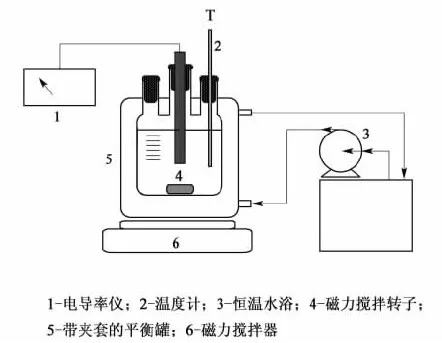
图1 电导率测定试验装置图Fig.1 Experimental apparatus for conductivity measurement
FE30型电导率仪,梅特勒-托利多(上海)有限公司);ZNWH-Ⅱ型智能恒温水浴,河南艾博特科技发展有限公司。试验装置见图1。
2.2 试验过程
所有试验中使用的盐在使用之前在烘箱中420 K下烘烤48 h。使用FE30型电导率仪测定溶液的电导率之前要使用生产厂家提供的标准液在298.15 K温度下进行标定。
测定纯有机溶剂的电导率:配置一定浓度的电解质溶液,并在磁力搅拌器上搅拌5 h,待溶质充分溶解后在恒温水浴中测量电解质溶液的电导率。
2.3 数据处理
使用电导率仪测定纯溶剂和混合溶液在不同浓度和不同温度下的电导率数值,分别列于表1中和表2中。纯溶剂的黏度与相对介电常数及相关参数A,B1,B2的值列于表1中。
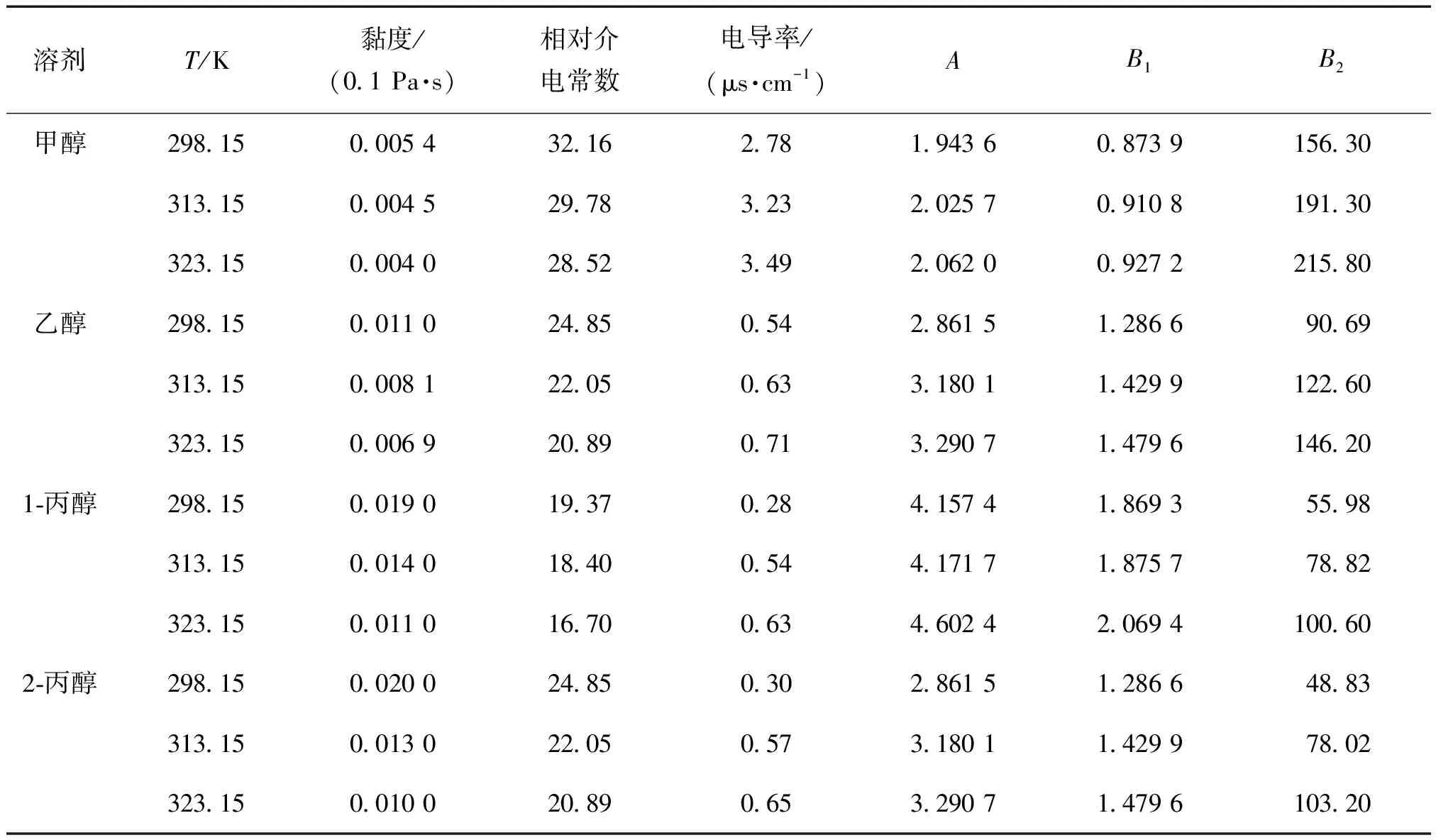
表1 有机溶剂的相对介电常数与黏度数据, 电导率的测定值及参数A, B1和B2值Tabel 1 Relative dielectric constant and viscosity of organic solvents, conductivity data and calculated parameters of A, B1, B2 at different temperatures
电解质溶液的摩尔电导率λ由式 (9) 计算。
(9)
3 结果与讨论
试验中配制一定浓度的电解质溶液时,参照了文献中相关的电解质在有机溶剂中的298.15 K的溶解度数据。NaBr在异丙醇中的溶解度只有0.012 76 mol/kg[13],这个体系在试验中配制的溶液浓度最高为0.012 69 mol/kg。NaCl在乙醇中的溶解度为0.012 49 mol/kg[14],这一体系在试验中配制的溶液浓度最高为 0.002 54 mol/kg。而 KBr 在乙醇中的溶解度为0.011 34[15],这一体系配制的最高浓度为0.006 34 mol/kg。其它体系的溶解度均大于我们要测定的浓度范围。
从表3的试验数据可见,随着温度的升高, 同一有机溶剂的介电常数降低, 黏度也降低, 这是由于温度升高,离子间的静电吸引作用增强, 离子活性减弱, 溶剂化自由离子浓度相对降低, 从而使加入电解质后形成的溶液活度系数也降低。
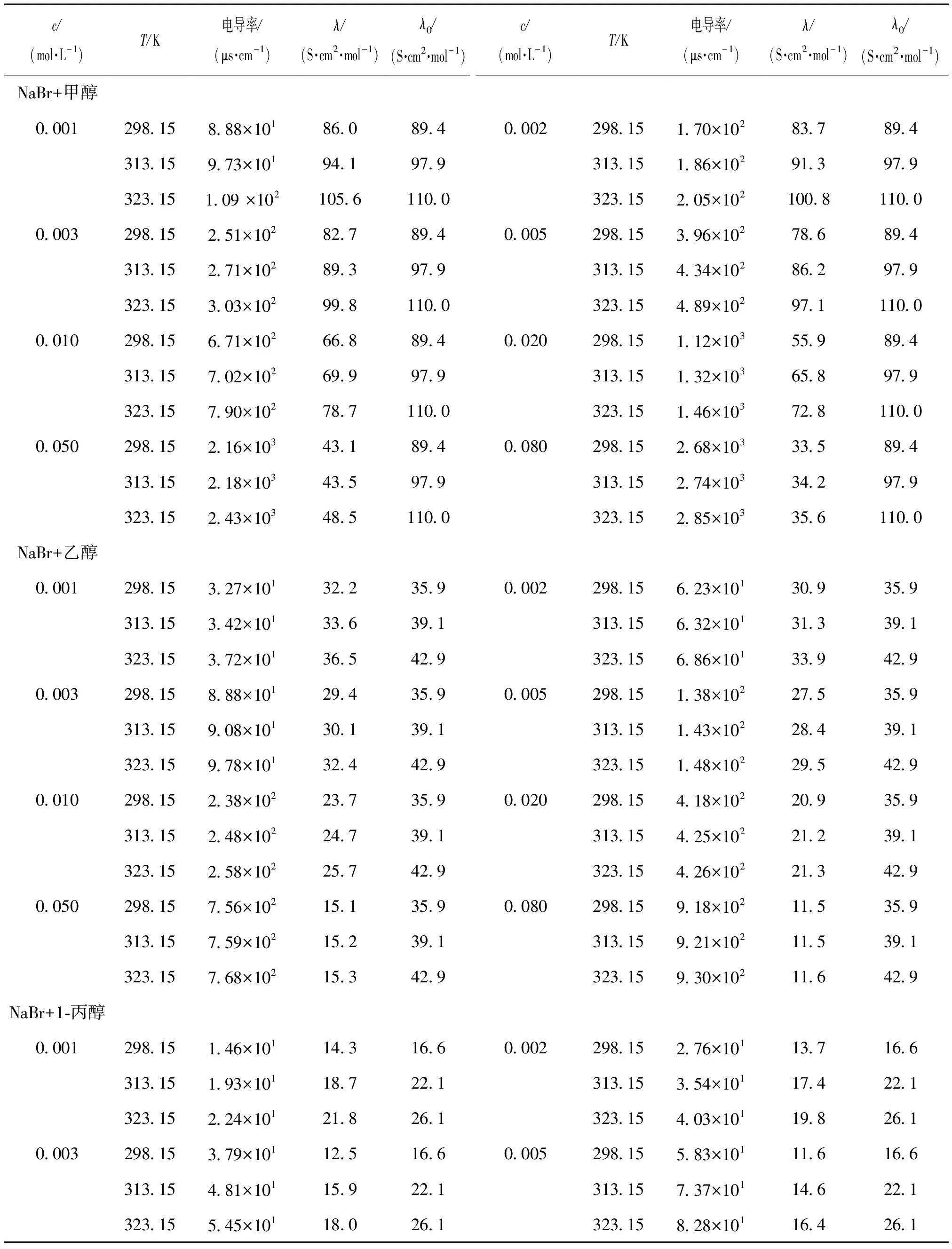
表2 不同浓度的混合溶液在不同温度下的电导率测量值及摩尔电导率和无限稀释摩尔电导率Table 2 Conductivity data of various concentrations mixed solutions, molar conductivity and infinite dilute mole conductivity of electrolytes solutions at different temperatures
续表2
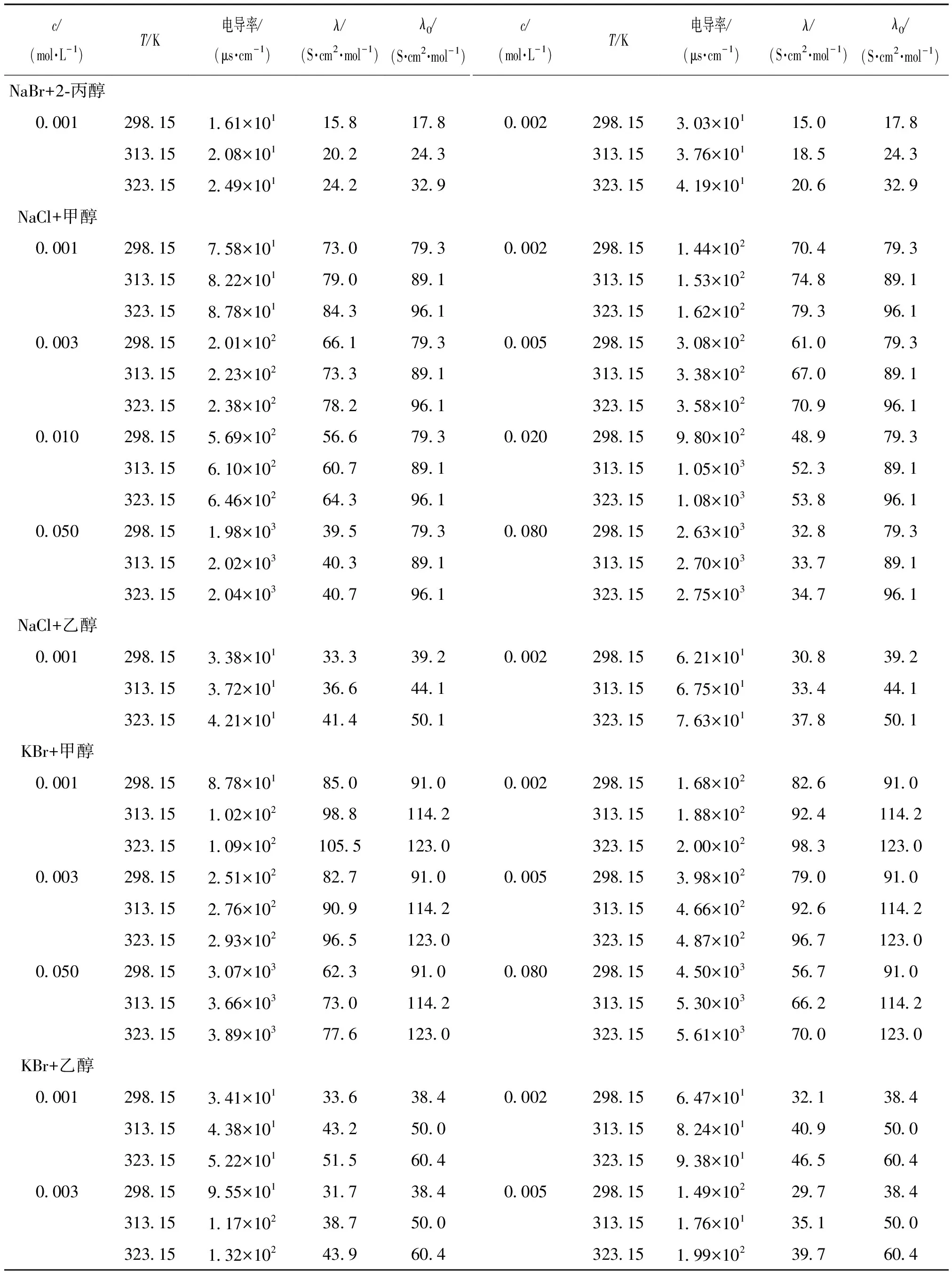
c/(mol·L-1)T/K电导率/(μs·cm-1)λ/(S·cm2·mol-1)λ0/(S·cm2·mol-1)c/(mol·L-1)T/K电导率/(μs·cm-1)λ/(S·cm2·mol-1)λ0/(S·cm2·mol-1)NaBr+2⁃丙醇000129815161×101158178000229815303×101150178 31315208×101202243 31315376×10118524332315249×10124232932315419×101206329NaCl+甲醇000129815758×101730793000229815144×102704793 31315822×101790891 31315153×102748891 32315878×101843961 32315162×102793961000329815201×102661793000529815308×102610793 31315223×102733891 31315338×102670891 32315238×102782961 32315358×102709961001029815569×102566793002029815980×102489793 31315610×102607891 31315105×103523891 32315646×102643961 32315108×103538961005029815198×103395793008029815263×103328793 31315202×103403891 31315270×10333789132315204×10340796132315275×103347961NaCl+乙醇000129815338×101333392000229815621×101308392 31315372×101366441 31315675×10133444132315421×10141450132315763×101378501KBr+甲醇000129815878×101850910000229815168×102826910 31315102×1029881142 31315188×1029241142 32315109×10210551230 32315200×1029831230000329815251×102827910000529815398×102790910 31315276×1029091142 31315466×1029261142 32315293×1029651230 32315487×1029671230005029815307×103623910008029815450×103567910 31315366×1037301142 31315530×103662114232315389×103776123032315561×1037001230KBr+乙醇000129815341×101336384000229815647×101321384 31315438×101432500 31315824×101409500 32315522×101515604 32315938×101465604000329815955×101317384000529815149×102297384 31315117×102387500 31315176×101351500 32315132×102439604 32315199×102397604
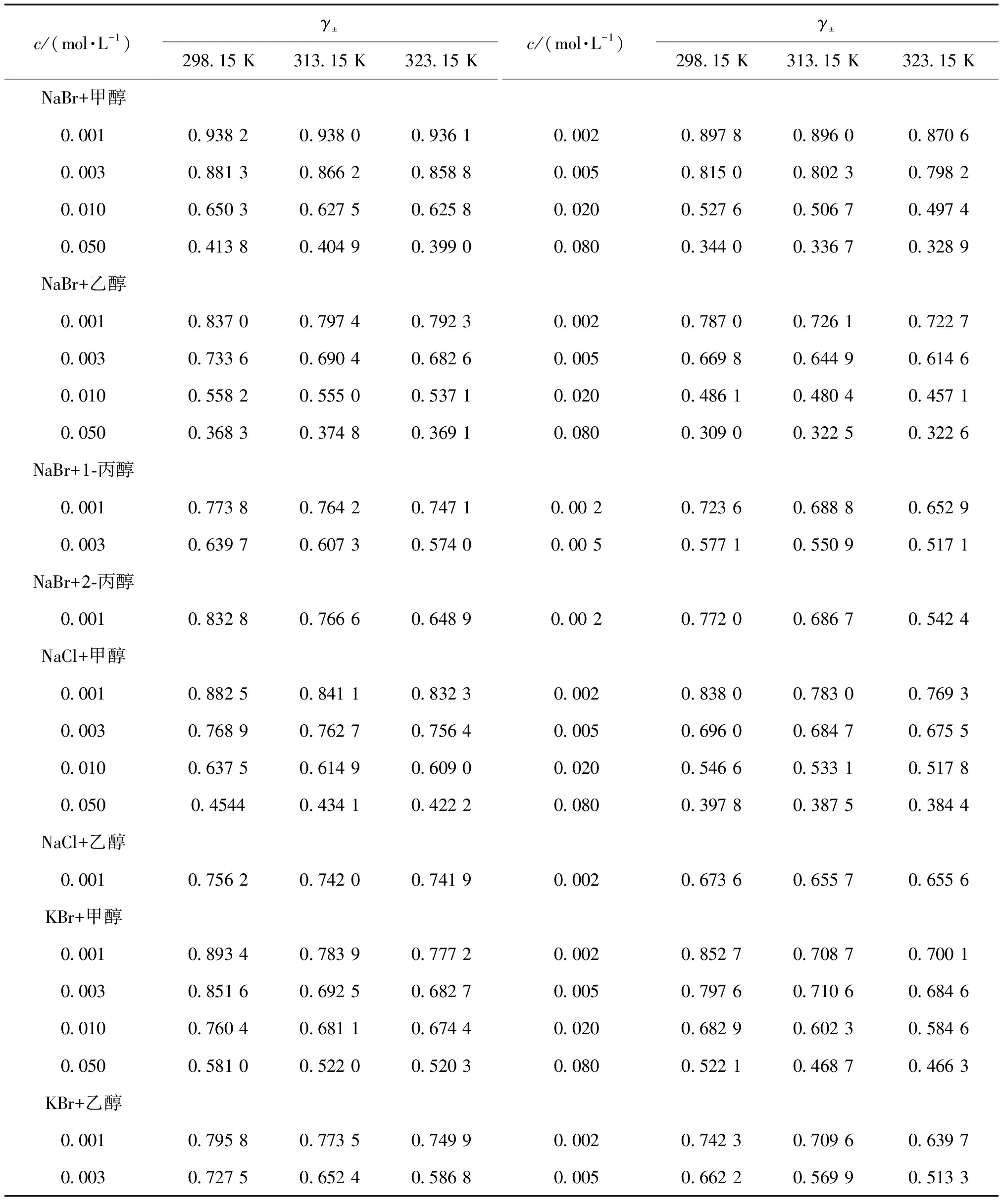
表3 不同浓度的电解质溶液在不同温度下的平均离子活度系数Table 3 The mean ion activity coefficients of electrolytes solutions of various concentrations at different temperatures
文献中关于电解质在混合溶液中的活度系数数据较多[16-21], 但电解质在纯有机溶剂中的数据较少。为了验证试验结果,选取各个体系中的 298.15 K 数据作图,并将文献[22]中的 NaCl 在甲醇中,文献[23]中的NaBr 在乙醇中,文献[24]中的KBr在甲醇中的 298.15 K 的活度系数数据分别列于图2、图3和图4中。
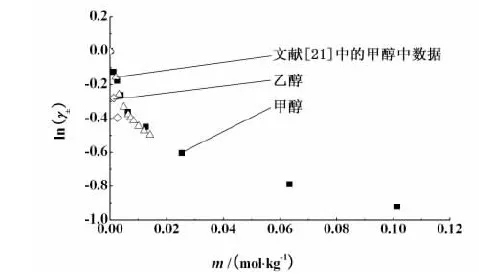
图2 298.15 K下 NaCl 在有机溶剂中的平均离子活度系数试验值Fig.2 Experimental mean ion activity coefficients of NaCl in organic solvent at 298.15 K
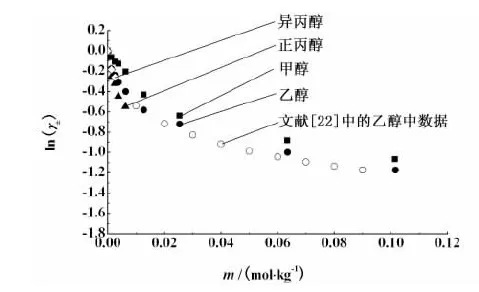
图3 298.15 K下 NaBr 在有机溶剂中的平均离子活度系数试验值Fig. 3 Experimental mean ion activity coefficients of NaBr in organic solvent at 298.15 K
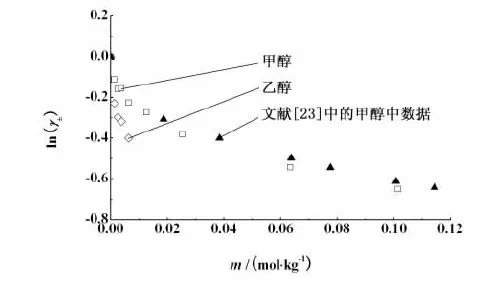
图4 298.15 K下 KBr 在有机溶剂中的平均离子活度系数试验值Fig. 4 Experimental mean ion activity coefficients of KBr in organic solvent at 298.15 K
从图2、图3和图4中可见,本试验中所得的平均离子活度系数值与文献中已有的数据吻合较好。这表明电导法测定电解质的平均离子活度系数是可行的。其它体系的活度系数数据未在文献中查到。对于同一电解质溶液体系,当温度一定时,随着溶液浓度增加,正、负离子之间静电吸引作用增强,溶剂化自由离子浓度相对降低,导致活度系数逐渐减小,即随着电解质溶液浓度的增加,活度系数降低,这个结果与试验结果相一致。此外,还可看到,对同一种电解质,在乙醇中的活度系数要低于在甲醇中的活度系数。这是由于乙醇的分子间静电吸引作用要强于甲醇的分子间作用力,因而同一种电解质在乙醇中的活度系数要低于在甲醇中的。
4 结论
采用电导法测定了几种常用的电解质在有机溶剂中的活度系数,试验数据为电解质的溶液热力学性质研究提供了基础参数。可见,只要电解质溶液浓度不是很高(低于0.1 mol/L),用电导法测出的活度系数也很准确,这说明电导法可作为一种测定电解质溶液活度系数的合适方法。
参考文献:
[1]FU J. Simulation of salt-containing extractive distillation for the system of ethanol/water/ethanediol/KAc. 2. Simulation of salt-containing extractive distillation[J]. Industry and Engineering Chemical Research, 2004, 43(5): 1 279-1 283
[2]SUCMAN E, BEDNAR J. Determination of chlorides in foods using ion selective electrodes: A review[J]. Canadian Journal of Analytical Sciences and Spectroscopy, 2002, 47: 66-71
[3]PEREZ-OLMOS R, YOLDI I, RUIZ M P,etal. Potentiometric determination of nitrite in meat products using a nitrite-selective electrode[J]. Analytical Sciences, 1998, 14: 1 001-1 003
[4]JØSSANG A, STANGE E. A new predictive activity model for aqueous salt solutions[J]. Fluid Phase Equilibrium, 2001, 181(1/2): 33-46
[5]李林尉,褚德萤,刘瑞麟. 应用离子选择性电极进行溶液热力学研究[J]. 华中师范大学学报:自然科学版,1998, 32 (2):186-191
[6]王卫东.电解质溶液活度系数的测定方法[J]. 湖北师范学院学报:自然科学版,2005, 1(1):104-106
[7]王卫东, 张云. 电导法测定HCl在H2O和DMF混合溶剂中的活度系数[J].化学通报, 2005, 68: w012
[8]黄子卿.电解质溶液理论导论[M]. 修订版.北京: 科学出版社, 1983
[9]CARL L, YAW S. Chemical Properties Handbook[M]. New York:McGraw-Hill Book Co.,1999
[10]SHIRKE R M, CHAUDHARI A, MORE N M,etal. Dielectric measurements on methyl acetate+alcohol mixtures at (288, 298, 308, and 318) K using the time domain technique[J]. Journal of Chemical Engineering Data, 2000, 45(5): 917-919
[11]ZHURAVLEV V I, DUROV V A, USACHEVA T M,etal. Dielectric properties of 1,3-propanediol and its binary-solutions with normal-propanol. I. Dielectric radiospectra[J]. Zhurnal Fizicheskoi Khimii, 1985, 59: 1 677-1 680
[12]KHIMENKO M T, LITINSKAYA V V, TKACHENKO E P,etal. Code 724 KHP-D82, 1982, 1-15
[13]LARSON R G, HUNT H. Molecular forces and solvent power[J]. Journal of Physical Chemistry, 1939, 43(4): 417-423
[14]PLYUSHCHEV V E, SHAKHNO I V, KOMISSAROVA L N,etal. Study of solubility of alkali metal chlorides in some aliphatic alcohols[J]. Trudy Moskovskogo Instituta Tonkoj Khimiiy Technologii, 1958, 7: 45
[15]PINHO S P, MACEDO E A. Experimental measurement and modeling of KBr solubility in water, methanol, ethanol, and its binary mixed solvents at different temperatures[J]. Journal of Chemical Thermodynamic, 2002, 34(3): 337-360
[16]LOPES A, FARELO F, FERRA M I A. Activity coefficients of sodium chloride in water-ethanol mixtures: A comparative study of Pitzer and Pitzer-Simonson models[J]. Journal of Solution Chemistry, 2001, 30(9): 757-770
[17]LOPES A, SANTOS J, FARELO F,etal. Mean activity coefficients of sodium chloride in water-ethanol solvents at 25℃[J]. Portugaliae Electrochimica Acta, 1999, 17, (2/3): 201-208
[18]ZUO Y X, FüRST W. Use of an electrolyte equation of state for the calculation of vapor-liquid equilibria and mean activity coefficients in mixed solvent electrolyte systems[J]. Fluid Phase Equilibrium, 1998, 150/151: 267-275
[19]YANG R, DEMIRGLAN J, SOLSKY J F,etal. Mean molar activity of NaCl, KCl and CsCl in ethanol-water mixtures[J]. The Journal of Physical Chemistry, 1979, 83, (21): 2 752-2 761
[20]ZHUO K L, YAN W D, WANG W H,etal. Activity coefficients of individual ions in aqueous solutions of sodium halides at 298.15K[J]. Fluid Phase Equilibrium, 2008, 274: 80-84
[21]BOUKHALFA N, MéNIAI A H. Activity coefficients for salts in water-methanol mixed solvent solutions[J]. Desalination, 2007, 206: 380-393
[22]YAN W, XU Y, HAN S. Activity coefficients of sodium chloride in methanol-water mixed solvents at 298.15 K[J]. Acta Chimica Sin, 1994, 52: 937-946
[23]GONZáLEZ-DíAZ O M, FERNáNDEZ-MéRIDA L, HERNáNDEZ-LUIS F,etal. Activity coefficients for NaBr in ethanol-water mixtures at 25℃[J]. Journal of Solution Chemistry, 1995, 24(6): 551-563
[24]KOLHAPURKAR R R, PATIL P K, DAGADE D Hetal. Studies of thermodynamic properties of binary and ternary methanolic solutions containing KBr and 18-crown-6 at 298.15K[J]. Journal of Solution Chemistry, 2006, 35: 1 357-1 376

