4,9-二[N-(2-二甲氨基)乙基]-9-吖啶胺-4-甲酰胺与蛋白质相互作用
张丽娟
(福建生物工程职业技术学院药学系,福建 福州 350002)
有关蛋白质的研究是目前生命科学和化学领域中一个十分活跃的课题[1-2]。寻找新的、无毒害无污染、发光强度高和选择性强的荧光探针则是目前国内外对蛋白质研究的重要方向。吖啶-4-酰胺衍生物探针在国内外的应用研究较少,开展这方面的研究对于拓展吖啶类荧光探针的应用范围,开发性能更优良的生物大分子荧光探针具有重要意义。在9-氯吖啶-4-甲酰氯的基础上,同时在4位、9位上引入2个N-(2-二甲氨乙基)取代基,合成了具有生物活性的4,9-二[N-(2-二甲氨基)乙基]-9-吖啶胺-4-甲酰胺(简写DNAF)。DNAF做为一种新的荧光探针,具有良好亲水性和荧光产率;此外,其不含氨基羧基等酸碱基团,在酸性体系中,2个N-(2-二甲氨乙基)取代基具有更高的正电荷,环境酸碱度变化对其影响降低。
探索了DNAF对蛋白质内源荧光猝灭的猝灭机制,并通过荧光猝灭试验,研究了DNAF与牛血清白蛋白(简写BSA)的结合作用机理。
1 仪器与试剂
Varian Cary Eclipse 荧光光谱仪(美国VARIAN);Perkin-Elmer Lambda 800 紫外-可见分光光度计(美国);PHS-3C型酸度计(上海大普仪器有限公司)。
DNAF由实验室自制,配成3.0×10-4mol/L和1.5×10-4mol/L的储备液,4 ℃条件下避光保存;牛血清白蛋白(BSA)(Sanland-chem Internation Inc.)配成含0.1 mol/L NaCl的1.0×10-4mol/L的储备液,存于4 ℃避光条件下;Tris-HCl 缓冲溶液(pH值为7.0)。所用试剂均为生化纯与分析纯,试验用水均为二次去离子水。
2 试验方法
在一系列5 mL刻度试管中加入pH值为7.0的Tris-HCl缓冲溶液2.0 mL,0.5 mL BSA(1.0×10-4mol/L)溶液,不同体积的DNAF(3.0×10-4mol/L)溶液,用水稀释至刻度,摇匀,分别在不同温度下,测定BSA的荧光光谱。激发波长280 nm,发射波长290~500 nm,狭缝宽度均为5 nm。
3 结果与讨论
3.1 DNAF对BSA荧光猝灭的机理
为了阐明给体BSA的猝灭机理,固定c(BSA) 为1.0×10-5mol/L,λex为280 nm,pH值为7.0,分别在12、24和36 ℃下,测定DNAF-BSA体系的荧光光谱。以F0/F为纵坐标,c为横坐标作Stern-Volmer图,见图1。以(F0-F)-1为纵坐标,c-1为横坐标作Lineweaver-Burk图,见图2。

图1 不同温度条件下BSA与DNAF作用的Stern-Volmer曲线Fig.1 The Stern-Volmer curves of BSA quenched by DNAF at different temperature
由图1可以看出,随着温度的上升,BSA猝灭曲线斜率降低,初步判断可能为静态猝灭。
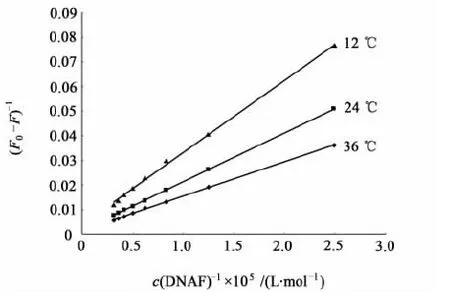
图2 不同温度条件下BSA-DNAF作用Lineweaver-Burk曲线Fig.2 The Lineweaver-Burk curves of BSA-DNAF at different temperature
为了进一步证实此猝灭过程,利用方程式(1),将此过程按动态猝灭过程处理。
F0/F=1+Kqτ0[Q]=1+Ksv[Q]
(1)
式中,F0、F分别为猝灭剂不存在、存在时的荧光强度;Kq为双分子猝灭过程速率常数,L/(mol·s);Ksv为动态猝灭常数,L/mol;τ0为猝灭剂不存在时荧光分子平均寿命,s;[Q]为猝灭剂浓度,mol/L。
荧光分子的平均寿命τ0约为10-8s[3],故由猝灭曲线斜率可求得12、24和36 ℃时Kq见表1。
由表1可知,Kq值大于各类猝灭剂对分子的最大扩散碰撞猝灭常数2.0×1010L/(mol·s)[4],因此原假设不成立,猝灭不是由动态猝灭过程引起的,而是静态猝灭过程。利用静态猝灭公式(2):

表1 BSA与DNAF在不同温度条件下作用的结果[按式(1)]Table 1 Experiment results of BSA quenched by DNAF at different temperature(according to eq(1))
1/(F0-F)=1/F0+KD/F0[Q]
(2)
作不同温度下的Lineweaver-Burk曲线(见图2),由直线斜率求得BSA与DNAF在12、24和36 ℃时的解离常数KD,结果见表2。

表2 BSA与DNAF在不同温度条件下作用的结果[按式(2)]Table 2 Experiment results of BSA quenched by DNAF at different temperature(according to eq(2))
由表2可见温度对猝灭的影响不大,说明BSA与DNAF有较强的结合。
3.2 DNAF与BSA作用的结合常数和结合位点数
图3为15 ℃时在牛血清白蛋白溶液体系中,随着DNAF浓度的增加,BSA的荧光猝灭谱图。343 nm处为BSA的荧光猝灭情况,451 nm处为在BSA作用下的不同浓度的DNAF的荧光增强情况,c(DNAF)从1到9对应的浓度分别为0、0.4×10-5、0.8×10-5、1.2×10-5、1.6×10-5、2.0×10-5、2.4×10-5、2.8×10-5和3.2×10-5mol/L,c(BSA)为1.0×10-5mol/L。
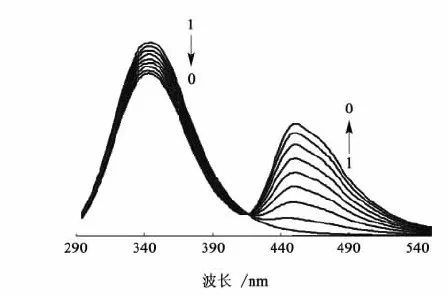
图3 溶液中BSA与DNAF相互作用的荧光光谱Fig. 3 Fluorescence spectra of interaction between BSA and DNAF in aqueous solution
(3)
由343 nm处的试验数据进一步应用公式(3)处理,得到图4。
随着大数据的广泛应用,数据挖掘对于电子商务的发展也起着很大影响,利用数据挖掘技术,可以有效的提高用户访问数量,优化网站访问效率,挖掘潜在用户、优化出售商品性能和提高网站安全环境等级等作用。

图4 lg[(F0-F)/F]对lg[Q]作图Fig.4 The plot of lg[(F0-F)/F] versus lg[Q]
从图4可以看出,在DNAF由低到高的整个浓度范围都呈现良好的线性,与公式(3)吻合良好,表明这一过程属于静态猝灭过程。由所得的直线求算出DNAF与BSA结合时的结合常数KA=5.46×103,结合位点数n为0.98。可见DNAF与BSA可发生相互作用,且结合作用较强。
3.3 DNAF与蛋白质的主要结合力的确定
在(24±2) ℃下测定BSA的荧光光谱,当温度变化不大时,反应焓变可以看作是一个常数。根据公式(4)和(5):
ln (KA2/KA1)=(1/T1-1/T2)ΔH/R
(4)
ΔG=-RTlnKA=ΔH-TΔS
(5)
可求出24 ℃时DNAF焓变ΔH为-30.35 kJ/mol;熵变ΔS为-30.77 J/(mol·K);反应自由能变ΔG为-21.21 kJ/mol。由于ΔH<0,ΔS<0,根据热力学参数与作用力的关系,可知DNAF与BSA结合的作用力类型主要是氢键与范德华力。
3.4 BSA与DNAF间的能量转移和结合距离
在一系列5 mL刻度试管中加入pH值为7.0的 Tris-HCl缓冲溶液2.0 mL,空白组加入0.5 mL的BSA(1.0×10-4mol/L)溶液,对照组加入0.5 mL的BSA(1.0×10-4mol/L)溶液及0.33 mL的DNAF(1.5×10-4mol/L)溶液,使二者物质的量之比为1:1。用水稀释至刻度,摇匀,在15 ℃下测定空白组和对照组的荧光光谱,测定对照组的紫外吸收光谱。
通过上述的试验中测定猝灭速率常数的结果,在广泛的温度范围内猝灭速率常数Kq值处于1011L/(mol·s)数量级。图5为n(BSA):n(DNAF)为1:1,c(BSA)为1.0×10-5mol/L,c(DNAF)为1.0×10-5mol/L时体系的吸收谱和相同浓度的BSA的荧光发射谱的重叠光谱图。

图5 荧光发射光谱与紫外吸收光谱的谱图重叠Fig.5 Overlap of the fluorescence emission spectra and absorption spectra
BSA的吸收光谱与发射光谱有相当重叠面积,求得该图中光谱重叠部分(285~500 nm)的积分面积J为9.73×10-14(cm3·L)/mol,初步判定为遵循Förster非辐射能量转移机制[5]。BSA分子中在134和212位处有2个色氨酸残基,BSA荧光(λem=335 nm)主要来自于第212位的色氨酸残基。在上述试验条件下,偶极空间取向因子K2可取受供能体各向随机分布的平均值2/3[6],供能体荧光量子产率Φ通常取蛋白质中色氨酸的量子产率0.118[7],介质折射指数N一般取水和有机物折射指数的平均值1.336[8]。据公式(6)和(7),可计算相关信息。
式中,R0为临界距离,nm;K2为偶极空间取向因子;N为介质的折射指数;Φ为授体的光量子效率;J为授体(蛋白质)荧光发射光谱与受体(染料)吸收光谱间的光谱重叠积分,cm3·L/mol;E为能量转移效率;r为授体-受体间距离,nm。
分别求得临界距离R0为3.58 nm;能量转移效率E为0.12;从而求出BSA中第212位色氨酸残基与DNAF分子间的距离r为4.99 nm。
4 结论
利用合成的一种新型的蛋白质分子荧光探针DNAF,对其与BSA的相互作用进行了研究。得知DNAF对BSA的荧光猝灭为静态猝灭机制,测定了相应的热力学参数ΔH为-30.35 kJ/mol,ΔG为-21.21 kJ/mol,ΔS为-30.77 J/(mol·K),结合位点数n为0.98及表观结合常数KA为5.46×103,计算了供体BSA和受体DNAF的距离r为4.99 nm,能量转移效率E为0.12。证明氢键作用和范德华力对两者结合起到重要作用,DNAF与BSA的能量转移机制符合Förster非辐射能量转移理论。
参考文献:
[1]王夔,邰子厚,徐辉碧. 生物无机化学[M]. 北京:清华大学出版社,1988
[2]KRAGH H U. Molecular aspects of ligand binding to serum album[J]. Pharmacol Review, 1981,33(1): 17-53
[3]易平贵,刘俊峰,陈安国. 荧光法研究吖啶橙与牛血清白蛋白结合作用的机理[J]. 湘潭矿业学院学报,2000,15(4):56-59
[4]杨频,高飞. 生物无机化学原理[M]. 北京:科学出版社,2002
[5]LAKOWICZ R J. Principles of Fluorescence Spectroscopy[M]. New York:Plenum Press, 1983
[6]CALTAGIRONE S, ROSSI C, POGGI A,etal. Flavonoids apigenin and quercet in inhibit melanoma growth and metastatic potential[J]. Int J Cancer, 2000, 87: 595-600
[7]CYRIL L,EARL J K,SPERRY W M.Biochemists Handbook[M].London:E & FN Epon Led Press,1961
[8]YANG P, YANG M, YANG B. Fluorescence enhancement effect and the interaction between donor and acceptor[J]. Chinese J Chem, 1996, 14(2): 109-113

