小鼠全脑缺血再灌注模型的制备及评价
陈远寿 陈 旻 张 弛 (遵义医学院生理教研室,贵州 遵义 563003)
脑血管疾病是严重危害人类健康的三大疾病之一,具有高发病率、高致残率和高死亡率的特点,是中老年人致死和致残的主要疾病〔1〕。由于小鼠体重差异小,其脑缺血更接近于人类脑供血不足或脑梗死再灌时脑组织病理生理演变过程〔2〕,故小鼠脑缺血模型是研究脑梗死后神经细胞死亡、神经功能修复及药物保护作用的实验基础。并且转基因小鼠目前在脑缺血研究中的作用日趋重要,因此建立一种稳定的小鼠脑缺血再灌注模型极其重要。为此,本文以C57BL/6小鼠为研究对象,采用双侧颈总动脉和基底动脉三血管阻塞的方法制备全脑缺血模型,观察不同缺血时间和不同再灌注时间对小鼠脑损伤的影响,以探讨该模型的制备及评价方法。
1 材料与方法
1.1 实验动物及其分组 84只雄性 C57BL/6小鼠,体重 20~25 g(由中国科学院上海斯莱克实验动物中心提供),随机分为假手术对照组(sham组)和脑缺血/再灌注组(I/R组),缺血时间分为 8、12、16min三个时间组(再灌注 3 d),缺血 12 min后再灌注分为 6 h、3、7、28d四个时间点观察。
1.2 小鼠全脑缺血/再灌注模型的制作 采用三血管(两侧颈总动脉 +基底动脉)阻塞法(3-VO)。小鼠称重后用 10%水合氯醛(300 mg/kg),腹腔注射(i.p.)麻醉,再给阿托品(0.25 mg/kg,i.p.)。将小鼠固定于自制的垫有发热毯的小鼠固定板上,用直肠体温计监测小鼠体温并维持在 37℃左右,颈部正中切口约 2~3cm,在解剖显微镜下分离出两侧颈总动脉并穿线备用,从气管和食管左侧旁向下剥离至寰枕关节膜,暴露出硬脑膜和蛛网膜,并用 1 ml注射器针尖将其剥离,切断蛛网膜骨小梁,暴露并从脑干表面游离出基底动脉,然后用微型动脉夹(用直径为 0.2 mm的不锈钢钢丝制作而成,日本东京FUJITA医疗器械有限责任公司定制)夹闭基底动脉,在解剖显微镜下可肉眼证实基底动脉血流被阻断,再用小动脉夹夹闭双侧颈总动脉后开始计时,造成小鼠全脑缺血到相应时间点后,松开动脉夹恢复脑血供(在显微镜下肉眼证实),缝合切口后予卡那霉素(20 mg/kg,i.p.),把小鼠放进 30℃的恒温保育箱,进行再灌注到相应时间点,期间应监测小鼠体温的变化情况。Sham组小鼠进行同样的手术处理,但不进行三血管栓塞。手术中如果小鼠呼吸障碍,可用小动物呼吸机维持其自主呼吸。
1.3 样本取材 脑I/R后各时间点动物予10%水合氯醛i.p.麻醉后,用 4℃ 0.9%生理盐水和 4%多聚甲醛灌注固定,迅速取脑后固定 4 h(4℃),分别置于 15%和 30%蔗糖脱水直至脑组织沉底(4℃)。海马行冰冻连续冠状切片(20μm)(德国莱卡冰冻切片机)。
1.4 Fluoro-Jade B(F-JB)法染色 取冰冻切片,浸入 100%乙醇5 min,70%乙醇2 min,dd H2O 2 min,0.06%KMnO415 min,ddH2O 1 min,避光下 0.000 5%F-JB储液 20 min(美国 Histo-Chem公司),双蒸水(ddH2O)1 min×3次室温干燥,二甲苯透明胶(DPX)封片。荧光显微镜(日本Nikon公司)下观察海马神经元细胞变性死亡情况。
1.5 尼氏染色 取冰冻切片,浸入 1∶1乙醇和氯仿溶液中30 min,梯度酒精(100%,95%,80%,70%,60%,50%)水化,蒸馏水冲洗后用甲酚紫染液浸染 30 min,蒸馏水洗,用梯度酒精(50%,60%,70%,80%,95%,100%)脱水,二甲苯透明(2×5 min),DPX封片,显微镜明场下观察海马神经元形态学变化。各组选取切片 8张,在显微镜下对海马各区存活神经元计数,并在分化目镜下测量海马相应区域的长度,按平均每0.2 mm2存活神经元数记录分析。
2 结 果
2.1 模型制备的难点和成功率 在克服了手术过程中游离与夹闭基底动脉时导致破裂出血和小鼠呼吸道阻塞引起通气功能障碍等技术难点后,最后缺血 12 min再灌注 3d后模型的成功率为 76.5%,但再灌注 28 d后减少到 50.2%;缺血 8min再灌注 3 d后模型的成功率为 88.7%,缺血 16 min再灌注 3 d后模型的成功率为 56.5%。
2.2 不同缺血时间再灌注 3 d对海马神经元损伤的影响sham组大鼠海马神经元未见 F-JB阳性细胞,脑缺血 8 min再灌注 3 d后海马 CA 1区神经元出现少量 F-JB阳性细胞,表明CA1区神经元出现迟发性变性死亡;缺血 12和 16 min后 CA 1区神经元变性死亡增多,定量分析显示CA1区神经元存活数量与 sham组比较显著减少(P<0.01),同时 CA 3、DG神经元存活数量与 sham组比较也明显减少(P<0.01)。见图 1、图 2。

图1 不同缺血时间再灌注 3d后对海马神经元损伤情况的染色评价
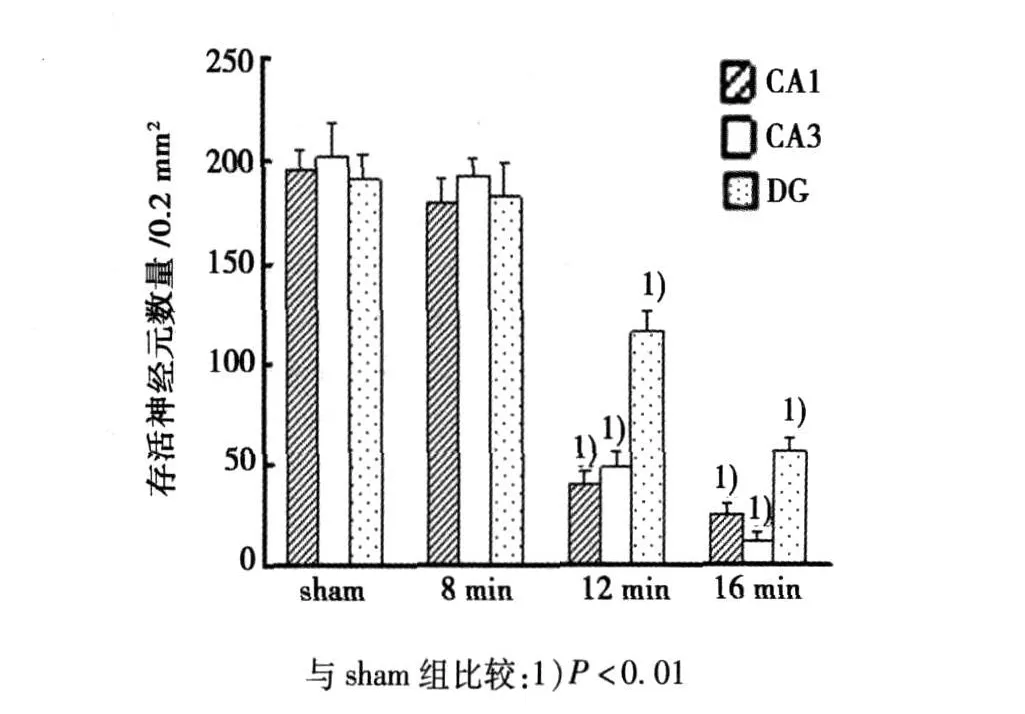
图2 不同缺血时间再灌注 3d后海马各区神经元存活数量的定量分析
2.3 缺血 12 min后不同的再灌注时间对海马神经元损伤的影响 与sham组比较,再灌注 6h后海马各区存活的神经元数量无明显差异,再灌注 3、7、28 d后可见 CA1、CA3、DG区存活的神经元数量显著减少(P<0.01)。见图 3、图 4。

图3 缺血 12min后不同的再灌注时间点海马神经元的尼式染色

图4 缺血 12 min后不同的再灌注时间海马各区神经元存活数量的定量分析
2.4 缺血再灌注对其他脑区神经元损伤的影响 F-JB荧光染色结果显示,缺血 12 min再灌注 3 d后,在小鼠大脑皮层、丘脑、纹状体均可见F-JB荧光染色阳性细胞,表明这些脑区有神经元死亡。见图 5。
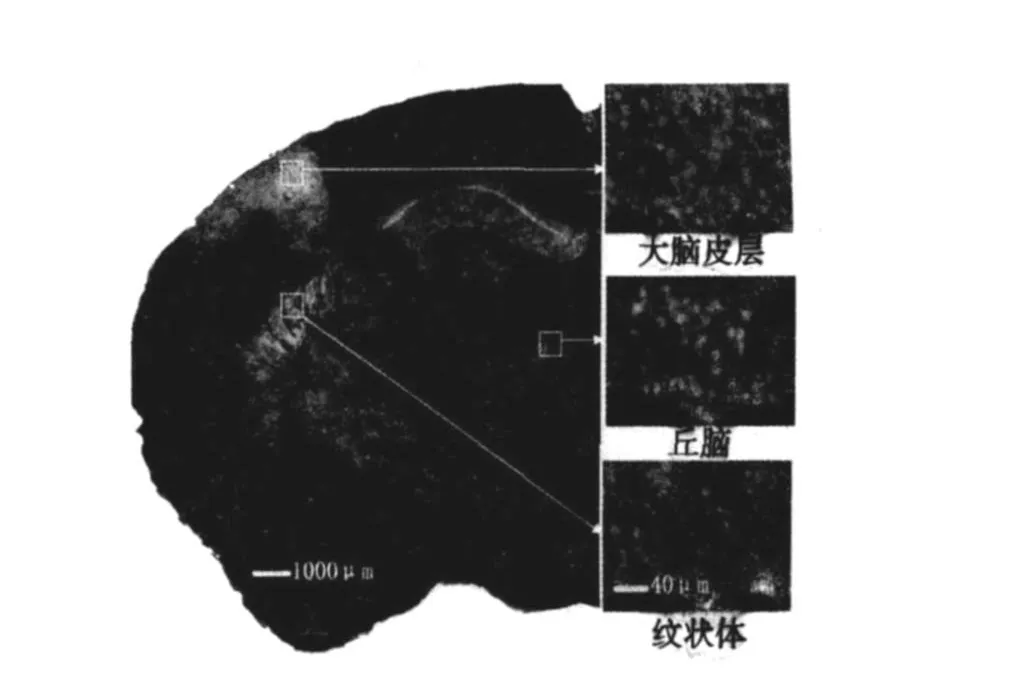
图5 全脑缺血引起的小鼠其他脑区神经元损伤(F-JB染色)
3 讨 论
短暂性脑缺血再灌注可导致脑易感区选择性迟发性神经元损害,以海马 CA1区最为敏感〔3,4〕,很多学者都以海马 CA1区神经元损伤作为模型,试图研究脑缺血的病理生理机制,以往多采用大鼠作为研究对象。近年来,随着基因工程的发展,转基因小鼠被广泛用于各种脑缺血损伤机制的研究,C57BL/6、129X 1/SvJ、Balb/C小鼠是转基因小鼠常用的母系小鼠,为脑缺血研究提供很好的工具。目前多采用小鼠大脑中动脉阻塞(MCAO)和双侧颈总动脉夹闭(2-VO)缺血模型用于实验研究。本实验应用改良的三血管夹闭(两侧颈总动脉和基底动脉)复制 C57BL/6小鼠全脑缺血模型,观察了不同缺血时间和不同再灌注时间对小鼠脑损伤的影响,为小鼠在脑缺血研究中提供一种较好的模型。
本实验研究结果显示,脑缺血 8 min再灌注 3 d后海马CA1区神经元出现了迟发性变性死亡;缺血 12 min和 16 min后 CA1区神经元变性死亡明显增多,同时CA 3、DG区神经元也出现大量死亡,与文献报道一致〔5,6〕。提示,随着缺血时间延长,海马神经元损伤程度逐渐加重。
各种脑缺血实验研究表明,脑缺血一定时间后再灌注2~28 d期间,首先在海马 CA 1区出现神经元选择性迟发性死亡〔5,7〕,随着再灌注时间延长,在海马的其他区域如 CA 2、CA 3、DG区相继出现不同程度的神经元死亡,并且在大脑皮层、丘脑等其他脑区也有神经元的死亡〔5〕。本研究也显示,小鼠全脑缺血 12min后,再灌注 3、7、28 d三个时间点,主要引起 CA1区神经元迟发性死亡,同时 CA3、DG区以及其他脑区(大脑皮层、丘脑和纹状体)也有不同程度的神经元死亡。结果补充了已往的研究,同时也说明本实验建立的 3-VO全脑缺血模型的可靠性和稳定性,证明该模型的复制是成功的,该模型是研究脑梗死后神经细胞死亡、神经功能修复和药物保护作用,以及小鼠基因操作的较为理想的模型。
1 吴占福,黄瑞英.脑血管疾病的危险因素及预防〔J〕.中国老年学杂志,2009;29(22):2968-71.
2 马 丛,王 蕾 .小鼠脑缺血再灌注模型方法及中药的药理作用〔J〕.中华中医药学刊,2008;26(2):280-2.
3 Chen M,Chen Q,Cheng XW,et al.Zn2+mediates ischemia-induced impairment of theubiquitin-proteasomesystem in the rat hippocampus〔J〕.J Neurochem,2009;111(5):1094-103.
4 Ito Y,Ohkubo T,Asano Y,et al.Nitric oxide production during cerebral ischemia and reperfusion in eNOS-and nNOS-knockout mice〔J〕.Curr Neurovasc Res,2010;7(1):23-31.
5 Yonekura I,Kawahara N,Nakatomi H,et al.A model of global cerebral ischemia in C57 BL/6 mice〔J〕.J Cereb Blood Flow Metab,2004;24(2):151-8.
6 Wei G,DoréS.Importance of normothermia control in investigating delayed neuronal injury in a mouse global ischemia model〔J〕.J Neurosci Methods,2010;185(2):230-5.
7 Kumaran D,Udayabanu M,Nair RU,et al.Benzamide protects delayed neuronal death and behavioural impairment in a mouse model of global cerebral ischemia〔J〕.Behav Brain Res,2008;192(2):178-84.

