米发糕储藏过程中微生物分析
陈芳溶,徐晓云,张 敏,潘思轶,李秀娟
米发糕储藏过程中微生物分析
陈芳溶,徐晓云,张 敏,潘思轶,李秀娟*
(华中农业大学食品科学技术学院,湖北 武汉 430070)
米发糕是中国传统发酵食品,在我国尤其是南方地区颇受消费者欢迎。本实验利用16S rDNA基因序列的PCR扩增技术对米发糕在室温储藏过程分离出的菌株进行鉴定。结果表明:细菌是致使米发糕迅速腐败的主要因素,分离出的3株菌经鉴定分别为发酵乳杆菌、巴氏葡萄球菌和蜡样芽胞杆菌。对米发糕腐败菌的菌相变化进行分析,确定乳杆菌和芽孢杆菌是米发糕储藏过程中的优势腐败菌,且都随着时间的延长呈明显上升趋势。
米发糕;微生物;分离;鉴定;优势腐败菌
米发糕是中国的传统大米发酵食品,主要以籼米为原料,经浸泡、磨浆、发酵并汽蒸而成[1]。由于其特殊的风味及松软的口感,在中国尤其是南方地区颇受消费者喜爱。但由于微生物引起的腐败变质和淀粉的回生,使其货架期短,长期以来都只能现做现卖。其中影响米发糕货架期的主要因素是微生物引起的腐败变质[2],目前尚无相关研究报道,故研究储藏中的微生物变化对其产品的开发和利用具有重要意义。本研究对影响米发糕腐败变质的主要微生物进行了分析,并对分离出的细菌进行菌种鉴定以确定其优势腐败菌,为建立有效的防腐措施和延长货架期提供参考。目前菌种分类鉴别通常采用形态特征、培养特征观察与核酸序列测定相结合的方法。其中相当有效的是采用PCR扩增16S rDNA进行序列分析[3],并与16S rDNA数据库中的序列数据比较,以鉴定样本中存在的微生物种类[4]。这为未知菌的鉴定及微生物的系统发育提供了一种较好的方法[5],目前在细菌遗传多样性及菌种鉴别的研究中已得到广泛的应用[6-8]。
1 材料与方法
1.1 材料与试剂
早籼米 市售。
dNTPs、10×Buffer、MgCl2、Taq DNA聚合酶生工生物工程(上海)有限公司;DNA Marker TaKaRa生物工程有限公司。
1.2 仪器与设备
JL-100型电动多用磨浆机 重庆市友昌机械制造有限责任公司;DYY-6B型稳压稳流电泳仪 北京市六一仪器厂;PE9600型PCR仪 美国PE公司;Gel-Logic200凝胶扫描成像系统 美国柯达公司;B203型生物显微镜重庆奥特光学仪器有限公司。
1.3 培养基[9-10]
营养琼脂、月桂基硫酸盐胰蛋白胨(LST)肉汤 青岛海博生物技术有限公司。
PCA平板计数琼脂培养基:胰蛋白胨5g、酵母浸出物2.5g、葡萄糖1g、琼脂15g,蒸馏水l000mL,调pH7.0,121℃灭菌15min。
孟加拉红培养基:蛋白胨5g、葡萄糖10g、磷酸二氢钾1g、硫酸镁(MgSO4·7H2O) 0.5g、琼脂20g,1/3000孟加拉红溶液100mL、蒸馏水1000mL、氯霉素0.1g。121℃灭菌20min。
MRS琼脂:蛋白胨10g、牛肉膏10g、酵母提出物5g、磷酸氢二钾2g、柠檬酸按2g、乙酸钠5g、葡萄糖20g、吐温-80 lmL、硫酸镁0.58g、硫酸锰0.25g、琼脂15g,蒸馏水l000mL,调 pH6.2~6.4,121℃灭菌15min。
锰盐营养琼脂:胰蛋白胨10g、硫酸锰0.0308g、琼脂20g、牛肉膏3g、氯化钠5g,蒸馏水1000mL,调pH7.2~7.4,12l℃灭菌15min。
MSA-甘露醇高盐琼脂培养基:牛肉膏1g、蛋白胨 10g、D-甘露醇10g、氯化钠75g、酚红0.025g,蒸馏水1000mL。调pH7.4,121℃灭菌15min。
1.4 米发糕制作工艺

其中:磨浆(米-水质量比1:0.8);米浆-发酵菌种质量比1:0.05,菌种从米发糕老浆中分离培养、优化得到;发酵温度34℃发酵4h,汽蒸时间15min。
1.5 米发糕贮藏中微生物分析
1.5.1 样品
米发糕蒸制成熟后,用保鲜膜包好,25℃恒温储存,于0、2、4、6、8、1 0、1 2 d分别取样,进行细菌总数、大肠菌群和霉菌总数的测定。
1.5.2 细菌、大肠菌群及霉菌总数测定
无菌条件下准确称取25g样品,加入225mL、0.85%灭菌生理盐水中,振荡均匀后,即成10-1的稀释液,然后依次10倍递增稀释成所需的浓度梯度。每个平皿接入lmL菌悬液,然后分别倒入细菌和霉菌的培养基,混匀、凝固后置恒温培养箱中倒置培养。细菌于36℃培养48h后计数;霉菌于30℃培养5d后计数。同时,接种1mL菌悬液于LST肉汤管中,36℃培养24h后观察管内是否有气泡产生。其中,菌落总数测定参照GB/T 4789.2—2008《食品卫生微生物学检验 菌落总数测定》,大肠菌群测定参照 GB/T 4789.3—2008《食品卫生微生物学检验 大肠菌群计数》,霉菌计数按 GB/T 4789.15—1994《食品卫生微生物学检验 霉菌和酵母计数》规定执行。
1.6 细菌的分离、纯化和鉴定
1.6.1 分离与纯化
从营养琼脂培养基中挑出典型生长的单一菌落,平板划线法反复分离纯化,得到纯化的单个菌落,然后进行菌落形态观察,并革兰氏染色、镜检,观察细胞形态,对分离出的细菌进行初步分析[12]。
1.6.2 培养特征观察
观察并记录已分离纯化的单个菌落的菌落形态,包括大小、形状、隆起程度、表面形态、边缘结构、黏度、透明度、质地及颜色等。
1.6.3 形态特征观察
挑取分离纯化得到的单一菌落,进行革兰氏染色、镜检,观察菌株革兰氏染色结果及个体形态,包括细胞的形状、细胞间的排列方式、有无芽孢等。
1.6.4 菌株的16S rDNA 基因同源性分析
使用灭菌牙签挑取分离纯化的单菌落,置于装有38 μL ddH2O的Microtube中95℃热变性5min,然后迅速加入PCR反应体系[13]:1)反应引物:采用细菌16S rDNA的通用引物[14-15];引物1(1 4 9 2 R):5'-GGTTACCTTGTTACGACTT-3',引物2(27F):5'-AGAGTTGATCCTGGCTCAG-3'。2)反应体系(50 μL):10×PCR Buffer 5 μL, Mg2+(25mmol/L)3 μL,d NTPs (each 25mmol/L) 1μL,引物1(27F) 1μL,引物2(1492R) 1μL,Taq酶(5U/μL)1μL。3)反应条件:94℃,预变性5min;94℃,变性1min;50℃退火1min;72℃延伸2min;30次循环;72℃,延伸10min。
1.6.5 琼脂糖凝胶电泳
取1μL PCR产物在1%琼脂糖凝胶进行电泳,检验扩增产物。
1.6.616 S rDNA序列的测序
PCR 产物由上海桑尼生物科技有限公司进行测序。
1.6.716 S rDNA序列比对与系统发育分析
测序结果输入NCBI网站,使用Blast软件[16],将测定得到的基因序列与GenBank数据库进行序列比对分析,进行同源性比较。 采用Dnaman软件包进行多重序列比较,进行系统发育分析,并构建遗传进化树。
1.7 细菌菌相变化
按1.5.2节的方法在每个平皿中接入l mL菌悬液,然后分别倒入不同菌相的选择性培养基,混匀。凝固后置恒温培养箱中倒置培养,培养条件见表1。

表1 不同细菌菌相的培养条件Table 1 Culture conditions of different bacteria
2 结果与分析
2.1 米发糕储存中微生物分析
米发糕是一种高水分易腐败食品,图1是25℃条件下米发糕细菌总数变化曲线。新鲜米发糕的细菌总数<10(lg(CFU/g)),储藏第7天,细菌总数显著升高, 远超过国家规定的糕点销售标准[17]。在这个期间内,细菌总数一直呈上升趋势。霉菌生长情况如图2所示,可以观察到,霉菌生长较缓慢,从第7天开始生长,到第12天显著增加,之后米发糕表面有霉斑出现。另外,在米发糕储藏过程中,一直未有大肠菌群检出。因此,细菌是导致米发糕迅速腐败变质的主要因素。故本研究将继续对细菌菌种作进一步的分析。的主要腐败细菌是芽抱杆菌和葡萄球菌。本实验通过对米发糕储藏过程中发现的菌株进行分离纯化,运用PCR扩增技术进行鉴别,确定米发糕储藏过程中存在3种细菌,再结合系统发育数分析,确定这3株菌分别为:发酵乳杆菌、巴氏葡萄球菌和蜡样芽胞杆菌。

图1 米发糕储藏过程中细菌总数变化Fig.1 Change of total bacteria in fermented rice cake during storage
2.2.1 菌株菌落培养特征观察
在米发糕贮藏过程中,共分离到3株具有典型菌落形态的细菌,其中,有两株菌都是比较小的圆形菌落,另一株是较大的有凸起、褶皱和边缘不整齐的圆形菌落。其菌落形态特征如表2所示。

表2 典型菌株菌落形态Table 2 Colonial morphology of typical strains
2.2.2 菌株形态特征观察

图3 菌株革兰氏染色图片Fig.3 Pictures of Gram strains

图2 米发糕储藏过程中霉菌总数变化Fig.2 Change of total mold in fermented rice cake during storage
对分离到的3株菌分别进行革兰氏染色,由图3可知,3株菌都是革兰氏阳性菌,其中图3a是具圆端的短杆菌,并形成链状(菌株1),图3b菌体呈球形,排列成葡萄串状(菌株2),图3c有明显的芽孢存在(菌株3)。
2.2.3 PCR扩增产物检验
2.2 细菌的分离、纯化和鉴定
鉴定细菌的传统方法主要是依据形态特征和生理生化特性,该法往往不能反映被鉴定物种与其他物种之间的亲缘关系,一般只能鉴定到属水平;而采用生物技术通过对大分子的分析从而对微生物进行分类鉴定,则能准确反映物种之间的亲缘关系,能鉴定到种水平。te Giffel等[18]研究发现,蜡样芽抱杆菌和短小芽抱杆菌是烘焙制品中的主要腐败菌。而Ji等[19]发现松糕中

图4 PCR产物琼脂糖凝胶电泳图Fig.4 Agarose gel electrophoresis of PCR products
挑取分离纯化的单菌落进行PCR扩增,并取扩增产物1μL进行琼脂糖凝胶电泳分析,3个样品都在1000~2000bp 处出现清晰明亮的条带,见图4,表明所测菌株的16S rDNA基因扩增成功。
2.2.4 PCR产物测序与细菌16S rDNA基因序列分析
将PCR产物送于上海桑尼生物科技有限公司测序,测得3株菌的16S rDNA序列片段长度分别为:974、1089bp和1132bp,序列见图5。

图5 菌株的16S rDNA序列片段Fig.5 16S rDNA sequence fragments of bacterial strains
将测序结果提交到NCBI进行序列同源性比对,并把GenBank上与细菌16S rDNA相似度较大的序列载入DNAMAN软件包中,进行多重序列比较,再构建系统发育树,如表3所示。菌株1与Lactobacillus fermentum最为接近,16S rDNA基因相似性达到100%。菌株2与Staphylococcus pasteuri同源性达到99%。菌株3与Bacillus cereus同源性为98%。而且菌株1(C12481)与HM035543(Lactobacillus fermentum strain 338-1-1)构成一个分支;菌株2(12482)与EU379258(Staphylococcus pasteuri strain 1RN-4A)在一个分支;菌株3(C12484)与HM015630(Bacillus cereus strain DZ103)在同一个分支,见图6。2.3米发糕储藏中细菌菌相变化及优势腐败菌分析

表3 分离菌株16S rDNA序列同源性比对Table 3 16S rDNA sequence identity of bacterial strains

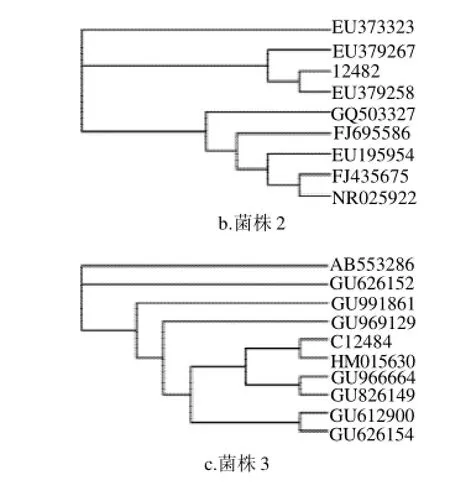
图6 菌株的系统发育树分析Fig.6 Phylogenetic tree analysis of bacterial strains
在米发糕储藏过程中,共分离并鉴别出3种细菌,表4反映了室温储藏条件下米发糕细菌总数、乳杆菌、葡萄球菌和芽孢杆菌的生长变化规律。在实验条件下,3种菌都不同程度影响了产品的腐败变质。其中,优势腐败菌是乳杆菌和芽孢杆菌,且都呈持续上升趋势。葡萄球菌呈先上升后下降趋势,但在整个储藏过程中其相对量较小。总的来说,米发糕中所含腐败菌种类较少,一方面是由于经过高温蒸煮后,大部分细菌被杀灭。另一方面,乳酸菌是大米原料中含量最多的一种微生物,在发酵过程中,由于其繁殖产生大量乳酸或其他有机酸,使微环境pH值显著下降[20],从而在储藏中很好地抑制了其他微生物生长。另外芽孢杆菌迅速消耗环境中的游离氧,造成环境低氧,并产生乳酸等有机酸类,进一步降低了环境pH值,间接抑制其他腐败菌的生长。

表4 米发糕室温(25℃)储藏过程中细菌的菌相变化Table 4 Microbial change of fermented rice cake during the storage at 25 ℃
3 结 论
本实验对影响米发糕货架期的主要微生物进行研究,应用PCR技术和系统发育树对储藏中分离出的细菌种类进行了鉴定和分析。结果表明,在室温条件下,细菌是导致米发糕迅速腐败的最主要因素,随着米发糕储藏时间的延长,细菌总数呈持续上升趋势,并在第7天急剧上升,远远超出国家标准。在整个储藏过程中,未检测出大肠杆菌,而霉菌生长较为缓慢。综合细菌菌落形态、PCR鉴定及系统发育树分析,确定分离得到的细菌分别是:Lactobacillus fermentum (发酵乳杆菌),Staphylococcus pasteuri (巴氏葡萄球菌),和Bacillus cereus(蜡样芽胞杆菌)。通过对腐败菌菌相分析,表明3种菌都不同程度影响了米发糕的腐败变质,其中乳杆菌和芽孢杆菌是最主要的腐败菌,且两种菌都在储藏过程中呈明显上升趋势。葡萄球菌数量相对较少,呈先上升后下降趋势。这些工作为进一步探讨米发糕保存技术、建立有效的防腐提供了新的思路。
[1]陈德文, 沈伊亮, 吴鹏, 等. 米发糕蒸煮工艺对大米淀粉颗粒特性的影响研究[J]. 食品科学, 2009, 30(10):114-117
[2]柏芸, 熊善柏, 王欢欢, 等. 传统发酵食品米发糕生产工艺的革新与现代化[J]. 粮食与食品工业, 2009(5): 4-6.
[3]HARMSEN D, KARCH H.16 rDNA for diagnosing pathogens: a living tree[J]. SM News, 2004, 70: 19-24.
[4]李志岗, 杨官品, 朱艳红. 水环境细菌16S rDNA限制性片断长度多型性及群落结构的分析[J]. 水生生物学报, 2001, 25(2): 111-115.
[5]WISE M G, MCARTHER J V, SHIMKETS L J. Bacterial diversity of a Cardina bay as determined by 16S rRNA gene analysis: Confirmation of novel taxa[J]. Appl Environ Microbial, 1997, 63(16): 1505-1514.
[6]FONTANA C, VIGNOLO G, COCCONCELLI PS. PCR-DGGE analysis for the identification of microbial populations from argentinean dry fermented sausages[J]. Journal of Microbiological Methods, 2005, 63: 254-263.
[7]周帼萍, 刘瑞祥. 分子生物学技术在食品微生物快速鉴定中的应用[J]. 武汉食品工业学院学报, 1999(l): 36-38.
[8]周贤轩, 杨波, 陈新华. 几种分子生物学方法在菌种鉴定中的应用[J]. 生物技术, 2004, 14(6): 35-38.
[9]中华人民共和国国家标准. GB/T 4789.28—1994食品卫生微生物学检验 染色法、培养基和试剂[S].
[10]郝林. 食品微生物学实验技术[M]. 北京: 中国农业出版社, 2001.
[11]沈伊亮, 潘思轶, 陈德文, 等. 米发糕汽蒸工艺模型[J]. 农业工程学报, 2009, 25(Suppl1): 112-117.
[12]东秀珠, 蔡妙英. 常见细菌系统分类和鉴定方法[M]. 北京: 科学出版社, 2001.
[13]钱昆, 周涛. 低温熏煮香肠中腐败菌的分离及鉴定[J]. 食品工业科技, 2008(4): 124-126.
[14]WILLIAM G W, SUSAN M B,DALE A P, et al. 16S ribosomal DNA amplification for phylogenetic study[J]. Journal of Bacteriology, 1991, 2 (6): 697-703.
[15]KIM T W , LEE J H, KIM S E, et al. Analysis of microbial communities in doenjang, a Korean fermented soybean paste, using nested PCR-denaturing gradient gel electrophoresis[J]. International Journal of Food Microbiology, 2009, 131: 265-271.
[16]ALTSCHUL S F, MADDEN T L, SCHAFFER A A, et al. Gapped BLAST and PSI-BLAST; a new generation of protein database search programs[J]. Nucleic Acids Research, 1997, 25: 3389-3402.
[17]中华人民共和国国家标准. GB7099—2003糕点、面包卫生标准[S].
[18]te GIFFEL M C, BEUMER R R, LEIJENDEKKERS S, et al. Incidence of Bacillus cereus and Bacillus subtilis in foods in the Netherlands[J]. Food Microbiology, 1996, 13: 53-58.
[19]JI Ying, ZHU Kexue, QIAN Haifeng, et al. Microbiological characteristics of cake prepared from rice flour and sticky rice flour[J]. Food Control, 2007, 18: 1507-1511.
[20]李玉珍, 肖怀秋, 兰立新, 等. 我国大米发酵食品研究进展[J]. 江苏调味副食品, 2008(6): 33-37.
Microbial Analysis of Fermented Rice Cake during Storage
CHEN Fang-rong,XU Xiao-yun,ZHANG Min,PAN Si-yi,LI Xiu-juan*
(College of Food Science and Technology, Huazhong Agricultural University, Wuhan 430070, China)
Fermented rice cake is a kind of traditional fermented food in China, especially in southern areas. In this study, the microbial analysis of fermented rice cake during storage was conducted, and the bacterial strains were identified by sequencing of partial 16S rDNA through polymerase chain reaction (PCR) amplification. The results indicated that bacteria were the major factor for the spoilage of fermented rice cake. Three major kinds of bacteria were isolated, purified and identified as Lactobacillus fermentum, Staphylococcus pasteuri and Bacillus cereus. Moreover, Lactobacillus and Bacillus were identified as the dominant spoilage bacteria through the microbial analysis, and both of them revealed an obvious increase trend with the extension of storage time.
fermented rice cake;microbe;isolation;identification;dominant spoilage bacteria
TQ929.2
A
1002-6630(2011)03-0186-05
2010-05-12
湖北省农业科技创新中心创新团队项目(2007620)
陈芳溶(1984-),女,硕士研究生,研究方向为食品科学与工程。E-mail:fangrong19@yahoo.com.cn
*通信作者:李秀娟(1978—),女,副教授,博士,研究方向为农产品质量与安全、农产品加工与贮藏。E-mail:lixiujuan@mail.hzau.edu.cn

