啤酒混浊蛋白组分的分离鉴定
金 蓓,李 琳,李 冰,冯宗财,杜建中
啤酒混浊蛋白组分的分离鉴定
金 蓓1,李 琳2,李 冰2,冯宗财1,杜建中1
(1.湛江师范学院化学科学与技术学院,广东 湛江 524048;2.华南理工大学轻工与食品学院,广东 广州 510640)
采用双向电泳结合基质辅助激光解吸/电离飞行时间质谱(MALDI-TOFMS)技术分析确定引起啤酒混浊的蛋白组分。结果表明,仅有少量的蛋白组分参与啤酒混浊的形成。聚丙烯酰胺凝胶电泳分析发现MW 40kD左右,25~29kD和6.5~17kD作为啤酒混浊蛋白组分,可能主要来自麦芽中的水溶蛋白,小部分来自麦芽醇溶蛋白。双向电泳分析证实了大部分的麦芽蛋白在酿造过程中发生降解和变性,并结合质谱技术鉴定得到BTI-CMe、germin E (Hordeum vulgare)和 protein Z 3种组分可以抵抗酿造过程的热变性和水解作用,将成为啤酒混浊形成重要的促进因子。
啤酒混浊;双向电泳;质谱;酿造过程;热变性
现在瓶装啤酒杀菌后出现混浊和在销售过程中酒液产生沉淀、混浊、失光的现象,绝大多数是由于啤酒的胶体不稳定性而引起的。因此,啤酒胶体稳定性的研究,一直是啤酒行业重要的研究课题。通过对混浊物成分分析可知,导致啤酒混浊的主要原因是由含有高含量脯氨酸的蛋白质与具有较高聚合度的多酚的复合物引起的[1-2]。啤酒中含有一定数量的大麦蛋白,这些蛋白在制麦和酿造过程中经历了化学变化和酶解而最终存留在啤酒中,并影响啤酒的混浊稳定性和泡沫稳定性[3-5]。
为了改善啤酒的胶体稳定性,目前常采用皂土、硅胶和PVPP(聚乙烯聚吡咯烷酮)来提高啤酒的胶体稳定性[6]。由于硅胶能够吸附啤酒中混浊活性蛋白,然几乎不能吸附泡沫活性蛋白[6-7],所以硅胶吸附蛋白被公认为是啤酒混浊蛋白,但是目前仍没有文献指出啤酒混浊蛋白的准确组成,何种蛋白组分在影响啤酒混浊中占主导作用以及它们的来源,因而本实验利用蛋白质组学的方法即双向电泳+质谱通过,探讨硅胶吸附蛋白的精确组成,从而确定啤酒混浊活性蛋白组分,并进一步分析麦芽蛋白在酿造过程中的变化,为进一步阐述每一种混浊蛋白组分促进啤酒混浊形成的机理提供参考。
1 材料与方法
1.1 材料与试剂
Baudin麦芽、麦汁、发酵液和啤酒等原料由珠江啤酒有限公司提供。
二硫苏糖醇(电泳级)、碘乙酰胺(电泳级)、超纯尿素(电泳级)、CHAPS(电泳级) 美国Sigma公司;苯甲基磺酰氟(电泳级) 加拿大BBI公司;矿物油(电泳级)、硫脲(电泳级) 美国Amresco公司;胰酶(质谱级) 美国Promega公司。
1.2 仪器与设备
KDN-2C型定氮仪 上海纤检仪器有限公司;LGJ-10冷冻干燥机 北京四环科学仪器厂;冷冻离心机 日本Hitachi公司;电磁搅拌机 金坛市新一佳仪器厂;DYCZ-30型电泳槽、ECP3000三恒电泳仪 北京六一仪器厂;Versa Dco凝胶扫描系统、PDQUEST7.3 2D胶分析软件、PH3-10固相化线性17cm干胶条 美国Bio-Rad公司;XW-80A型微型漩涡混合仪 上海爱朗仪器有限公司;Agilent 1100型高效液相色谱仪 美国安捷伦公司;IPGphor等电聚焦仪、Ettan Spot Picker切胶仪 瑞典Amersham Pharmacia 公司;Ettan DAL Tsix垂直板电泳仪 瑞典Amersham Pharmacia 公司;Beckman1765超速离心机 德国 Beckman公司;基质辅助激光解析飞行时间质谱仪 美国Thermo Finnigan公司。
1.3 方法
1.3.1 蛋白的提取
根据Osborne分类法[8],取磨碎的麦芽粉0.1g,加1mL蒸馏水,室温下提取1h,离心取上清液,作为水溶蛋白(清蛋白);在沉淀中再添加5g/100mL NaCl溶液1mL,重复提取过程,上清液为盐溶蛋白(球蛋白);在沉淀中再添加70%乙醇溶液1mL,60℃水浴中提取1h,离心取上清液,获得醇溶蛋白。
啤酒混浊蛋白的提取方法是依据E v a n s等[7]和Apperson等[9]的研究方法稍作修改。即将0.1g硅胶添加到200cm3的脱气啤酒中,混合搅拌10min,然后13000r/min离心5min。弃去上清液,再将沉淀物加入新的200cm3的脱气啤酒中,重复上述过程直至最初的0.1g硅胶完全暴露在4L啤酒中。然后加入0.2%氨水到沉淀颗粒中,混合搅拌,13000r/min离心10min,重复上述过程,回收上清液。最后在上清液中加入硫酸铵,混合搅拌30min,8000r/min离心10min,将沉淀充分溶解在40cm3去离子水中,透析,冷冻干燥得到最终的冻干蛋白粉。
1.3.2 氨基酸分析
采用高效液相色谱(HPLC)分析麦汁,发酵液和啤酒蛋白中的氨基酸组成。首先将冻干的蛋白粉用6mol/L HCl溶液于110℃水解24h,然后将水解液蒸干,用Agilent1100型高效液相色谱仪对氨基酸组成进行测定。氨基酸检测条件: 采用TAG氨基酸分析柱,温度为38℃,流速为1mL/min,检测波长为254nm。
1.3.3 聚丙烯酰胺凝胶电泳(SDS-PAGE)
采用Laemmli[10]的电泳系统并进行改进,利用单向一步电泳方法分析啤酒混浊蛋白的组成。10%分离胶丙烯酰胺,2.5%浓缩胶,交联度为2.6%,样品提取液为:0.0625mol/L Tris-HCl、体积分数5%巯基乙醇、2%SDS、10%丙三醇、体积分数0.002%溴酚蓝,pH6.8。1.3.4双向电泳分析
第一向固相pH 梯度等电聚焦电泳(IPG-IEF) 每个样品用水化液(7mol/L 脲、2mol/L硫脲、4% CHAPS、65mmol/L DTT、2% 载体两性电解质pH3~10,痕量溴酚兰) 分别稀释,涡旋混匀,12000r/min离心10min,取上清液上样到等电聚焦盘中。每根17cm pH3~10 线性IPG预制胶条,考染蛋白质上样量为1mg,总上样体积为350μL,梯度升压,等电聚焦总伏小时为85kV·h。平衡后胶条转移至15%SDS-PAGE上进行第二向电泳。开始时用10mA恒流30min,再用30mA恒流至电泳结束。最后凝胶采用质谱兼容银染色法染色。采用Melanie图像分析软件分析扫描图像,进行强度校正、点检测、背景消减、均一化和匹配等处理。
1.3.5 质谱条件
切取需要分析的点,进行胶内酶解,将提取肽段溶于50% ACN-5% TFA(三氟乙酸)中点样于不锈钢靶板。采用质谱仪对处理好的样品进行肽质量指纹图谱分析。离子源加速电压为20kV,采用反射模式进行检测,离子延迟时间100ns,真空度为4×10-7Torr,收集质荷比在700~3500D范围内的信号峰,用胰蛋白酶自切峰作为内标校正,利用Voyager-DE STR对所得到的峰图进行分析。采用标准的检索方法,在MASCOT (http:// www.matrixscience. com/)进行检索,在NCBI nr 数据库中搜索。
2 结果与分析
2.1 啤酒混浊蛋白组分分析
相对于啤酒蛋白含量(0.467g/L)而言,混浊蛋白(0.106g/L)仅占啤酒蛋白的较少的一部分,这也表明了仅有少量的啤酒蛋白参与了啤酒混浊的形成。Leiper等[11]报道混浊蛋白含量在麦汁煮沸和发酵过程中明显降低,而啤酒混浊蛋白的含量极大地影响啤酒胶体稳定性。脯氨酸和谷氨酸一直被认为是啤酒混浊蛋白的重要组成部分[12]。表1也证实了这一理论。啤酒混浊蛋白中脯氨酸和谷氨酸含量明显高于啤酒中的含量而其他氨基酸组分含量却相差无几。而含硫氨基酸(蛋氨酸和半胱氨酸)是啤酒混浊蛋白中的第一限制性氨基酸。

表1 啤酒混浊蛋白中氨基酸含量测定Table 1 Contents of amino acids in beer haze
2.2 电泳分析
2.2.1 SDS-PAGE分析
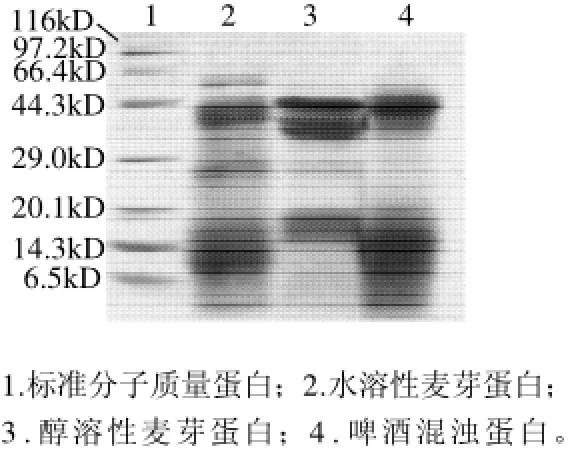
图1 啤酒混浊蛋白电泳图Fig.1 SDS-PAGE of beer haze proteins
由图1可知,混浊蛋白包括了一系列广泛的蛋白带,其中大约40kD高强度的蛋白带可以认为是主要的蛋白带,通常这个蛋白带被描述为protein Z。其他的蛋白带包括6.5~17kD和25~29kD。然而,Leiper等[11]却观察到啤酒混浊蛋白包括46.9kD即protein Z,30.7、24.6、20.8、16.5、13.5kD,而其中参与混浊形成的重要的糖蛋白是16.5kD和30.7kD。啤酒混浊蛋白中40kD和25~29kD蛋白带可能是来自麦芽中水溶性蛋白或醇溶蛋白,而6.5~17kD蛋白带来自麦芽中水溶性蛋白,这表明了6.5~17kD和25~29kD蛋白带与protein Z一样可以抵抗酿造过程中的热变性和酶解作用而存留在啤酒中,从而参与啤酒混浊的形成。
2.2.2 双向电泳分析
由图1可知,啤酒混浊蛋白中低分子质量的蛋白带在SDS-PAGE图中分辨率较低,采用双向电泳进一步探讨啤酒混浊蛋白的组成。而且由于麦汁蛋白的组成极大地影响啤酒混浊蛋白的组成[25-26],因而分别对啤酒麦汁蛋白和啤酒混浊蛋白进行2-D电泳分析,从而确定影响啤酒混浊的主要蛋白组分。利用Melanie分析软件发现麦汁蛋白2-D电泳图中大约有150个蛋白点,而在混浊蛋白电泳图则存在大约60个蛋白点,且主要分布在10~75kD和pI4~8,其中高强度的蛋白点都集中在两块凝胶的40~60kD和pI4~6附近,这些符合protein Z的特性,据此可推测为这些蛋白点为protein Z。由图2、3可知,protein Z区域在麦汁蛋白和混浊蛋白2-D图中分辨率较差,即存在一个宽范围、高强度的蛋白点。这可能是因为protein Z中的赖氨酸与糖分子发生部分的糖基化作用。
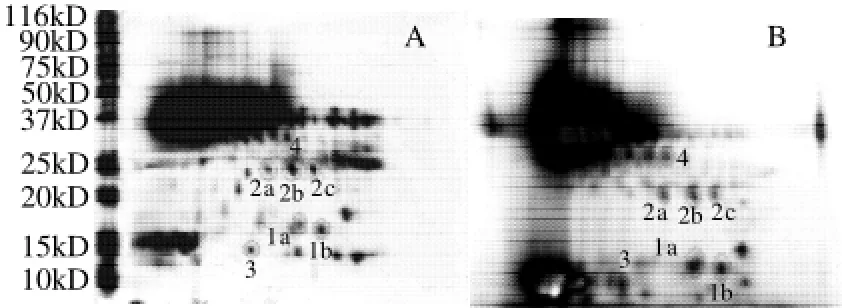
图2 麦汁蛋白(A)和啤酒混浊蛋白(B)的2-D电泳图Fig.2 Two-dimensional electrophoresis of wort protein and beer haze proteins
由图2可发现,从银染色凝胶中观察到的蛋白模式的变化与酿造过程中发生的化学修饰密切相关。在麦汁蛋白的2-D电泳图中还存在大约10个高分子质量蛋白点主要分布在MW75~116kD范围内,而在啤酒混浊蛋白的2-D电泳图中则观察不到这些高分子蛋白点的存在。与麦汁蛋白电泳图相比,发现在啤酒混浊蛋白电泳图的pI5~8和分子质量在10~20kD及25~35kD区域内蛋白点数目明显降低。在麦汁蛋白电泳图中25~35kD区域内检测到大约32个蛋白点,同样地,啤酒混浊蛋白电泳图中此区域内仅检测到20个蛋白点;而在麦汁蛋白2-D图中12~16kD区域内检测到大约20个蛋白点,啤酒混浊蛋白在此区域内仅检测到大约12个蛋白点。这一结果表明了大部分的蛋白组分不能承受酿造过程的热变性和还原作用,证实了前面蛋白含量的测定和单向电泳分析。通过对比麦汁蛋白和混浊蛋白的2-D电泳图可发现,高强度的蛋白点1 a、1 b、2 a、2 b、2 c、3、4均存在于这两个电泳图中。而且相对于麦汁蛋白2-D图而言,蛋白点1a、1b、3强度加深,而2a、2b、2c、4强度减弱,证实了在酿造过程中高分子蛋白发生降解生成小分子蛋白,然而这一结果也说明了1a、1b、2a、2b、2c、3、4蛋白点可以抵抗酿造过程中的热变性和酶解作用而存留在啤酒中,从而作为促进啤酒混浊的重要因子,即是最为重要的混浊活性蛋白。
2.3 质谱分析
利用飞行质谱来分析啤酒混浊蛋白中的蛋白点,以确定啤酒混浊蛋白主要的组成成分。根据图象分析结果从啤酒混浊蛋白主要分布区域中选出一些极具代表性、清晰且较浓的与麦汁蛋白电泳图相匹配的7个蛋白点(1a、1b、2a、2b、2c、3、4),进行LCQ-DECAXPplus质谱分析,得到相应肽分子质量和肽序列标签的蛋白质,经数据库查询得到相应的蛋白质。
初步鉴定蛋白质结果发现,蛋白点1a、1b、3都被鉴定为BTI-CMe蛋白(属于α-淀粉酶或胰蛋白酶抑制剂属,也称之为氯仿/甲醇可溶性蛋白)。相对醇溶蛋白而言,BTI-CMe是一种低分子质量的盐溶性并具有疏水特性蛋白,脯氨酸含量较低,属于CM蛋白家族[13-16]。从理论上分析,它们类似于醇溶蛋白,这些疏水性蛋白或它们的疏水性部分能够抵抗酿造过程中的热变性和酶解作用,最终存在于啤酒中继而参与啤酒混浊的形成。而蛋白点2a、2b、2c被鉴定为germin E(大麦属),germin实际上是一种草酸氧化酶(OXO),属于水溶性的同源六聚体糖蛋白。每个单体包含201个氨基酸残基,分子质量大约为26kD[17-18]。germin蛋白具有很高的单体表面包埋面积且在其蛋白结构存在疏水性区域,因而对热、蛋白酶和其他变性剂都具有显著的抗性[19-21]。而对比麦汁和啤酒混浊蛋白的2-D图可发现,2a、2b、2c蛋白点强度减弱,这可能是由于germin的脯氨酸含量较低(大约8%)使得在这个区域内的大部分蛋白组分在酿造过程中不容易发生糖基化作用。事实上,酿造过程中的还原条件和热变性导致蛋白结构的展开,而糖基化可以结构展开的germin蛋白在酿造过程中以可溶状态而存留在最终产品啤酒中。蛋白点4被鉴定为protein Z-type serpin (protein Z4)。protein Z属于丝氨酸蛋白酶抑制剂家族,分为proteinZ4和proteinZ 7两个小的基因属[22-23]。这些蛋白组分在酿造过程中,protein Z中16%的赖氨酸发生糖基化通过美拉德反应[24]。protein Z也是大麦蛋白中极少数几个蛋白在啤酒中被识别出来的蛋白,并有助于改善啤酒的泡沫稳定性以及参与啤酒混浊的形成[22-23]。因此,根据本研究中蛋白质组学分析(双向电泳和质谱)发现啤酒中混浊活性蛋白组分包括3个重要的组成部分:protein Z,BTI-CMe蛋白,germin E。这一结果表明了这3种蛋白组分在啤酒混浊形成中起到至关重要的作用。
3 结 论
本研究采用电泳(单向电泳和双向电泳)结合质谱技术考察啤酒混浊蛋白组分在酿造过程的变化和鉴定其组成成分,其研究结果表明:1) 蛋白含量分析发现仅有少量的啤酒蛋白参与了啤酒混浊的形成,而氨基酸含量分析发现脯氨酸和谷氨酸作为啤酒混浊蛋白的主要组成。2)SDS-PAGE分析发现混浊蛋白包括了一系列广泛的蛋白带,即40kD左右,6.5~17kD和25~29kD,并发现这些混浊蛋白主要来自麦芽中的水溶蛋白组分,小部分是来自醇溶蛋白组分。3)2-D电泳分析发现混浊蛋白电泳图大约有60个蛋白点,主要分布在10~75kD和pI4~8。对比分析麦汁和啤酒混浊蛋白的2-D图发现,大部分蛋白点在酿造过程中发生变性和降解,并发现大约有7个高强度蛋白点经得住酿造过程中的各种修饰反应而存在于啤酒混浊蛋白中成为影响啤酒混浊蛋白的主要组分。5)利用飞行质谱技术对这7个蛋白点进行分析鉴定,确定啤酒中混浊活性蛋白组分包括3个重要的组成部分:protein Z、BTI-CMe蛋白、germin E。然而这些蛋白组分的来源以及它们在啤酒混浊形成过程中所起的作用仍有待于今后研究进一步的证实。
[1]BAMFORTH C W. Beer haze[J]. Am Soc Brew Chem, 1999, 57: 81-90.
[2]SIEBERT K J. Effects of protein-polyphenol interactions on beverage haze, stabilization and analysis[J]. Agric Food Chem, 1999, 47(2): 353-362.
[3]BOIVIN P, MARTEL C. Proteolysis during malting[J]. Ferment, 1991, 4: 182-186.
[4]EVANS D E, HEJGAARD J. The impact of malt derived proteins on beer foam quality. Part 1. The effect of germination and kilning on the level of protein Z4, protein Z7 and LTP1[J]. Inst Brew, 1999, 105: 159-169.
[5]SLACK P T, BAMFORTH C W. The fractionation of polypeptides from barley and beer by hydrophobic interaction chromatography: the influence of their hydrophobicity on foam stability[J]. Inst Brew, 1983, 89: 379-401.
[6]SIEBERT K J, LYNN P Y. Mechanisms of beer colloidal stabilization [J]. Am Soc Brew Chem, 1997, 55: 73-78.
[7]EVANS D E, ROBINSON L H, SHEEHAN M C, et al. Application of immunological methods to differentiate between foam-positive and haze active proteins originating from malt[J]. Am Soc Brew Chem, 2003, 61: 55-62.
[8]OSBORNE T B. The vegetable proteins[M]. London: Longmans Green and Co., 1985.
[9]APPERSON K, LEIPER K A, McKEOWN I P, et al. Beer fluorescence and the isolation, characterization and silica adsorption of haze-active beer proteins[J]. Inst Brew, 2002, 108: 193-199.
[10]LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227: 680-685.
[11]LEIPER K A, STEWART G G, McKEOWN I P. Beer polypeptides and silica gel. PartⅠ. Polypeptides involved in haze formation[J]. Inst Brew, 2003, 109(1): 57-72.
[12]ASANO K, SHINAGAWA K, HASHIMOTO N. Characterization of haze-forming proteins of beer and their roles in chill haze formation[J]. Am Soc Brew Chem,1982, 40: 147-154.
[13]SALCEDO G, SACHEZ-MONGE R, ARGAMENTERIA A, et al. TheA-hordeins as a group of salt soluble hydrophobic proteins[J]. Plant Science Letters, 1980, 19 (2): 109-119.
[14]PAZ-ARES J, HERNANDEZ-LUCAS C, SALCEDO G, et al. The CM-proteins from cereal endosperm: immunological relationships[J]. Experimental Botany, 1983, 34: 388-395.
[15]ROBINSON L H, JUTTNER J, MILLIGAN A, et al. The identification of a barley haze active protein that influences beer haze stability: Cloning and characterisation of the barley SE protein as a barley trypsin inhibitor of the chloroform/methanol type[J]. Cereal Sci, 2007, 45: 343-352.
[16]ODANI S, KOIDE T, ONO T. The complete amino acid sequence of barley trypsin inhibitor[J]. Biol Chem, 1983, 258: 7998-8003.
[17]WOO E J, DUNW ELL J M. Barley oxalate oxidase is a hexameric protein related to seed storage protein: evidence from X-ray crystallography [J]. FEBS Lett, 1998, 437: 87- 90.
[18]LANE B G, BERNIER F. Homologies between members of the Germ in gene family in hexaploid wheat and similarities between these wheat Germ in and certain Physarum spherulins[J]. Biol Chem, 1991, 266: 10461-10469.
[19]DUMAS B, SAILLAND A, FREYSSINET G, et al. Identification of barley oxalate oxidase as a Germ in-like protein[J]. Paris Life Scie, 1993, 316: 793- 798.
[20]LANE B G, DUNWELL J M, RAY J A. Germ in, a protein mark of early plant development, is an oxalate oxidase[J]. Biol Chem, 1993, 268: 12239-12242.
[21]VALLELIAN-BINDSCHEDLER L, MSINGER E, MTEAUX J P, et al. Structure, expression and localization of a germin-like protein in barley (Hordeum vulgare L.) that is insolubilized in stressed leaves[J]. Plant Molecular Biology, 1998, 37: 297-308.
[22]EVANS D E, SHEEHAN M C. Do not be fobbed off: The substance of beer foam: a review[J]. Am Soc Brew Chem, 2002, 60: 47-57.
[23]CURIONI A, PRESSI G, FUREGON L, et al. Major proteins of beer and their precursors in barley: electrophoretic and immunological studies [J]. Agric Food Chem, 1995, 43: 2620-2626.
[24]HEJGAARD J, KAERSGAARD P. Purification and properties of the major antigenic beer protein of barley origin[J]. Inst Brew, 1983, 89: 402-410.
[25]金蓓, 李琳, 李冰, 等. 啤酒酿造过程对麦芽蛋白结构的影响研究[J].酿酒科技, 2009(3): 21-25.
[26]PERROCHEAU L, ROGNIAUX H, BOIVIN P, et al. Probing heatstable water-soluble proteins from barley to malt and beer[J]. Proteomics, 2005, 5: 2849-2858.
Isolation and Identification of Haze Proteins in Beer
JIN Bei1,LI Lin2,LI Bing2,FENG Zong-cai1,DU Jian-zhong1
(1. School of Chemistry Science and Technology, Zhanjiang Normal University, Zhanjiang 524048, China;2.College of Light Indusity and Food Sciences, South China University of Technology, Guangzhou 510640, China)
The two-dimensional electrophoresis (2-DE) and MALDI-TOF-MS were used to determine the compositions of haze proteins in beer. The results indicated that only small amount of proteins participated in the formation of beer haze. Sodium dodecyl sulfate polyacrylamide gel electrophoresis (SDS-PAGE) revealed the molecular masses of 40, 25-29 kD and 6.5-17 kD for bear haze protein fraction, which were originated primarily from water-soluble protein and ethanol-soluble protein in malt. The degradation and denaturation of malt proteins during the brewing process were confirmed by two-dimensional electrophoresis (2-DE) analysis coupled with mass spectrometry. Meanwhile, BTI-CMe, germin E (Hordeum vulgare) and protein Z were also validated to have the resistance to proteolysis and heat denaturation during brewing process, which might be important contributors to the formation of beer haze.
beer haze;two-dimensional gel electrophoresis;mass spectrometry;brewing process;denaturation
TQ93
A
1002-6630(2011)03-0086-05
2010-04-25
国家自然科学基金重点项目(20436020);广东省自然科学基金研究团队项目(05200617);
广东高校优秀青年创新人才培育项目(LYM09100)
金蓓(1981—),女,讲师,博士研究生,研究方向为植物蛋白科学与工程。E-mail:jinbeikim2007@yahoo.com.cn

