杂色鲍与盘鲍杂交F1的早期生物学表现
蔡明夷,柯才焕,郭 峰,王桂忠,王志勇,王艺磊
(1.厦门大学 海洋技术与工程系,近海海洋环境科学国家重点实验室,福建厦门 361005;2.集美大学 水产生物技术研究所,福建厦门 361021)
杂色鲍(Haliotis diversicolor)和盘鲍(H.discus discus)是中国最重要两种养殖鲍,原产地分别为中国台湾和日本。虽然它们的亲缘关系较远,但是这两种鲍杂交可以产生后代,并存活至性成熟[1],但存活后代为含有少量父本基因的雌核发育二倍体[2]。远缘杂交具有广泛的应用价值和潜力。亲和程度较高的杂交组合,可以直接利用杂交 F1的杂种优势;而亲和程度低的杂交组合,也可能在存活后代中筛选出宝贵的育种中间材料和遗传学研究材料。在胚胎和幼体阶段,杂交 F1就可能表现出杂种优势[3-4]或远交不亲和[5-6]。另外,胚胎发育速度和早期成活率也是分析杂交亲和程度和后代遗传本质的辅助依据。因此,本文比较研究杂色鲍与盘鲍正反交 F1及其亲本自繁后代的早期生物学表现,主要包括正反交 F1和亲本自繁后代的卵裂速度和孵化速度,以及杂色鲍与盘鲍杂交 F1和杂色鲍自繁幼体的成活率,以期为杂交 F1的后续应用开发提供依据,也为进一步研究杂交产生雌核发育二倍体的机理奠定基础。
1 材料与方法
1.1 亲鲍与催产
杂交亲本杂色鲍和盘鲍分别由中国台湾和日本引种, 在福建省东山养殖传代。亲鲍催产采用阴干、紫外线照射过的海水刺激和流水刺激的方法。配子开始排放时,将正在排放的亲鲍转移到单独的容器中产卵、排精。操作全过程,同种的雌雄个体间保持5 m以上的距离,同时所有的表面及器皿在每一步操作前先用淡水浸洗过,以防止同种精子污染发生。混合刚排放的卵子和新鲜精液,授精方法参见蔡明夷等的描述[7]。试验包括正反交和父母本自繁4个组合:杂色鲍♀×杂色鲍♂、杂色鲍♀×盘鲍♂、盘鲍♀×杂色鲍♂和盘鲍♀×盘鲍♂,下文简为SS、SJ、JS和JJ。
1.2 胚胎发育速度的观察及统计
授精后,胚胎在22~23 ℃下孵育,每隔5 min取样,每个样本中卵数不少于 200个,用 2%福尔马林固定。取样结束后,在解剖镜下检查记录样品中处于各细胞期的卵数和总卵数,计算出各细胞期胚胎的百分比。以授精时间为横坐标、各细胞期胚胎的百分比为纵坐标作图,并用Gussian模型拟合(Origin 7.0),计算出胚胎发育至各细胞期的时间,其中,µ为平均值,σ为标准偏差(SD)。
参照 Park[8]描述的方法,以胚胎卵裂次数为横坐标,授精时间为纵坐标,用胚胎处各细胞期的时间数据作图,并作线形拟合(Y=A+BX,OriginPro7.0),计算出不同交配组合的卵裂周期间隔时间(το=B)。
每组挑出 200个发育卵,转移到结晶皿中用膜滤海水培养,用于观察孵化时间。每20 min,在体视镜下观察,计未孵化卵数(n),并依此计算出各观察时间的孵化率(H),计算公式为Hi= (200-ni)/200。以授精时间为横坐标、孵化率为纵坐标作图,用Sigmoidal拟合工具拟合后,查找出孵化率为 50%的时间作为孵化时间。
1.3 成活率观察和统计
将2日龄SJ幼体及JJ幼体按每孔30只左右加入预接了矮小卵型藻的6孔培养板中,每组3板,共18孔。培养海水中含20 mg/ L青霉素和链霉素。将培养板放置在25 ℃恒温光照培养箱中培养,每隔24 h观察记录1次,并清理死亡个体。成活率=存活幼体数/总投放幼体数×100%。
2 结果
2.1 胚胎发育速度
图1示授精后不同取样时间,自繁和杂交组合SS、JJ、SJ和JS中,2细胞期、4细胞期、8细胞期和16细胞胚胎的百分比,及其高斯拟合图。利用高斯拟合,计算出SS、JJ、SJ和JS交配组合中,胚胎处2细胞期、4细胞期、8细胞期和16细胞期的时间,结果如图2所示。自繁组合SS和JJ处2细胞期的时间分别为授精后 45.3 min±8.9 min和 59.3 min±8.9 min,杂交组合SJ和JS的处2细胞期的时间分别为授精后 69.3 min±17.5 min和 71.7 min±5.8 min。可见,SJ和JS两杂交组合第一次卵裂均慢于双亲自繁组合。
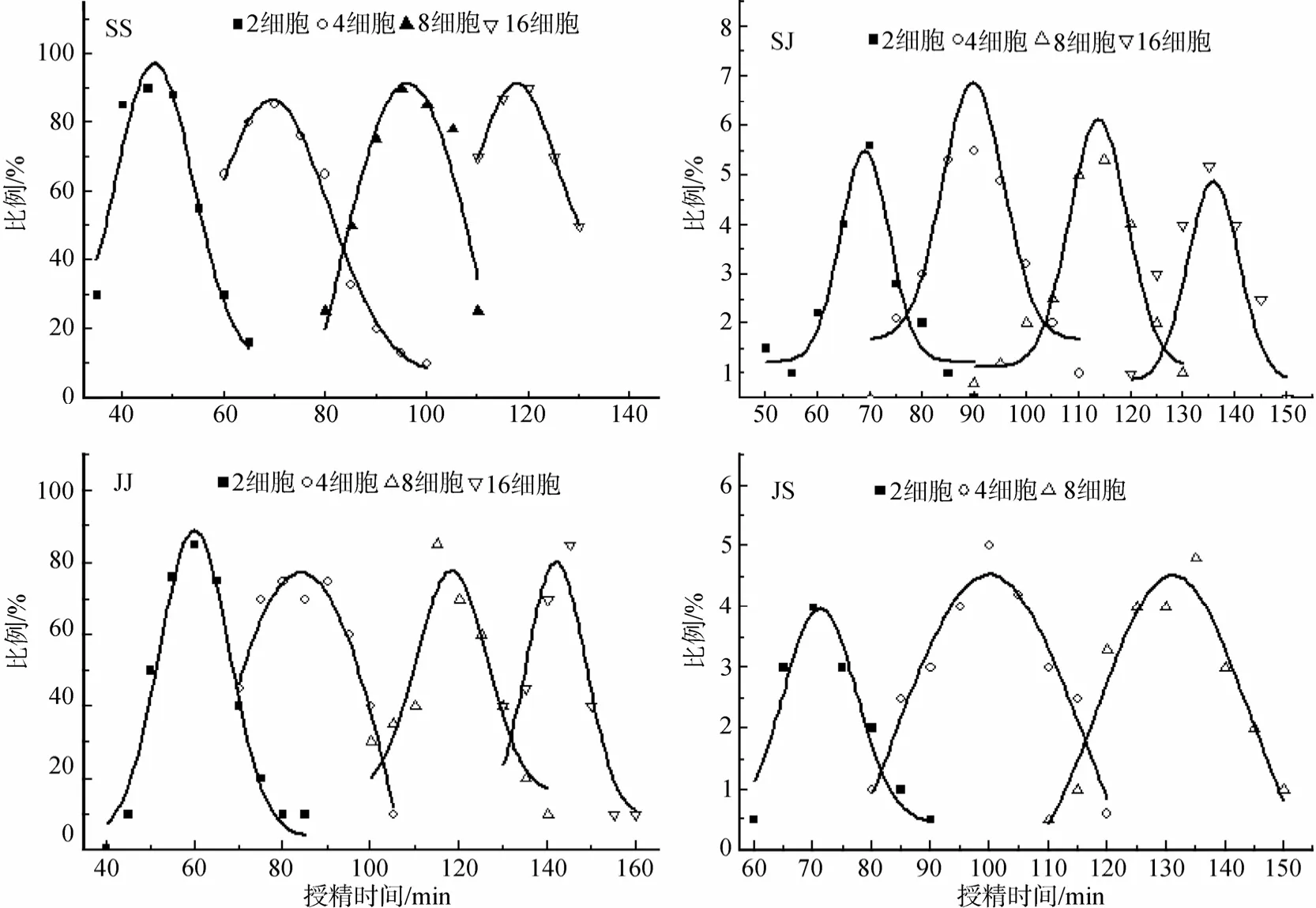
图1 细胞期杂交和自繁组合胚胎速度比较和高斯模型拟合Fig.1 Comparison of development speed of embryos from hybrid and pure crosses at cell stage and Gaussian fitting
以胚胎卵裂次数为横坐标、授精时间为纵坐标,将各细胞期的时间数据作点状图,直线拟合(Y=A+BX),其中系数B为每次有丝分裂所需时间(τ0)。自繁组合 SS 和 JJ的τ0分别为 21.7 min±2.9 min和 27.0 min±2.6 min,杂交组合 SJ和JS的τ0分别为22.2 min±4.7 min 和 31.3 min±6.1min(图2,表1)。各交配组合按τ0从小到大排列为 SS、SJ、JJ、JS。可见,杂交组合有丝分裂速度均接近于母本,但略慢于母本。
杂交组合的孵化速度慢于母本,按孵化速度排列交配组合为SS、SJ、JJ、JS,孵化时间分别为563.4 min±33.8 min、632.7 min±89.5 min、711.8 min±40.0 min和 874.3 min±94.6 min(图3,表1)。从 2细胞开始到卵裂,SS、SJ、JJ和 JS组的胚胎历时相当于23.9τ0、25.4τ0、24.1τ0和 24.8τ0(表1)。
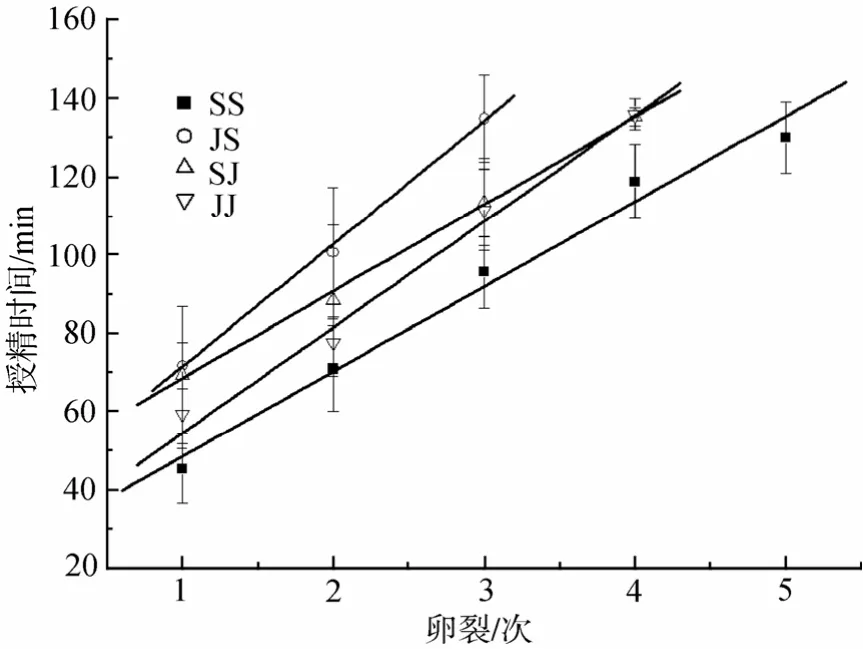
图2 线性拟合估测杂交和自繁组合的卵裂间隔Fig.2 Liner fitting to estimate the mitotic interval of the offspring from the hybrid and the pure crosses
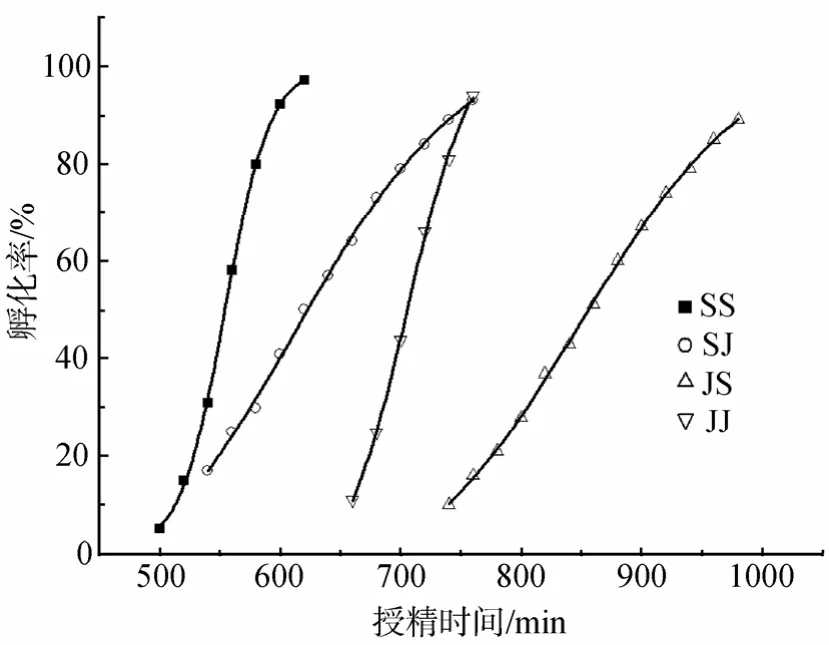
图3 杂色鲍与盘鲍杂交及自繁后代的孵化速度Fig.3 The hatching-out speed of offspring from the hybrid and the pure crosses
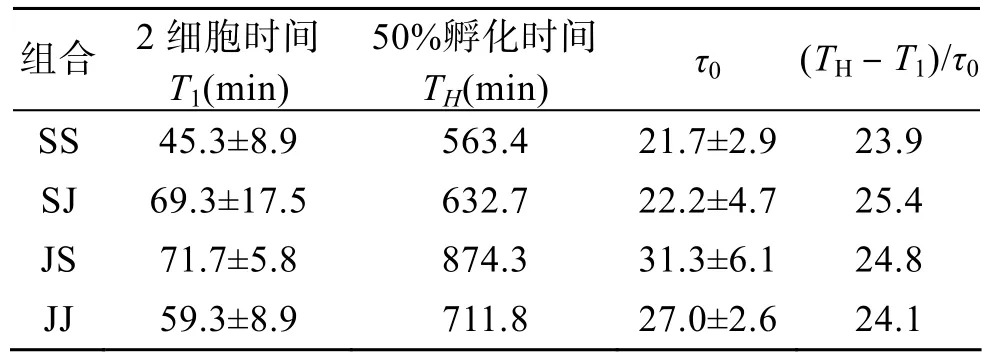
表1 杂色鲍与盘鲍正反交F1及其亲本自繁2细胞期时间、孵化时间和卵裂间隔时间(水温:22~23 ℃)Tab.1 The time of two-cell stage and hatching-out of hybrid between Haliotis diversicolor and H.disucs discus and their parents
2.2 成活率
与母本自繁组合SS相比,SJ杂交幼体成活率很低(图4)。在担轮幼体期和早期面盘期,SJ幼体与SS幼体在形态上没有明显区别。在授精后第4天,幼体开始附着,这些附着幼体畸形率很高,主要表现为头部歪向一侧,足部不定形(图5)。授精后第5天(匍匐幼体),SJ幼体开始大量死亡,D4、D5、D6成活率分别相当于对照组的93.3 %、25.6 %、3.05 %、0.8 %。在授精后第9日幼体开始变态,变态后,SJ的成活率为0.4%±0.03 %,SS的成活率为33.7%±5.9 %。SJ的成活率仅为SS的1.2 %。
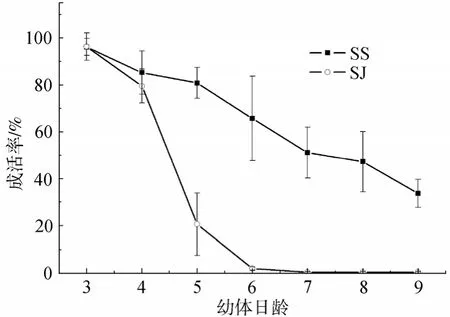
图4 杂色鲍♀×盘鲍♂(SJ)杂交幼体及其杂色鲍自繁幼体(SS)成活率Fig.4 Survival rates of the larvae from heterospecific cross between Haliotis diversicolor and H.discus discus(SJ),and the larvae from the pure cross of H.diversicolor(SS)
3 讨论
3.1 发育速度
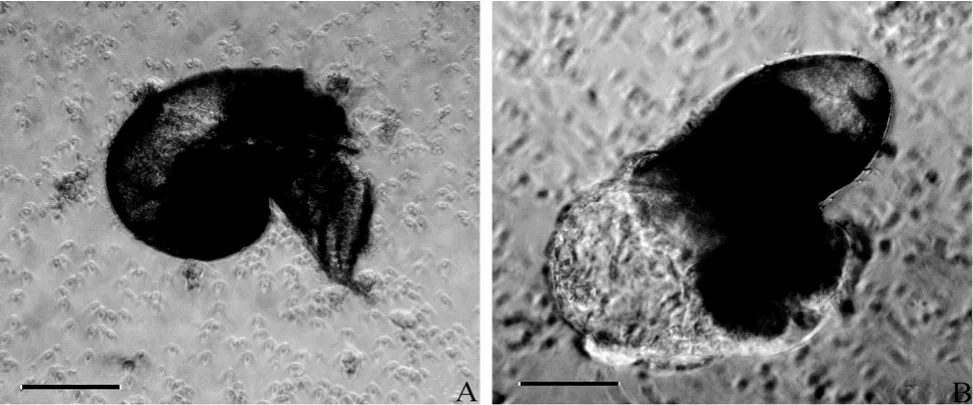
图5 正常的杂色鲍自繁晚期面盘幼体(A)与畸形的杂色鲍×盘鲍杂交晚期面盘幼体(B)的形态Fig.5 The morphology of normal later veliger from the pure cross of Haliotis diversicolor (A) and the malformed later veliger from the heterospecific cross between Haliotis diversicolor× H.discus discus (B)
在计算卵裂时间、孵化时间时,通常采用 50%个体发育到观测指标的时间。本研究中,由于杂交组合发育率较低,仅在 5%左右,故实际操作中,很难确定50%个体发育到观测指标的时间。另一方面,杂色鲍和盘鲍自繁与杂交胚胎卵裂速度较快,很难同时比较观测卵裂时间。因此,在细胞期阶段,本研究采用连续间隔取样的方法,测定授精后不同时间点发育到特定阶段的胚胎数目,以高斯模型拟合来测定处于不同细胞期时间的平均值和标准差。虽然这里的平均值和标准差不是 50%个体发育到观测指标的时间,但能够反映出不同交配组合胚胎发育至 2细胞、4细胞、8细胞和 16细胞等时期的速度和同步性。观察孵化速度时,操作时间比较充裕,可以事先将发育卵筛选出来进行观察。用Sigmoidal拟合工具拟合后,可以估算出50%胚胎孵化的时间。
在相同条件下,杂交亲本杂色鲍和盘鲍的卵裂周期耗时不同,杂色鲍的一个卵裂周期比盘鲍耗时短约5.3 min。杂交F1胚胎发育同时含有杂色鲍与盘鲍的基因组[9],本研究结果表明,杂交 F1的卵裂周期表现出较强的母本效应。早期发育速度的母本效应也见于其他贝类杂交组合,例如大平洋牡蛎Crassostrea gigas与大连湾牡蛎Ostrea talienwhamensis杂交幼体生长速度居于双亲之间与母本接近[10],太平洋牡蛎与葡萄牙牡蛎C.angulata杂交F1生长速度与母本自繁对照组接近[11]。杂交F1发育早期细胞周期表现出母本效应可能是由于早期胚胎发育父本基因处于关闭状态,细胞分裂所需的 RNA和蛋白质是由卵子中贮存物提供。另一方面,SJ和JS杂交F1的有丝分裂周期虽然表现出较强的母本效应,但略慢于母本,导致最终孵化速度明显慢于母本。这可能是由于杂交 F1中含有两个细胞周期不一致的基因组,来源于父本的基因组对细胞周期调控产生了影响。异源基因组对细胞周期调控的影响机制有待进一步研究。另外,正反交 F1第一次卵裂速度比双亲都慢。Que等[12]在研究太平洋牡蛎与近江牡蛎C.ariakensis杂交时,也观察到杂交胚胎第一次卵裂滞后的现象,并用细胞学研究结果进一步证明杂交F1减数分裂耗时约为亲本自繁的 3倍。这些结果揭示,在发育早期杂色鲍和盘鲍杂交 F1特殊的基因组结构影响减数分裂进程和细胞周期调控,杂交 F1具有作为减数分裂和细胞周期调控机制研究模型的潜在价值。
3.2 成活率
杂色鲍×盘鲍杂交 F1在幼体期出现高死亡率,变态后成活率仅为母本自繁的1.2 %。早期发育阶段成活率低的现象同样见于其他贝类和鱼类远缘杂交。魏贻尧等[6]研究合浦珠母贝Pinctada martensii、长耳珠母贝P.chemnitzi和大珠母贝P.chemnitzi之间的杂交时,12次杂交试验中仅有5次获得极少量贝苗,收苗率只为0.01%~0.04%。草鱼Ctenopharyngodon idellus与鲤Cyprinus carpio杂交F1出苗率仅为十万分之一[13]。也有些杂交后代甚至无法活过幼体阶段,如美洲牡蛎C.virginica×近江牡蛎和美洲牡蛎×太平洋牡蛎杂交 F1后代成活率低是杂交不亲和的体现。杂交不亲和在细胞和分子水平的表现包括:核质不相容、染色体数目配对和分离紊乱、酶的基因位点或表达的时空顺序不同等[14]。杂交不亲和的程度大体上与亲本的遗传差异正相关[15]。虽然成活率低下,仍然有少量的杂交鲍苗存活至性成熟。作者[2]已应用AFLP对存活的SJ 杂交F1进行遗传分析,结果表明存活的杂交 F1不是真正的杂种,而是含有少量父母基因的雌核发育二倍体。远缘杂交可能培育异源多倍体、异附加系、易位系等宝贵的遗传学材料。早期成活率的观察记录可以指导进一步研究杂种中异源染色体组的相互作用,例如在快速死亡期可以加密取样点,便于在DNA水平、RNA水平和细胞水平研究杂交胚胎的变化,以研究染色体行为、异源基因组互作和核质互作。
[1]柯才焕,田越,周时强,等.杂色鲍与皱纹盘鲍、盘鲍杂交的初步研究[J].海洋科学,2000,24(11):39-41.
[2]蔡明夷,王志勇,柯才焕,等.杂色鲍×盘鲍杂交及亲本自繁群体的 AFLP分析[J].厦门大学学报(自),2009,48(6):884-889.
[3]Leighton D L,Lewis C A.Experimental hybridization in abalone[J].Int J Invert reprod,1982,5:273-282.
[4]Allen S K,Gaffney P M,Scarpa J,et al.Inviable hy-brids ofCrassostrea virginica(Gmelin) withC.rivularis(Gould) andC.gigas(Thunberg) [J].Aquaculture,1993,113:269-289.
[5]Miyaki K,Niiyama H,Tabeta O.Growth and survival of artificial hybrid abalone,Nordotis gigantea♀×N.discus♂ under laboratory condition[J].Suisanzoshoku,1995,43:401-405.
[6]魏贻尧,姜卫国,李刚.合浦珠母贝、长耳珠母贝和大珠母贝种间人工杂交的研究 I.人工杂交和杂交后代的观察[J].热带海洋,1983,2:309-315.
[7]蔡明夷,柯才焕,王桂忠,等.杂色鲍与盘鲍种间杂交受精率的影响因素[J].中国水产科学,2006,13(2):230-236.
[8]Park I S,Johnson S C.Determination of the temperature-dependent index of mitotic interval (tau(O)) for chromosome manipulation in winter flounderPseudopleuronectes americanus[J].Aquaculture,2002,213:95-100.
[9]蔡明夷,柯才焕,游伟伟,等.杂色鲍♀×盘鲍♂杂交受精细胞学研究[J].厦门大学学报(自然科学版),2007,38(3):239-243.
[10]吕豪,魏若飞,吕典壮,等.太平洋牡蛎(Crassostrea gigas)与大连湾牡蛎(Ostrea talienwhamensis)杂交实验[J].水产科学,1994,13 (6):8-11.
[11]Soletchnik P,Huvet A,Le Moine,O,et al.A comparative field study of growth,survival and reproduction ofCrassostrea gigas,C.angulataand their hybrids[J].Aquat Liv Res,2002,15:243-250.
[12]Que H,Allen S K.Hybridization of tetraploid and diploidCrassostrea gigas(Thunberg) with diploidC.ariakensis(Fujita) [J].J Shellfish Res,2002,21:137-143.
[13]叶玉珍,吴清江,陈荣德.草鱼和鲤杂交的细胞学研究-鱼类远缘杂交核质不同步现象[J].水生生物学报,1989,13(3):234-239.
[14]楼允东.鱼类育种学[M].北京:中国农业出版社,1999:138-140.
[15]Edmands S.Dose parental divergence predict reproductive compatibility[J].Trends Ecol Evol,2002,17:520-527.

