植物雌激素影响鱼类生殖发育的作用机理研究进展
(中国海洋大学 海洋生命学院,山东 青岛 266003)
植物雌激素(Phytoestrogen,PE)是一类植物来源的杂环多酚类化合物,在结构和功能上与 17β-雌二醇(雌二醇)类似,能够结合雌激素受体,具有弱的雌激素活性。已发现的植物雌激素有40多种,主要分布于38科植物中,大致可归纳为10种结构类型,包括黄酮类、苯丙素类、 类、内脂或香豆素类、芳香醚类、生物碱类、三萜类、甾醇类、醌类、环酞类等,其中以异黄酮类最多,主要包括有大豆苷元、金雀异黄素、芒柄花黄素等[1]。
长期以来,因植物雌激素对乳腺癌、前列腺癌、更年期综合症、心血管病和骨质疏松等疾病有一定防治作用,在医药和保健食品中应用广泛。植物雌激素被人食用后,会转化为活性更高的雌马酚等代谢物排泄进入环境。此外,纸浆厂、木材加工厂的污水也将大量植物雌激素排放并汇集到水体中。并且,水产养殖业的发展造成对水产饲料需求的增加,鱼类饵料需要 40%~50%的蛋白,由于动物蛋白价格高,价格相对低廉的大豆蛋白就成为首选替代品,但大豆蛋白中往往富含着大豆异黄酮。因此,许多鱼类正面临着水体和食物中植物雌激素的双重暴露的威胁。许多研究表明,植物雌激素对鱼类的生殖发育具有广泛的负面效应,能影响鱼类的配子发生、性腺发育、性激素的合成、分泌等,是一类潜在的内分泌扰乱化学物质。作者就最新的植物雌激素对影响鱼类生殖发育的影响及其作用机理的研究进展进行了综述。
1 水体和饵料中的植物雌激素含量
如今鱼类生活水体中植物雌激素的污染相当严重,表1列举了世界各地的污水处理厂出水、纸浆厂废水、农田废水以及河流中的植物雌激素检测状况。从表1可见,牧场及工业废水中异黄酮类含量最高,其中金雀异黄素、大豆苷元最大浓度分别高达143.4μg/L,42.9 μg/L;工业如造纸、木材及豆类食品加工等废水中主要含金雀异黄素和β-谷甾醇,其最大浓度分别为20 μg/L和1 055 μg/L,废水处理过程也不能将其完全消除,处理后的最大浓度分别为10.5 μg/L,48.6 μg/L;生活污水处理厂出水中含有少量金雀异黄素、大豆苷元、香豆雌酚等,总植物雌激素含量为0.0002~ 0.083 μg/L;自然水体(河流、湖泊)中也含有金雀异黄素、大豆苷元、鹰嘴豆素、香豆雌酚等植物雌激素种类,其最高质量浓度均低于0.276 μg/L。
此外,随着植物蛋白被广泛添加到商业饵料中,植物雌激素也随之进入到鱼类饵料中。大豆浓缩蛋白中富含12种异黄酮类物质,其中金雀异黄素、大豆苷元质量比为5 900,1 900 μg/g[20]。鱼类饵料含40%鱼粉,如果全部由大豆蛋白替代,则金雀异黄素、大豆苷元在饵料中的理论质量比最高分别可达2 360,760 μg/g。在实际调查中,Ishibashi等[21]检测出商业鲤鱼饲料中总异黄酮质量比为 810 μg/g,商业鳟鱼饵料中质量比为80 μg/g。
2 植物雌激素对鱼类的生殖毒性
植物雌激素结构与雌二醇相似,可结合雌激素受体。大量研究表明植物雌激素对鱼类生殖发育的影响趋势也与雌二醇相似,主要表现在干扰了鱼类性激素的合成与代谢,造成鱼类性别分化的紊乱,影响鱼类的配子发生和性腺发育,降低了鱼类的生殖力,但其作用强度大大低于雌二醇,表现出较弱的雌激素活性。
2.1 对激素合成、代谢的影响
实验证实,植物雌激素和外源雌二醇均能够影响鱼体内性激素的合成与代谢,包括睾酮、雌二醇、11-羟基睾酮、孕烯醇酮、孕酮、促黄体生成激素和促卵泡激素等。Bennetau-Pelissero等[22]用含有 500,1 000 μg/g金雀异黄素的饵料喂食虹鳟鱼(Oncorhynchus mykiss)1 a,雄性个体的睾酮、孕酮及雌鱼体内促黄体生成激素和促卵泡激素水平均随着暴露浓度的增加而降低;Deborah等[23]对金鱼(Carassius auratus)腹腔注射β-谷甾醇,导致雄性金鱼血清睾酮、11-羟基睾酮以及雌性金鱼血清睾酮、雌二醇水平的显著下降,同时抑制了外源性人绒毛膜促性腺激素(HCG)对金鱼活体睾酮和孕烯醇酮的诱导;Yuliana等[24]的研究发现,1 μmol/L的大豆苷元能抑制虹鳟鱼肝脏内雌二醇的代谢,同时 1,10 μmol/L金雀异黄素的暴露下,大西洋鲑鱼(Salmo sala)和虹鳟鱼肝脏、肾脏内雌二醇的代谢受到剂量性抑制。
研究发现,植物雌激素对鱼类性激素合成、代谢的影响具有种类和性别的差异。例如,Zhang等[25]给日本青 (Oryzias latipes)腹腔注射金雀异黄素造成雌鱼血清中的雌二醇含量增加,雄鱼血清中的睾酮含量降低;而 Heiska等[26]却发现在植物甾醇混合物(含 80%的β-谷甾醇)暴露下,雄性斑马鱼(Danio rerio)血浆睾酮和 11-羟基睾酮水平均上升。此外,Catherine等[27]发现金雀异黄素食物暴露下的虹鳟鱼体内睾酮水平随着个体所处生活期的不同而产生差异。
2.2 对性别分化的影响
目前的研究发现雌二醇和植物雌激素均能影响鱼类的性别分化,引发鱼类的性逆转。有研究表明质量浓度为 1 μg/L的 17β-雌二醇即能导致半滑舌鳎(Cynoglossus semilaevis)雌性化的概率达到74%[28]。而在对植物雌激素的研究中,Scholz等[29]用 1,10 μg/L的金雀异黄素水体暴露雄性基因型的日本青幼鱼,个体性逆转的发生率分别为37%和100% ;性成熟雄性日本青 幼鱼(孵化后100 d)水体暴露于400μg/L,800 μg/L雌马酚以及 1g/L金雀异黄素中,10%,87%和12%的个体发生了性逆转,而1 g/L金雀异黄素暴露下 50%的雌性个体背鳍和臀鳍却表现出雄性特征[30];Green等[31]用含金雀异黄素 2 000,4 000,8 000 μg/g的饵料喂食尚未性别分化(孵化后5~140 d)的斑点叉尾(Ictalurus punctatus),剂量性地诱导了个体的兼性现象。
此外,植物雌激素能够影响子代鱼的性别分化。10μg/L、20μg/L 的植物甾醇混合物(含 80%β-谷甾醇)能够改变暴露组斑马鱼世代的性别比例,与外源性雌二醇能够诱导鱼体子代和亲代产生雌性化现象不同的是导致 F1和 F2代分别以雄性和雌性个体为主导[32];Yilmaz 等[33]用 50 000 μg/L 的 Genesis药物(一种植物雌激素混合物)暴露雌性非洲鲶鱼(Clarias gariepinus)时,能够显著增加子代雌鱼的比例。
2.3 对配子发生及性腺发育的影响
雌二醇和植物雌激素的暴露均能够影响鱼类的配子发生及性腺发育,直接降低鱼类的生殖力。质量浓度为1 μg/L的17β-雌二醇可导致半滑舌鳎出现卵巢分化提前和精巢分化延迟的现象[28]。在对植物雌激素的研究中,Bennetau-Pelissero等[22]用含500 μg/L,1 000 μg/g金雀异黄素的饵料喂食虹鳟鱼1 a,其配子形成受到明显抑制,雄鱼精子密度及运动能力降低,雌鱼受精率及幼鱼成活率下降;日本青 暴露于0.4 μg/L,0.8 μg/L雌马酚以及 1 000 μg/L金雀异黄素的水体中,雌性个体卵母细胞数量降低率、闭锁发生率、卵巢腔面积随着暴露浓度的增加而增大,造成卵母细胞损伤及卵巢发育异常;雄性个体出现精子密度降低、发育延迟,睾丸基质增生、组织纤维化及原始生殖细胞增生等现象,并在一定浓度范围内具有剂量效应[30];鱼类饵料中高浓度异黄酮的添加(1000 μg/g)能够显著降低雄性鲤鱼的生殖腺成熟指数[34];植物甾醇混合物(含 80%的β-谷甾醇)的暴露能够导致雄性斑马鱼精子发生加速,精母细胞和成熟精子比例失调,雌性个体卵母细胞闭锁发生率升高[26]。
2.4 对胚胎发育的影响
研究显示,雌二醇对鱼类的胚胎发育具有毒性作用,7.5 μmol/L的雌二醇就能够导致斑马鱼胚胎出现脊柱弯曲、心囊水肿等致畸效应[35]。和雌二醇类似,Kim等[36]研究发现,斑马鱼胚胎(受精后 24 h)暴露于金雀异黄素(100 μg/L,50μg/L,25 μmol/L)60 h 后,胚胎心率减缓、体长降低、死亡率升高,并具有剂量效应关系,同时在 25 μmol/L浓度组呈现出胚胎致畸效应,如围心腔水肿、卵黄囊水肿、脊骨弯曲等;Messai等[37]指出,2.5 μmol/L金雀异黄素能够诱发斑马鱼胚胎特别是后脑和脊髓前角细胞的凋亡;1,10,50 g/L植物甾醇混合物(75.7%β-谷甾醇)对河鳟(Thymallus thymallus)胚胎的暴露还能够显著缩短胚胎的孵化时间,导致幼鱼存活率降低,体积减小[38]。
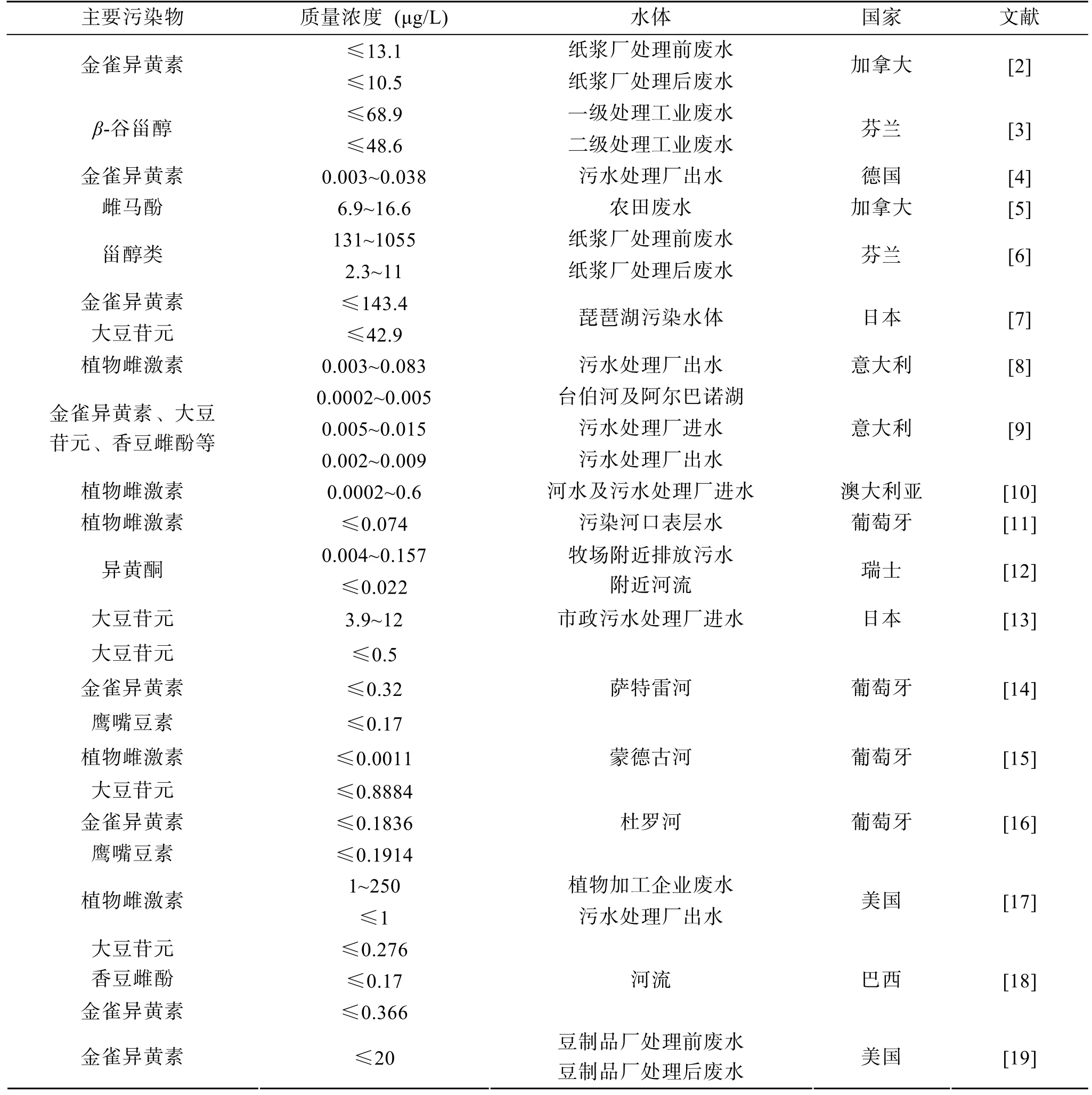
表1 植物雌激素在环境水体中的浓度
2.5 对VTG合成的影响
卵黄原蛋白(VTG)是一种广泛用于评价卵生脊椎动物体内和体外雌激素活性的生物标志物。在鱼类中,VTG在雌二醇作用下由成熟雌鱼肝细胞合成,经血液运输至卵巢,作为胚胎发育的物质和能量来源。雄鱼中同样具有vtg基因,但由于其体内仅有痕量或者无雌二醇存在,因此通常雄鱼体内VTG浓度极低甚至检测不到。大量的研究证实,外源性雌激素能够诱导雄鱼及幼鱼体内VTG的产生,因此雄鱼及幼鱼体内VTG的水平是评价雌激素效应水平的一个重要的生物标志物。与此同时,VTG和性比、性激素水平等指标一样,能够反映环境雌激素对鱼类的生殖影响,也可作为评价环境雌激素对鱼类生殖毒性的终点指标。
目前,体内和体外实验证实多种植物雌激素都能够和雌二醇一样诱导雄鱼及幼鱼体内 VTG的发生。0.5 μg/L 雌二醇 21 d即可诱导雄性泥鳅(Misgurnus anguillicaudatus(Cantor))体内VTG含量的增加[39]。然而,用富含 500 μg/g金雀异黄素的饵料喂食虹鳟鱼1 a,在雄鱼中才能检测到持续的VTG合成诱导效应[22];与此同时,暴露于10 μg/L大豆固醇和10,20 μg/L木固醇中的雌性和雄性斑马鱼血浆VTG水平有显著提高[32];Turker等[34]用含有不同质量比(250,500,1 000,10 000 μg/g)总异黄酮的饵料喂食鲤鱼 180 d,剂量性诱导了雄鱼和雌鱼幼鱼体内VTG的发生。
3 植物雌激素对鱼类的生殖毒性机制
有关雌二醇和植物雌激素作用机制的研究大多集中于哺乳动物,在鱼类中相对较少。现有的研究结果显示:植物雌激素与内源性雌激素的比例可能决定了植物雌激素发挥的作用是雌激素效应还是抗雌激素效应。而植物雌激素可能通过雌激素受体介导途径或者非受体介导途径,引发相应的反应级联,干扰鱼体性激素的合成、分泌与代谢,进一步导致胚胎发育、性别分化、性腺发育、配子生成等生殖过程的紊乱。
3.1 雌激素或抗雌激素作用
外源性雌二醇具有较强的雌激素活性,能够与内源性雌激素产生叠加的雌激素效应,与此不同的是植物雌激素则具有雌激素和抗雌激素的双重活性,当内源性雌激素缺乏时,可成为雌激素促效剂;当内源性激素水平较高时,则可成为雌激素拮抗剂。这一点在金雀异黄素中研究较为透彻。Bennetau- Pelisser等[22]指出,未成熟雌性虹鳟鱼血清中雌二醇浓度较低时,金雀异黄素显现出雌激素性,能够诱导血浆VTG水平的升高,反之,在VTG合成前期,当血清雌二醇水平升高时,金雀异黄素表现出抗雌激素性,能够显著延缓卵母细胞的成熟;Zhang等[25]研究发现青 注射中等浓度金雀异黄素(0.75 μg/条)促进了性激素的合成和释放,而在高浓度下(3 μg/条)此效应减弱,证实了金雀异黄素对性激素合成和释放的双重调节。有研究指出,植物雌激素的双重效应受到雌二醇和金雀异黄素的比率所影响,当金雀异黄素与雌二醇的比率为10~100时,能够引发两者对于 ERs的竞争性结合,占据受体结合位点,阻碍内源性雌激素与ER相结合,减弱了靶细胞对雌激素的应答,因此产生了抗雌激素效应[40]。
3.2 受体介导途径
目前的研究认为雌激素受体介导途径包括了 3种作用方式:雌激素反应元件(ERE)途径、转录因子途径、非基因介导途径[41]。雌激素反应元件途径即雌二醇或植物雌激素等配体与 ERs上的配基结合区结合,形成雌激素-受体复合体,直接结合到靶基因启动区的 ERE上,调节靶基因的转录与表达;转录因子途径即雌激素-受体复合体通过连接其他转录因子,间接结合于基因的启动区;非基因介导途径即细胞膜或细胞质中的ERs或ERs异形体被雌激素激活后发出信号,由第二信使(SM)传导信号,影响离子通道或者增加细胞质中氮氧化物水平,在没有基因调控的前提下快速发挥效应。
现有的研究结果发现鱼类VTG和性激素合成的一些关键酶是通过雌激素反应元件途径受到植物雌激素影响的,其余的几种作用方式尚未得到验证。植物雌激素与靶细胞内 ERs上的配基结合区结合,形成雌激素-受体复合体,直接结合到靶基因启动区的ERE上,调节靶基因的转录与表达。Messai等[37]研究中发现低浓度的金雀异黄素能够诱发斑马鱼前脑中芳香化酶 b基因的表达,同时金雀异黄素暴露下雌性日本比目鱼卵巢中细胞色素P450芳香化酶基因(P450arom,鱼体内雄激素向雌激素转化过程中的关键酶)mRNA的表达被诱导,而苗勒氏管抑制物基因(MIS,抑制苗勒氏管发育)mRNA的表达受到抑制,直接导致了鱼体的雌性化现象[42];此外,β-谷甾醇暴露于雄性金鱼 5周后,降低了性腺内类固醇调节蛋白(STAR)基因的转录水平,这可能导致血浆内性激素水平的降低以及血浆脂蛋白水平的变化,从而造成生殖紊乱[43]。
硬骨鱼中存在两种ERs类型,即ERα和ERβ,且有些种类中 ERβ存在两种异型体结构,称为 ERβ1和ERβ2或者ERβ和ERγ。多种硬骨鱼中ERs的cDNA片段已被克隆(表2)。鱼类 ERα和 ERβ的分布具有种间差异及组织差异,在肝脏、性腺中分布较为集中,在脑、垂体、肠道、肌肉中分布较少。
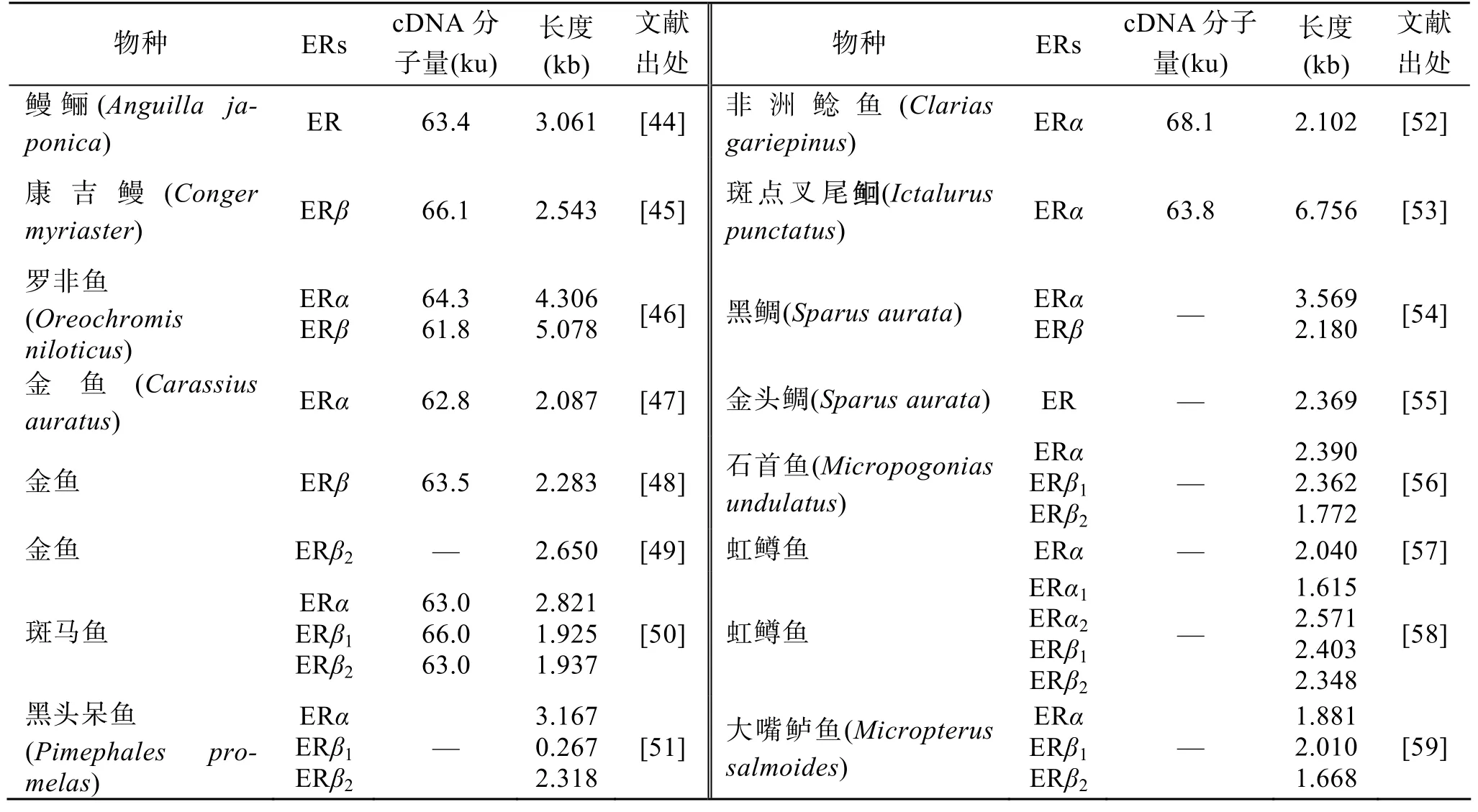
表2 硬骨鱼中ERs cDNA的结构和种类
植物雌激素对于鱼类中 ERs的两种亚型具有不同的结合力,通常对 ERβ的结合力高于 ERα,植物甾醇、黄烷酮以及查尔酮等例外,因此植物雌激素是ERβ的选择性调节剂。在对虹鳟鱼原代肝细胞的研究中发现,VTG的合成主要是通过ERβ介导[60]。玉米烯酮等植物雌激素对于ERα显示出较弱的转录活性,而对 ERβ则显示出较强的活性。金雀异黄素对ERβ的结合力是ERα的9倍[61]。17-β雌二醇对两种亚型则具有同等的结合力,由于植物雌激素对两者受体基因的转录激活水平也不同[62],因此ERα和ERβ组织分布及水平的差异决定了植物雌激素和雌二醇的雌激素效应具有不同的组织和器官特异性[63]。
与此同时,植物雌激素与鱼类 ERs的结合力还随植物雌激素种类及鱼种类的不同而存在差异。ER竞争结合试验表明,各种植物雌激素对于虹鳟鱼肝细胞内 ERs 的结合力为:雌二醇(DC50:7nmol/L)>芒柄花黄素(DC50:260 nmol/L)>金雀异黄素(DC50:570 nmol/L)>雌马酚(DC50:5.3 μmol/L)>大豆苷元(DC50:9 μmol/L)>鹰嘴豆素(DC50:100 μmol/L);对于西伯利亚鲟鱼(Acipenser baeri)肝细胞内ER的结合力为:雌二醇(DC50:5 nmol/L)>金雀异黄素(DC50:220 nmol/L)>芒 柄 花 黄 素 (DC50:1μmol/L)> 雌 马 酚 >( DC50:8.3 μmol/L)>大豆苷元>( DC50:80 μmol/L)>鹰嘴豆素(DC50:100 μmol/L)。植物雌激素与 ERs的结合力与雌激素活性的发挥有关,如诱导未成年鲟鱼和虹鳟鱼活体肝脏内VTG的发生所需饵料中的金雀异黄素含量分别为20,1 000 μg/g,即鲟鱼对于饵料中的金雀异黄素的敏感度是虹鳟鱼的50倍;虹鳟鱼ERs的结合位点数目显著高于鲟鱼,是导致结合力差异的一个原因[64]。
3.3 非受体介导途径
植物雌激素可以直接作用于性类固醇结合蛋白(SSBP)和性类固醇激素合成、代谢过程中的一些关键酶,以及影响鱼体内生物转化及代谢相关酶的活性,对鱼类的配子发生、性腺发育及其他的生殖过程产生影响。
3.3.1 类固醇信号和转导途径
除了雌激素受体介导途径以外,植物雌激素还可以通过非雌激素受体介导途径发挥效应。体外实验表明,许多植物雌激素一方面能够抑制性类固醇激素生物合成过程中的关键酶的活性,包括 17β-羟类固醇氧化还原酶Ⅰ和Ⅱ,3β-羟类固醇氧化还原酶,芳香化酶以及5α还原酶等,另一方面能够干扰性类固醇的转运,最终导致性类固醇激素的水平的改变。
在植物雌激素抑制罗非鱼体内雌二醇代谢的研究中发现,含有两个或者 3个羟基的异黄酮类能够抑制雌激素磺基转移酶(SULT)以及葡糖醛酸基转移酶(ΜGT)的活性,干扰了雌二醇代谢产物E2-17-葡糖苷酸,E2-17-硫酸盐和 E2-3-葡糖苷酸的合成[24];Pelissero等[65]研究发现,黄酮,芹菜苷元、橡黄素、二羟黄酮、萘黄酮和雌马酚都是虹鳟鱼卵巢中芳香化酶活性的强力抑制剂,鹰嘴豆素和金雀异黄素能够轻微抑制芳香化酶的活性,降低了雄激素向雌激素的转化水平。因此植物雌激素除了通过受体介导途径,也可通过非受体途径,即直接干扰芳香化酶的活性来影响雄激素向雌激素的转化过程。
体外实验还发现,香豆雌酚、玉米烯酮和鹰嘴豆素对17β-羟类固醇氧化还原酶(雌酮向雌二醇、雄甾烯二醇向睾酮转化过程的调控酶)[66],异黄酮类物质对 3β-羟类固醇氧化还原酶(催化孕烯醇酮向孕酮转化)以及木脂素、异黄酮类对 5α还原酶(5α-R,催化睾酮向 5α-二氢睾酮转化)[67]的活性均具有较强的抑制作用,能够直接干扰性激素的生物转化,并降低靶组织中内源性雌激素的利用度;在虹鳟鱼肝细胞系的研究中发现,金雀异黄素和雌马酚不仅能够干扰性类固醇结合蛋白(SSBP)的活性,而且能够剂量性地抑制SSBP和雌二醇、睾酮的结合,从而影响性激素的运输,造成体内性激素水平的下降[68]。
3.3.2 生物转化及代谢相关酶的抑制
植物雌激素能够抑制鱼体内生物转化及代谢相关酶的活性,如蛋白激酶(PKA、PKC)、DNA拓扑异构酶(TOPO)等,从而影响鱼类的生殖。
蛋白激酶(PKA、PKC)在细胞信号转导和细胞周期的调控中起着重要的作用,能够催化 ATP转出磷酸并共价结合到特定蛋白质分子中某些氨基酸的羟基上,导致蛋白质、酶的构象和活性的改变。研究发现异黄酮类物质能够抑制蛋白激酶的活性[69],同时Melamed等[70]指出PKC与GnRH的释放相关,金雀异黄素可能通过对PKC的抑制来阻碍GnRH的释放,干扰LH和FSH的释放;DNA拓扑异构酶(TOPO)是DNA复制过程中的关键酶,也能够受到金雀异黄素的强力抑制,可能阻碍鱼类生殖相关基因的正常复制,造成生殖损伤[71]。
4 展望
以上简要比较了植物雌激素和外源雌二醇对于鱼类的生殖影响及其作用机理的研究进展,由于植物雌激素对鱼类作用机理的研究较少,同时研究方法及其研究背景存在着较大差异,导致很多实验结果不相一致,植物雌激素对鱼类生殖毒性的详细作用机理尚不明确,需要大量的后续研究;其次,已开展的大部分实验中植物雌激素的暴露浓度远远超过了环境浓度的范围,无法有效地预测和评价环境中的植物雌激素对鱼类生殖产生的影响,因此在未来的研究中应当就暴露浓度、试验方法等方面统一标准,以保证实验结果能够有序地进行类比和分析;再次,针对目前污水处理废水和纸浆废水中的植物雌激素成分对鱼类生殖功能的显著影响,今后的研究应着重考虑以下几个方面:(1)进行大量的数据分析确定鱼类较为敏感的植物雌激素浓度;(2)关注种群水平的基础参数,如成熟期、孵化成功率、幼年入添数量等;(3)实验室研究应当模拟处理污水以及纸浆废水中各种化学物质的实际状况。
[1]潘瑞乐,陈迪华.植物雌激素结构类型、药理活性和临床应用 [J].国外医药(植物药分册),2002,17(4):139-143.
[2]Kiparissis Y,Hughes R,Metcalfe C,et al.Identification of the isoflavonoid genistein in bleached kraft mill effluent [J].Environ Sci Technol,2001,35(12):2423-2427.
[3]Karels A,Markkula E,Oikari A.Reproductive,biochemical,physiological,and population responses in perch (Perca fluviatilisL.) and roach (Rutilus rutilusL.)downstream of two elemental chlorine-free pulp and paper mills [J].Environ Toxicol Chem,2001,20:1517-1527.
[4]Körner W,Spengler P,Bolz U,et al.Substances with estrogenic activity in effluents of sewage treatment plants in southwestern Germany [J].Environ Toxicol Chem,2001,20(10):2142-2151.
[5]Burison B K,Hartmann A,Lister A,et al.A toxicity identification evaluation approach to studying estrogenic substances in hog manure and agriculture runoff[J].Environ Toxicol Chem,2003,22:2243-2250.
[6]Kostamo A,Holmbom B,Kukkonen J V K.Fate of wood extractives in wastewater treatment plants at kraft pulp mill and mechanical pulp mills [J].Water Res,2003,38:972-982.
[7]Kawanishi M,Takamura-Enya T,Ermawati R,et al.Detection of genistein as an estrogenic contaminant of river water in Osaka [J].Environ Sci Technol,2004,38:6424-6429.
[8]Lagana A,Bacaloni A,De Leva I,et al.Analytical methodologies for determining the occurrence of endocrine disrupting chemicals in sewage treatment plants and natural waters [J].Anal Chim Acta,2004,501:79-88.
[9]Bacaloni A,Cavaliere C,Faberi A,et al.Determination of isoflavones and coumestrol in river water and domestic wastewater sewage treatment plants [J].Anal Chim Acta,2005,531:229-237.
[10]Kang J,Price W E,Hick L A.Simultaneous determination of isoflavones and lignans at trace levels in natural waters and wastewater samples using liquid chromatography/electrospray ionization ion trap mass spectrometry [J].Rapid Commun Mass Spectrom,2006,20:2411-2418.
[11]Ribeiro C,Tiritan M E,Rocha E,et al.Development and validation of a HPLC-DAD method for determination of several endocrine disrupting compounds in estuarine water [J].J Liq Chromatogr Related Technol,2007,30(18):2729-2746.
[12]Erbs M,Hoerger C C,Hartmann N,et al.Quantification of six phytoestrogens at the nanogram per liter level in aqueous environmental samples using 13C3-labeled internal standards [J].J Agric Food Chem,2007,55 (21):8339-8345.
[13]Liu Z H,Mamoru I,Kanjo Y,et al.Profile and removal of endocrine disrupting chemicals (EDCs) in two municipal wastewater treatment plants by using an ER(AR) competitive ligand binding assay and chemical analyses [J].J Environ Sci,2009,21(7):900-906.
[14]Ribeiro C,Pardal M A,Tiritan M E,et al.Spatial distribution and quantification of endocrine-disrupting chemicals in Sado River estuary,Portugal [J].Environ Monit Assess,2009,159(1-4):415-427.
[15]Ribeiro C,Pardal M A,Martinho F,et al.Distribution of endocrine disruptors in the Mondego River estuary,Portugal [J].Environ Monit Assess,2009,149(1-4):183-193.
[16]Ribeiro C,Tiritan M E,Rocha E,et al.Seasonal and spatial distribution of several endocrine-disrupting compounds in the Douro River Estuary,Portugal [J].Arch Environ Contam Toxicol,2009,56(1):1-11.
[17]Lundgren M S,Novak P J.Quantification of Phytoestrogens in Industrial Waste Streams [J].Environ Toxicol Chem,2009,28:2318-2323.
[18]Kuster M,Azevedo D A,López de Alda M J,et al.Analysis of phytoestrogens,progestogens and estrogens in environmental waters from Rio de Janeiro (Brazil)[J].Environ Int,2009,35(7):997-1003.
[19]Ferrer I,Barberb L B,Thurmana E M.Gas chromatographic-mass spectrometric fragmentation study of phytoestrogens as their trimethylsilyl derivatives:Identification in soymilk and wastewater samples [J].J Chromatogr A,1 216(32):6024-6032.
[20]Mambrini M,Roem A J,Cravèdi J P,et al.Effects of replacing fish meal with soy protein concentrate and of DL-methionine supplementation in high energy,extruded diets on the growth and nutrient utilization of rainbow trout,Oncorhynchus mykiss[J].J Anim Sci,1999,77:2990-2999.
[21]Ishibashi H,Kobayashi M,Koshiishi T,et al.Induction of plasma vitellogenin synthesis by the commercial fish diets in male goldfish (Carassius auratus) and dietary phytoestrogens [J].J Health Sci,2002,48:427-434.
[22]Bennetau-Pelissero C,Breton B B,Bennetau B,et al.Effect of genistein-enriched diets on the endocrine process of gametogenesis and on reproduction efficiency of the rainbow troutOncorhynchus mykiss[J].Gen Comp Endocrinol,2001,121:173-187.
[23]Deborah L,Maclatchy,Clen J,et al.The phytoestrogenβ-sitosterol alters the reproductive endocrine status of Goldfish [J].Toxicol Appl Pharmacol,1995,134:305-312.
[24]Yuliana Ng,Hanson S,Malison J A,et al.Genistein and other isoflavones found in soybeans inhibit estrogen metabolism in salmonid fish [J].Aquaculture,2006,254:658-665.
[25]Zhang L,Khan I A,Foran C M.Characterization of the estrogenic response to genistein in Japanese medaka(Oryzias latipes) [J].Comp Biochem Physiol C:Toxicol Pharmacol,2002,132:203-211.
[26]Christianson-Heiska I,Smeds P,Granholm N,et al.Endocrine modulating actions of a phytosterol mixture and its oxidation products in zebrafish (Danio rerio) [J].Comp Biochem Physiol C:Toxicol Pharmacol,2007,145:518-527.
[27]Catherine B P,Breton B,Bennetau B,et al.Effect of-genistein-enriched diets on the endocrine process of gametogenesis and on reproduction efficiency of the rainbow troutOncorhynchus mykiss[J].Gen Comp Endocrinol,2001,121:173-187.
[28]张晓彦,刘海金.17β-雌二醇对半滑舌鳎性分化和生长的影响 [J].东北农业大学学报,2009,6:67-72.
[29]Scholz S,Gutzeit H O.Lasting effects of xeno- and phytoestrogens on sex differentiation and reproduction of fish [J].Environ Sci,2001,8:57-73.
[30]Kiparissis Y,Balch G C,Metcalfe T L,et al.Effects of the isoflavones genistein and equol on the gonadal development of Japanese medaka (Oryzias latipes) [J].Environ Health Perspect,2003,111:1158-1163.
[31]Green C C,Kelly A M.Effects of the estrogen mimic genistein as a dietary component on sex differentiation and ethoxyresorufin-O-deethylase (EROD) activity in channel catfish (Ictalurus punctatus) [J].Fish Physiol Biochem,2009,35(3):377-384.
[32]Nakari T,Erkomaa K.Effects of phytosterols on zebrafish reproduction in multigeneration test [J].Environ Pollut,2003,123:267-273.
[33]Yılmaz1 E,Çek S,Mazlum Y.The Effects of Combined Phytoestrogen Administration on Growth Performance,Sex Differentiation and Body Composition of Sharptooth CatfishClarias gariepinus(Burchell,1822) [J].Turk J Fish Aquat Sci,2009,9:33-37.
[34]Turker H,Bozcaarmutlu A.Effect of Total Isoflavones Found in Soybean on Vitellogenin.Production in Common Carp [J].Kafkas Univ Vet Fak Derg,2009,15(4):561-568.
[35]赵宝全,董武,王思珍,等.17β-雌二醇对斑马鱼初期胚体节形成影响的研究[J].中国比较医学杂志,2005,15(1):17-20.
[36]Kim D J,Seok S H,Baek M W,et al.Developmental toxicity and brain aromatase induction by high genistein concentrations in zebrafish embryos [J].Toxicol Mech Methods,2009,19(3):251-256.
[37]Sassi-Messai S,Gibert Y,Bernard L,et al.The Phytoestrogen Genistein Affects Zebrafish Development through Two Different Pathways [J].PLoS One,2009,4(3):4935.
[38]Honkanen J O,Kostamo A,Kukkonen J V K.Toxicity of a phytosterol mixture to grayling (Thymallus thymallus) during early developmental stages [J].Arch Environ Contam Toxicol,2005,48:391-396.
[39]吕雪飞,周群芳,宋茂勇,等.17β-雌二醇、壬基酚及其混合物对雄性泥鳅的雌激素效应 [J].科学通报,2007,52(18):2122-2126.
[40]Aldercreutz H,Goldin B R,Borbach S L,et al.Soybean phytoestrogen intake and cancer risk [J].J Nutr,1995,125:757-770.
[41]Heldring N,Pike A,Andersson S,et al.Estrogen Receptors:How Do They Signal and What Are Their Targets [J].Physiol Rev,2007,87:905-931.
[42]杨隽,郭红卫,仲伟鉴,等.三羟基异黄酮对日本比目鱼(牙鲆)性腺分化的影响 [J].环境与职业医学,2006,23(6):474-478.
[43]Sharpe R L,Woodhouse A,Moon T W,et al.β-sitosterol and 17β-estradiol alter gonadal steroidogenic acute regulatory protein (StAR) expression in goldfish,Carassiu auratus[J].Gen Comp Endocrinol,2007,151:34-41.
[44]Todo T,Adachi S,Yamauchi K.Molecular cloning and characterization of Japanese eel estrogen receptor cDNA [J].Mol Cell Endocrinol,1996,119:37-45.
[45]Mikawa N,Utoh T,Horie N,et al.Cloning and characterization of vitellogenin cDNA from the common Japanese conger (Conger myriaster) and vitellogenin gene expression during ovarian development [J].Comp Biochem Physiol B:Biochem Mol Biol,2006,143(4):404-414.
[46]Chang X T,Kobayashi T,Todo T,et al.Molecular cloning of estrogen receptors alpha and beta in the ovary of a teleost fish,the tilapia (Oreochromis niloticus) [J].Zool Sci,1999,16:653-658.
[47]Choi C Y,Habibi H R.Molecular cloning of estrogen receptorαand expression pattern of estrogen receptor subtypes in male and female goldfish [J].Mol Cell Endocrinol,2003,204:169-177.
[48]Tchoudakova A,Pathak S,Callard G V.Molecular cloning of an estrogen receptorβsubtype from the goldfish,Carassius auratus[J].Gen Comp Endocrinol,1999,113:388-400.
[49]Ma C H,Dong K W,Yu K L.cDNA cloning and expression of a novel estrogen receptorβ-subtype in goldfish (Carassius auratus) [J].Biochim Biophys Acta,2000,1 490:145-152.
[50]Menuet A,Pellegrini E,Anglade I,et al.Molecular characterization of three estrogen receptor forms in zebrafish:binding characteristics,transactivation proper-ties,and tissue distributions [J].Biol Reprod,2002,66:1881-1892.
[51]Filby A L,Tyler C R.Molecular Characterization of Estrogen Receptors 1,2α,and 2βand Their Tissue and Ontogenic Expression Profiles in Fathead Minnow(Pimephales promelas) [J].Biol Reprod,2005,73:648-662.
[52]Teves A C C,Granneman J C M,Van Dijk W,et al.Cloning and expression of a functional estrogen receptor-αfrom African catfish (Clarias gariepinus) pituitary [J].J Mol Endocrinol,2003,30:173-185.
[53]Xia Z,Patino R,Gale W L,et al.Cloning,in vitro expression,and novel phylogenetic classification of a channel catfish estrogen receptor [J].Gen Comp Endocrinol,1999,113:360-368.
[54]Socorro S,Power D M,Olsson P E,et al.Two estrogen receptors expressed in the teleost fish,Sparus aurata:cDNA cloning,characterization and tissue distribution[J].J Endocrinol,2000,166:293-306.
[55]Munoz-Cueto J A,Burzawa-Gerard E,Kah O,et al.Cloning and sequencing of the gilthead sea bream estrogen receptor cDNA [J].DNA Sequence,1999,10:75-84.
[56]Hawkins M B,Thornton J W,Crews D,et al.Identification of a third distinct estrogen receptor and reclassification of estrogen receptors in teleosts [J].Proc Natl Acad Sci USA,2000,97:10751-10756.
[57]Pakdel F,Metivier R,Flouriot G,et al.Two estrogen receptor (ER) isoforms with different estrogen dependencies are generated from the trout ER gene.Endocrinology,2000,141(2):571-580.
[58]Nagler J,Cavileer T,Sullivan J,et al.The complete nuclear estrogen receptor family in the rainbow trout:discovery of the novel ERα2and both ERβisoforms [J].Gene,2007,392:164-173.
[59]Sabo-Attwood T,Kroll K J,Denslow N D.Differential expression of largemouth bass (Micropterus salmoides)estrogen receptor isotypes alpha,beta,and gamma by estradiol [J].Mol Cell Endocrinol,2004,218(1-2):107-118.
[60]Leaños-Castañeda O,Van Der Kraak G.Functional characterization of estrogen receptor subtypes,ERαand ERβ,mediating vitellogenin production in the liver of rainbow trout [J].Gen Comp Endocrinol,2009,161(1):73-78.
[61]Barkhem T,Carlsson B,Nilsson Y,et al.Differential response of estrogen receptor alpha and estrogen receptor beta to partial estrogen agonists/antagonists [J].Mol Pharmacol,1998,54:105-112.
[62]Domstauder E,Jisa E,Unterrieder I,et al.Estrogenic activity of two standardized red clover extracts (menoflavon) intended for large scale usein hormone replacementtherapy [J].J Steroid Biochem Mol Biol,2001,78(1):67-75.
[63]Belcher S M,Zsamovszky A.Estrogenic action in the brain:estrogen,phytoestrogen,and rapid intracellular signaling mechanisms [J].J Pharmacol Exp Ther,2001,299(2):408-414.
[64]Latonnelle K,Fostier A,Le Menn F,et al.Binding affinities of hepatic nuclear estrogen receptors for phytoestrogens in rainbow trout (Oncorhynchus mykiss)and Siberian sturgeon (Acipenser baeri) [J].Gen Comp Endocrinol,2002,129:69-79.
[65]Pelissero C,Lenczowski M,Chinzi D,et al.Effects of flavonoids on aromatase activity,an in vitro study [J].J Steroid Biochem Mol Biol,1996,57:215-223.
[66]Krazeisen A,Breitling R,Möller G,et al.Phytoestrogens inhibit human 17-hydroxysteroid dehydrogenase type 5 [J].Mol Cell Endocrinol,2001,171:151-162.
[67]Evans B A,Griffiths K,Morton M S.Inhibition of 5a-reductase in genital skin fibroblasts and prostate tissue by dietary lignans and isoflavonoids [J].J Endocrinol,1995,147(2):295-302.
[68]Bennetau-Pelissero C,Flouriot G,Valotaire Y,et al.Induction of rainbow trout estradiol receptor (rtER)mRNA and vitellogenin (rtVTG) mRNA by phytoestrogens in hepatocyte cultures [J].Ann N Y Acad Sci,1998a,839:600-601.
[69]Osada H,Magae J,Watanabe C,et al.Rapid screening method for inhibitors of protein kinase C[J].J Antibiot,1988,41:925-930.
[70]Melamed P,Rosenfeld H,Elizur A,et al.Endocrine regulation of gonadotropin and growth hormone gene transcription in fish [J].Comp Biochem Physiol C:Toxicol Pharmacol,1998,119:325-338.
[71]Kurzer M S,Xu X.Dietary phytoestrogens [J].Annu Rev Nutr,1997,17:353-381.

