刀鲚、凤鲚和湖鲚矢耳石的形态学比较研究
姜 涛,杨 健,刘洪波,沈新强
(1.上海海洋大学 水产与生命学院,上海 201306;2.中国水产科学研究院 淡水渔业研究中心,中国水产科学研究院 内陆渔业生态环境与资源重点开放实验室,江苏 无锡 214081;3.中国水产科学研究院 东海水产研究所,上海 200090)
鲚属(Coilia)鱼类隶属于鲱形目 科(Engraulidae),其中刀鲚(Coilia nasus)和凤鲚(Coilia mystus)为其中的两种重要的经济鱼类。刀鲚分为洄游型和定居型两类,其中洄游型主要分布于长江、钱塘江、瓯江口等地区;定居型(常被称为湖鲚Coilia nasus taihuensis)主要分布在太湖、巢湖等长江下游湖泊中[1]。刀鲚资源由于过度捕捞和水体污染而日益匮乏[2-4],小型化、低龄化、种群结构简单化现象也日益严重[5]。凤鲚主要分布于中国东南沿海,其又可以分为长江、钱塘江等几个生态型[6]。其中长江凤鲚是目前长江口地区唯一能形成鱼讯的经济类渔获对象。但是由于连年的高强度捕捞以及天然产卵场破坏和水体的污染使凤鲚个体小型化、资源量下降严重[7,8]。如何更好地利用和保护凤鲚以及刀鲚资源已成为当前重要的课题。
迄今,对于刀鲚、凤鲚、湖鲚形态的分类标准尚存不足,如刀鲚和凤鲚在外部形态上较为相近,传统的区分手段主要通过臀鳍条数和纵列鳞数等,但这些可数性状存在重复和交叉[9];同时,由于主要采用的是鱼体外部形态的数据,其与鱼体生理条件关系密切,变异较多;再有,对于湖鲚是否可以作为一个亚种仍存争议[10-12]。耳石是一种位于鱼体内耳前庭区,用于听觉和身体平衡的硬组织,是硬骨鱼类中最先钙化的结构。鱼体内一共有3对耳石,其中较大的一对为矢耳石(sagitta),其余两对为星耳石(asteriscus)和微耳石(lapillus)。耳石的主要成分为碳酸钙(CaCO3)并含有有机物及一些微量元素,一旦形成很少发生再吸收现象,比较稳定[13]。 近年来,不同种属、种群间耳石形态存在着差异的现象逐渐得到重视,且被尝试用于鱼类的鉴别之中[14-17]。耳石形态除了与种属有关,也与其生活环境有关[16]。利用这点可以尝试进行鱼类的种群结构分析,地理种群鉴别等研究。目前针对鲚属鱼类的耳石形态分析很少[9,18],且主要涉及种间耳石某些可量数据的比较,而对于种内不同地理群的形态结构分析尚缺。另外,上述研究均需要将耳石碾磨至核心暴露的状态。这种人为的前处理有可能导致耳石上一些结构和形态特征的损失,值得引起注意。再有,研究刀鲚、凤鲚等“海-江”洄游性鱼类的种群结构和动态较为困难,且报道较少[4,19],不同水域群体的差异性和关联性尚不明了。如果能利用既与鱼类生活环境相关,又比较稳定的耳石结构作为鉴别的标准,将有望提高种内和种间群体的判别的效率。借鉴国内外耳石形态学的种群判别的经验[16,18,20-21],本研究尝试测量凤鲚、湖鲚以及不同采样水域刀鲚个体的耳石形态、结构特征,归纳出可用于比较的耳石形态总体测量框架,在研究种间、种内耳石形态差异性的基础上,验证该框架体系的可行性;一方面为今后尝试基于耳石形态进行刀鲚、凤鲚、湖鲚鉴别提供理论基础;另一方面,为了解不同水域刀鲚群体间的相互关联性,从而更合理地利用和保护其资源提供可能的技术支撑。
1 材料与方法
1.1 材料
本研究中的刀鲚标本采自长江口崇明岛(30尾,体长 26.3~30.5cm)、152海区 4区(32尾,体长25.6~31.2cm)、瓯江口(18 尾,体长 14.1~32.1cm)水域;凤鲚标本采自浙江省舟山市定海区金塘镇北部水域(30尾,体长11.6~23.9cm);湖鲚个体采自太湖平台山水域(30尾,体长 10.3~15.5cm)(表1)。取样点如图1所示。

表1 刀鲚、凤鲚和湖鲚的采样资料Tab.1 Sampling details of Coilia mystus,Coilia nasus taihuensis,and Coilia nasus
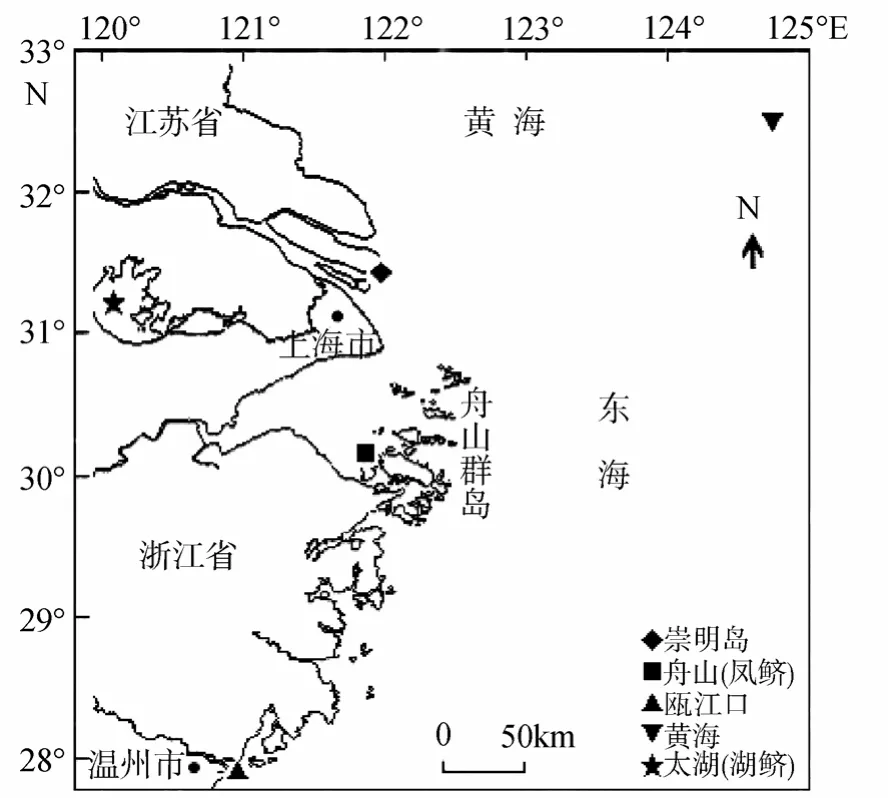
图1 刀鲚、凤鲚和湖鲚的采样水域Fig.1 Map of the sampling waters of Coilia mystus,Coilia nasus taihuensis,and Coilia nasus
1.2 方法
1.2.1 耳石标本的前处理
自刀鲚内耳附近取出矢耳石,于去离子水中去除外包膜以及黏液后于培养皿内自然晾干。待晾干后,将耳石近轴面向上,远轴面向下,背部朝上置于解剖镜下拍摄整体形态。
1.2.2 耳石形态测量框架
由于刀鲚矢耳石的形态最为复杂,为更全面地进行形态学描述和测量,本研究参考郭弘艺[9]和张波等[15]的方法先对刀鲚矢耳石各部分进行了定义(图2):翼叶:耳石前端、背侧的突起;基叶:耳石前端、腹侧的突起;主间沟:翼叶和基叶间的凹陷;背侧突起:耳石背侧突起;腹侧突起:耳石腹侧突起;主凹槽:耳石近轴面表面,自主间沟开始延伸的凹槽。凤鲚和湖鲚的再参照其定义对应的部分。
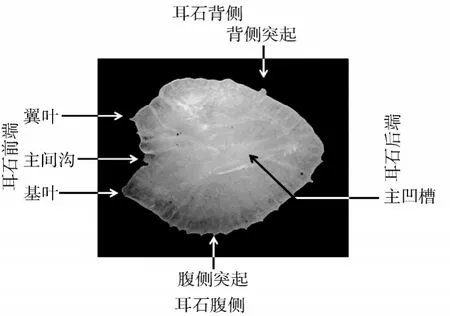
图2 刀鲚右矢耳石内侧面特征Fig.2 Medial surface view of right sagittal otolith of Coilia nasus
参考 Turan[17]所使用的测量框架以及上述耳石术语设置耳石测量框架。如图3利用IPP6.0软件测量端点(P1-P6)之间距离获得 12组形态数据(D1~D12),由于鲚耳石在后部较尖,所以选用并除以 D3去除耳石形态大小的影响获得11组处理后数据。所得11组数据利用SPSS 18.0进行方差分析、判别分析以及聚类分析。
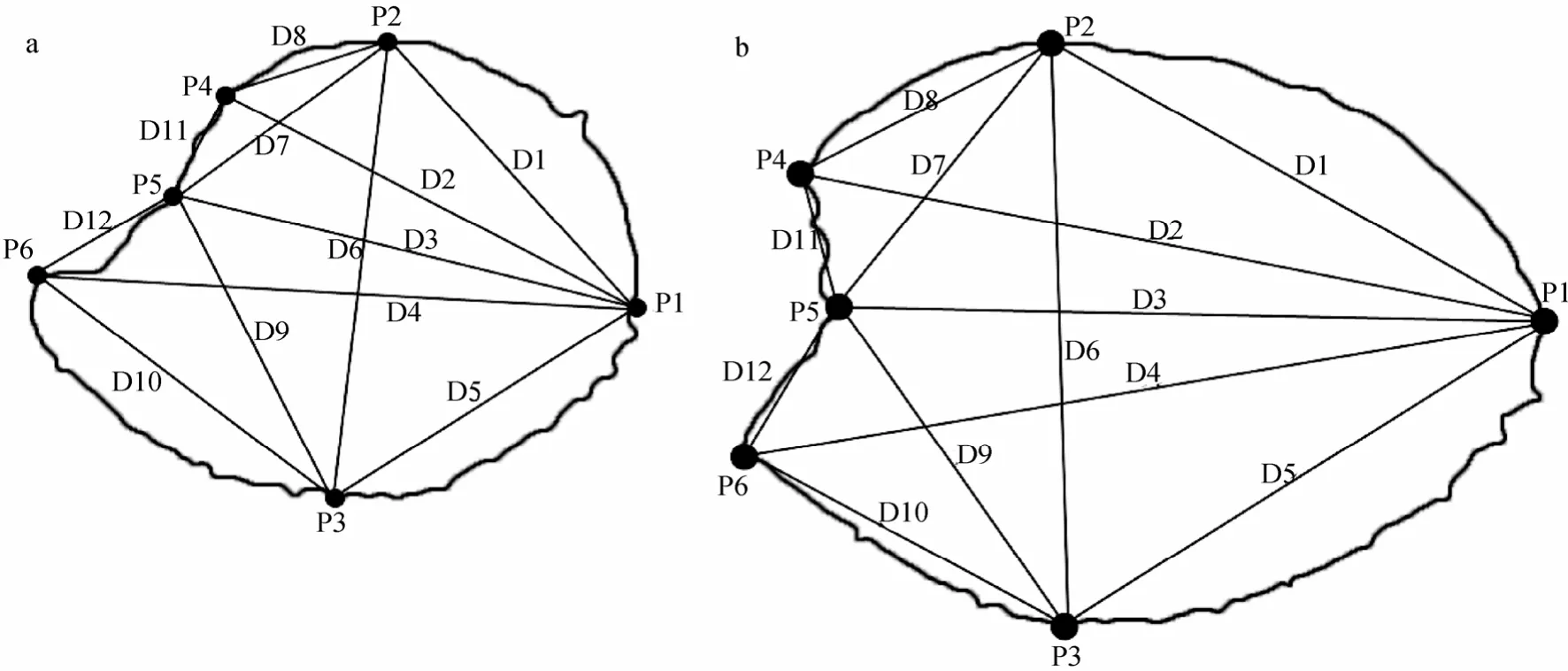
图3 耳石测量框架Fig.3 Truss networks for the otolith distance measurements
2 结果
2.1 耳石形态
表2所示为测量的11组数据,其中除D5/D3其余11组数据差异显著(one-way ANOVA,P<0.01)。本研究中,刀鲚、湖鲚和凤鲚 3者耳石形态之间除D5/D3差异不显著(P=0.414)外,其他参数均极其显著(P<0.01)。其中刀鲚和湖鲚之间除了 D4/D3、D5/D3、D10/D3和 D11/D3,刀鲚和凤鲚之间除了D5/D3,湖鲚和凤鲚之间除了D5/D3和D8/D3外,其余参数均差异显著(P<0.01)。仅从刀鲚来看,崇明刀鲚和黄海刀鲚之间各项参数均不显著(P>0.05),但它们与瓯江口刀鲚之间除 D1/D3、D2/D3、D5/D3和D8/D3之外,其余参数均差异显著(P<0.01)。
凤鲚、刀鲚和湖鲚耳石形态一般呈现为:耳石较扁,呈椭圆形,一侧分叉,耳石背向体轴弯曲,主凹槽不封闭,腹侧突起较多,多为三角状和晶状,一些样本在背侧靠近后端处有一明显晶杆状突起,主凹槽和基叶较稳定。
刀鲚耳石(图4a、b、c)翼叶较明显,与基叶大小相当,耳石后端较凤鲚尖锐,主间沟明显,后背角和腹部平坦,耳石中心靠前端,基叶腹端突出不明显。本研究所采集的个体中瓯江口刀鲚和崇明、黄海刀鲚耳石在耳石基叶上差异明显表现为基叶较后两者发达,其与刀鲚其他种群差异主要在于耳石前部的D6/D3、D7/D3、D10/D3和D11/D3。其中D6/D3和D7/D3较大,使得耳石形态较高、耳石背侧部分较腹侧部分大;D11/D3较大使得翼叶较靠近背部;D10/D3较大使得其基叶较为发达。
凤鲚耳石(图 4d)较刀鲚和湖鲚耳石厚,翼叶不明显,基叶较突出,后端钝圆,背侧较光滑少突起,主间沟较不明显,后背角向后突出倾斜,腹部突出明显,耳石重心靠后端,基叶腹端突出明显。其与刀鲚主要差异在于 D1/D3、D2/D3、D6/D3、D7/D3、D10/D3和D11/D3。其中D1/D3和D2/D3较小使得耳石背部较短,向背后端突出明显;D1/D3、D5/D3较小和 D6/D3较大使得耳石后端较短,比较钝圆;D7/D3和D11/D3较大反应为耳石翼叶靠背向且突出不明显;D5/D3较小使得腹前端较小,D10/D3较大反应为腹部向外突出明显,样本内部D5/D3和D10/D3差异较刀鲚小,腹部前后端大小相近,耳石基叶突出显著。
湖鲚耳石(图 4e)翼叶较凤鲚明显,但与刀鲚相比较小,主间沟较不明显,后端较刀鲚钝圆但不及凤鲚,后背角略向后突出倾斜,腹部较为突出。其与刀鲚耳石形态主要差异在于耳石背侧的 D1/D3、D2/D3、D7/D3。其中 D1/D3、D2/D3较小,使得P1P2P4构成的耳石背侧三角较短,整个背上角部分向后突出;D7/D3较大和D11/D3较小使得翼叶突出较不明显(图4)。
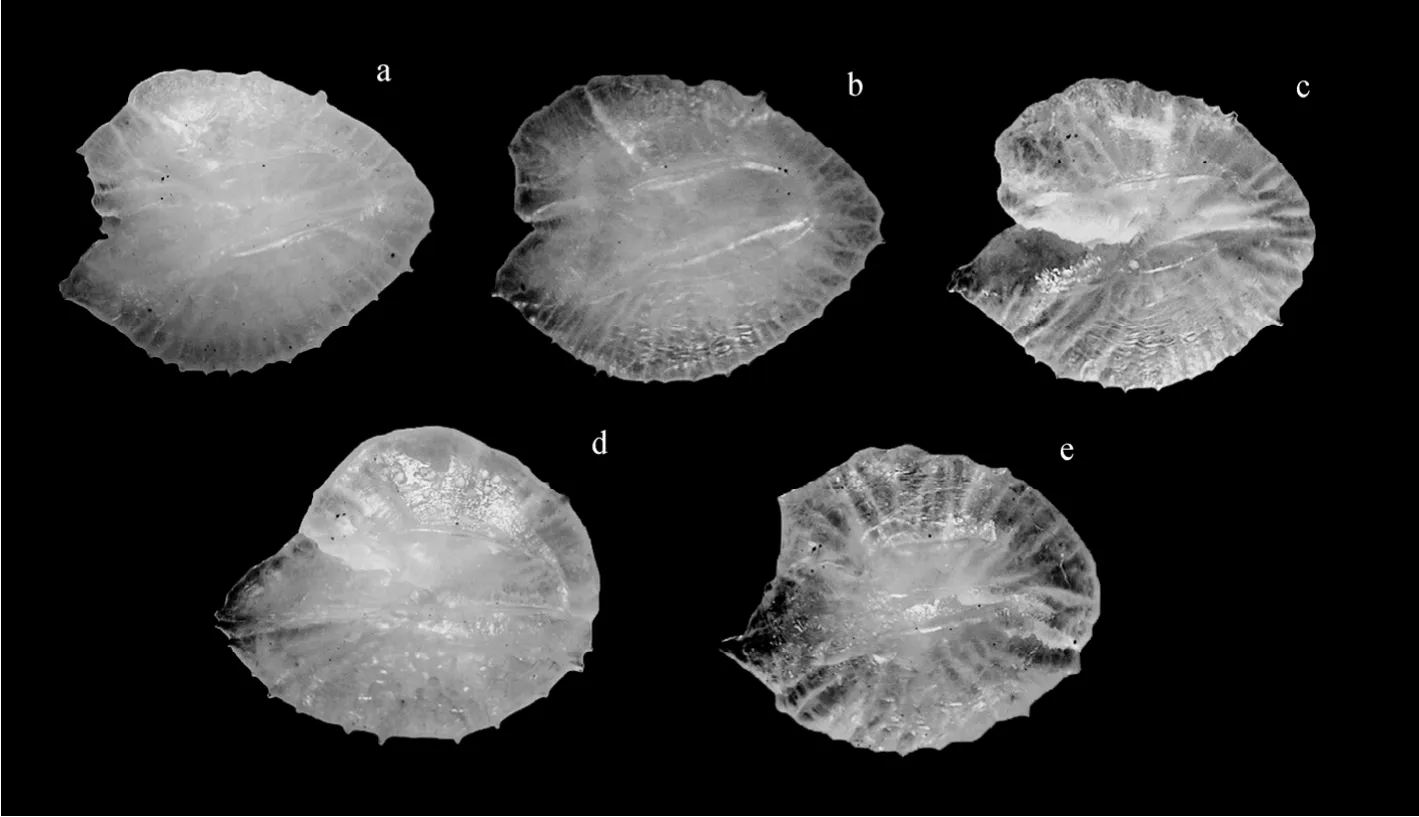
图4 刀鲚、凤鲚和湖鲚的右耳石Fig.4 Right otoliths of Coilia mystus,Coilia nasus taihuensis,and Coilia nasus

表2 凤鲚、刀鲚和湖鲚耳石测量端点间距离的比值(平均值±标准差)Tab.2 Ratios of the otolith distance measurements in Coilia mystus,Coilia nasus taihuensis and Coilia nasus(mean±SD)
2.2 耳石的种间和种内差异
为分析刀鲚、凤鲚和湖鲚耳石形态上差异,讨论测量框架的客观准确性,建立典型判别函数得点图(图5),并进一步从11组形态数据中获取了对判别贡献度最大的 4组数据(D2/D3、D4/D3、D11/D3和D12/D3),建立了典型Fisher判别函数:


258.380 D11/D3-1024.124 D12/D3-1361.756为讨论刀鲚不同地区种群间的差别,利用11组形态数据对其进行判别分析,获取了贡献度最大 3组数据(D1/D3、D5/D3和 D6/D3),并建立了 Fisher判别函数:

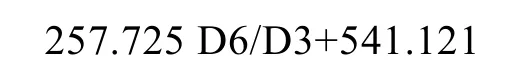
将各组数据代入 Fisher判别函数获得函数值。以最大函数值所对应的类别项作为判别结果,并用其对样品进行验证。其中对于凤鲚样品和湖鲚样品代入判别函数后能准确判别,其正确率可达100%。刀鲚样品代入判别函数后能正确判别为刀鲚样品的为94.3%,仅有5.7%(4尾)可能被误判为湖鲚样品(皆为瓯江口刀鲚)(表3)。刀鲚各地区种群间存在误判,其中崇明刀鲚的判别准确率在 73.3%,其中 3.3%误判为瓯江口刀鲚,23.4%误判为黄海刀鲚;瓯江口刀鲚的判别准确率在 83.3%,其中 5.6%误判为崇明刀鲚,11.1%误判黄海刀鲚;黄海刀鲚的判别准确率在56.25%,其中31.25%误判为崇明刀鲚,13.5%误判瓯江口刀鲚(表3)。典型判别函数图显示(图5a),刀鲚、湖鲚和凤鲚群体组质心相距较远,在函数 1(x轴)方向上即可以明显地识别出刀鲚,湖鲚和凤鲚样品,在函数2(y轴)方向上刀鲚和凤鲚样品距离较近而湖鲚与两者之间有一定距离。图 5b所示为刀鲚各地区种群典型函数判别分析结果;在函数 1*(x轴)上崇明刀鲚和黄海刀鲚距离较近而瓯江口刀鲚与之相距甚远,在函数 2*(y轴)上崇明刀鲚和瓯江口刀鲚之间的距离较黄海刀鲚的距离要近;此外,崇明刀鲚和黄海刀鲚在两个方向上皆存在很大程度上的混杂。

表3 耳石形态判别分析对所观测刀鲚、凤鲚和湖鲚的预测分类及准确率Tab.3 Predicted classification and the correct rate of discriminant function analysis based on the otolith distance measurements of Coilia mystus,Coilia nasus taihuensis and Coilia nasus
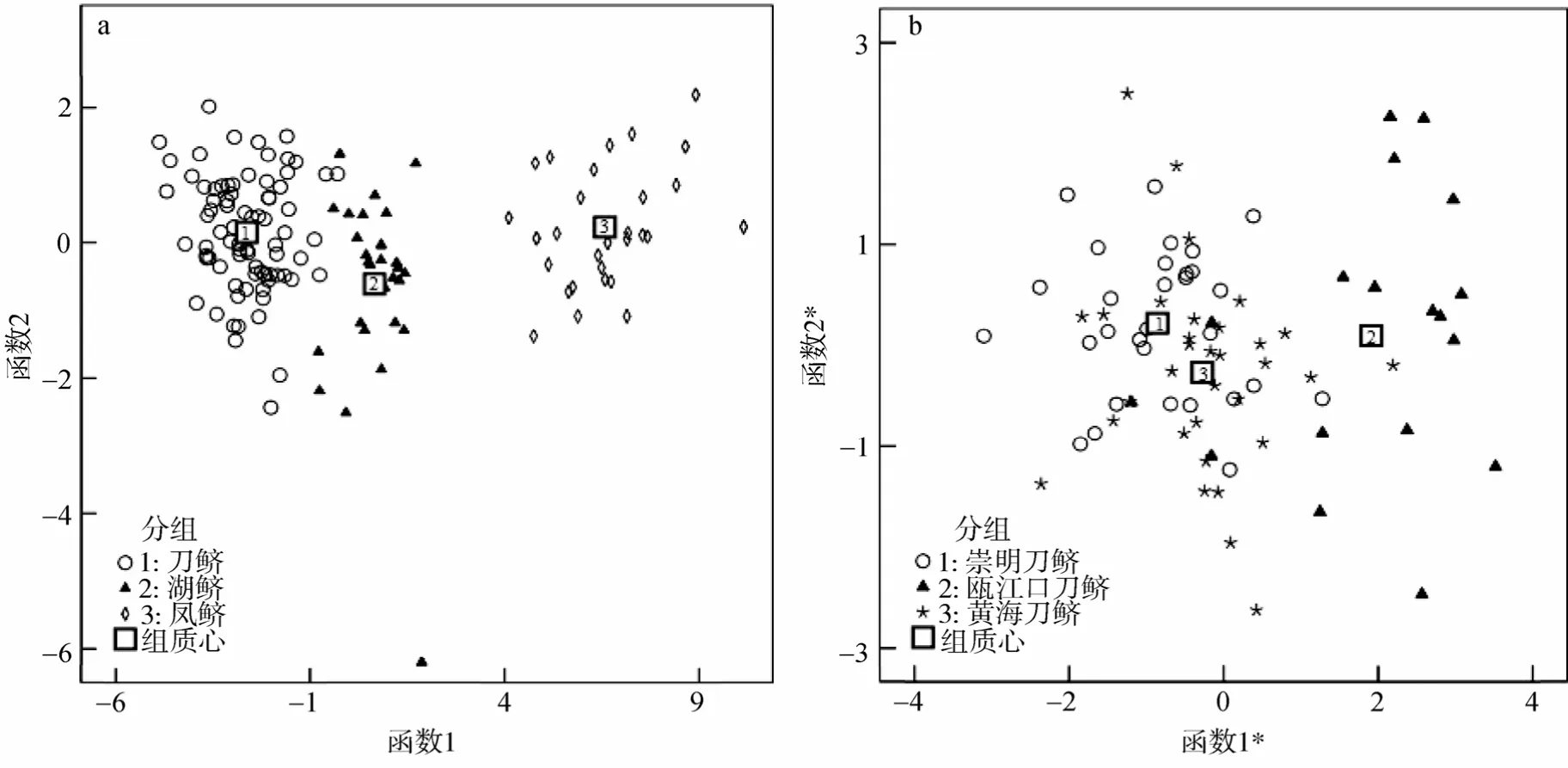
图5 耳石形态的典型函数判别结果Fig.5 Canonical plot scores from discriminant function analysis of otolith morphological measurements
使用层次聚类分析讨论以上11组数据,讨论凤鲚、刀鲚各地理种群以及湖鲚间种群内及种群外的关系。聚类方法为组间连接,以欧式距离衡量个体之间距离(图6)。其中CMCE和ZSCE聚为第一小类其个体距离为0.051;OJCE和第一小类聚为第二小类,其距离为0.128;CET和第二小类聚为第三小类,其距离为0.149;ZSCM和前面的第三小类间的距离为0.25。

图6 刀鲚、凤鲚与湖鲚耳石形态的聚类分析结果Fig.6 The dendrogram for hierarchical cluster analysis by morphology on the sagittal otolith of Coilia mystus,Coilia nasus taihuensis and Coilia nasus
3 讨论
3.1 耳石形态测量框架的选择
耳石框架的选择的基本即需要最大程度上反映耳石的真实情况。传统形态学的测量方法主要分析的是耳石的长、高等并不能完全反映耳石的特征;另一些研究方法需要围绕着耳石核心展开框架[9,16,18]。其优点在于有一个公共参考的基点,可以精确地分析耳石形态特征,同时可以为耳石形态研究设定一个统一的框架,但其局限性也同样存在。根据笔者对比原始状态和碾磨至核心暴露状态耳石的经验发现:(1)以耳石核心为基点的分析的框架主要是从耳石核心出发,框架中很多数据是耳石形态内数据对于耳石形态的整体信息有一定程度上的损失;(2)由于这种框架的重点在于耳石核心,而并不能保证不同样品间剖面方向上的统一,存在相当程度上的误差,不利于分析,可能发生有的样品在磨至核心时其一边已经损失很多而另一边尚在固定的树脂中;(3)耳石核心的剖磨处理相对而言比较复杂,对于某些特殊的鱼类耳石,核心磨出时其耳石轮廓不能获得或者已经缺损(例如耳石边缘上的晶状突起和某些形状比较特殊,核心向外凸出的耳石);(4)笔者在分析刀鲚幼鱼的工作中发现对于耳石较小的样品(如仔稚鱼)而言,由于其个体较小,边缘上的形态特征在碾磨过程中更容易被破坏。
为了避免上述局限性,本研究选择了对原始状态下的耳石进行测量,以获取其形态信息的方法。目前比较普遍的相关测量方法多为构建一个耳石整体形态的测量框架,获得一系列可以比较的形态学特征数据[14,17,23]。其共同点在于直接从耳石全形态上构建测量框架,尽量避免人为加工和操作所带来的误差。本研究中所使用的测量框架主要是基于统一类型的耳石其特征一致或者相近,从而利用其形态上的共同的“特征点”(远端点或者是曲率拐点)进行耳石形态上的抽象和归纳。其优点在于不用对耳石进行多余的处理操作,只需要拍照后使用软件进行形态测量即可分析判断;此外从框架与耳石的符合度来看也不难发现使用这种方法所得出的框架能更好地反映耳石的整体形态特点。其缺点在于“特征点”的选择,如何获取共同的特征点,客观地反映耳石形态特征避免人为选择误差是主要的问题;此外,耳石形态测量有多种框架,需要选择一种简单并能分别耳石形态差异的框架。本研究所使用的框架主要参考Turan[17]。在耳石形态上刀鲚、凤鲚和湖鲚与地中海竹 鱼(Trachurus mediterraneus)形态类似,都为类椭圆形、前端分叉、基叶、翼叶和主间沟明显,形态轮廓上较为相似。不过凤鲚、湖鲚和刀鲚耳石后端较尖锐,故本实验中考虑将后端点合并为一个端点。
本研究使用 D3作为去除耳石大小差异的标准,而不是使用传统意义上耳石全长和鱼体长来进行标准化,主要是基于两点考虑:(1)如果没有获取耳石核心位置,则耳石全长的测量存在相当的误差,因为耳石长轴长通常取耳石中心到最后端的垂直距离加上耳石中心到最前端的垂直距离[18],在没有出现耳石核心的情况下对于耳石长轴的测量出现误差的可能性很大;若先碾磨出耳石核心,则很难获经过耳石核心的水平面,这使得所测量的数据误差较大;此外对于某些特殊样品,其碾磨后对于耳石形态的破坏程度较大不能有效地反应出耳石形态上的信息;(2)鱼体本身的数据受到其生理各方面条件的影响,变异程度较大,利用耳石进行种群分析除了其种间和种内的差异之外,主要就是利用耳石形成的稳定性,故此考虑使用耳石形态本身的数据作为参考标准更为客观。从本研究得结果来看,笔者确定的耳石测量框架能相对准确、全面地反映所研究鱼类耳石形态的信息。
3.2 耳石形态差异的种间和种内比较
从耳石照片以及判别的结果不难发现刀鲚不同种群、凤鲚和湖鲚存在较大程度上的差异。刀鲚耳石整体形态特点为后端较尖,背部和腹部曲线有明显拐点,以D6为分界线可见前部明显小于后部,中央沟明显,有明显基、翼叶且大小相近,突出较为平滑不似凤鲚般突然伸出。凤鲚在耳石形态上主要的特征为耳石后端比较钝圆,背部和腹部的曲线没有明显的曲率变化,背、腹部端点比较靠近后部,以D6为分界线可见前部和后部较均衡,中央沟不明显,基叶明显前端突出,翼叶不明显。聚类结果(图6)也可以发现两者间距离明显。
湖鲚是否可以作为一个亚种还存有争议。从本研究中可以发现,其耳石形态与刀鲚洄游类型的瓯江口、崇明以及黄海群体有明显的差异。其主表现在湖鲚两叶中间呈弧状,多数样品没有明显的中央沟,两叶较其他种群不明显,后端较钝湖鲚形态特征。比较与刀鲚形态,其相似点在于腹部(D4/D3、D5/D3和D10/D3)性状较近,其差异在于刀鲚洄游群体间两叶种间呈三角状,中央沟较明显,有的样品具有中央突,后端较尖。研究结果表明湖鲚和刀鲚差异明显,其耳石形态不存在介于两者之间的误判点(除瓯江刀鲚)(图5),形态聚类分析也反映了刀鲚不同采样地群体间的差异,这说明本研究中的个体应该不存在洄游型刀鲚滞留于淡水湖泊或者湖鲚进入通海河道后进入海洋与洄游型刀鲚杂居的情况。
为进一步讨论刀鲚和湖鲚之间差异是否达到亚种水平,参考 Mayr[22]的方法计算差异系数CD=(MB-MA)/(SDA+SDB),其中A、B为两个种群,M为某参数的平均值,SD为此参数的标准差。根据Mayr的75%法则,即如果A种群有75%的个体不同于B种群中 97%的个体则其之间已达亚种水平,此时其差异系数的值为CD=1.28(CD>1.28则为亚种)。将刀鲚样品和湖鲚样品进行比较,得到各项差异系数均小于 1.28,即此二者之间差异应该未达到亚种水平(表4)。这与利用分子手段判别的结果并不矛盾[10,12]。不过从判别的结果(图5)可以发现湖鲚与刀鲚之间的差异已经明显,其与刀鲚之间不同的生活习性,加之太湖水体与长江水体间交流日益减少使其与刀鲚差异越发显著,故无法排除其日后达到亚种水平的可能性。此外,本次研究的结果也显示,对于利用分子手段比较难以区分的样品,其从耳石形态上可以较为准确的判别。这可能与传统分子手段主要利用的分析的片段(线粒体基因、同工酶等)[10,12,24]与控制耳石形成的基因片段并不一致有关,此外耳石形成与环境之间的关联性也使得用耳石形态来作产地、种群的判别较其他方式要好。

表4 刀鲚与湖鲚之间差异系数比较Tab.4 Comparison of the coefficient of difference in otolith morphological measurements of Coilia nasus and Coilia nasus taihuensis
对于刀鲚洄游种群之间,其耳石形态依然存在相当的差异,主要表现在瓯江口群体和崇明、黄海群体间存在可能的差异。本研究中,比之于崇明、黄海刀鲚,瓯江口刀鲚耳石较接近于湖鲚(耳石后端较钝,基叶较大与翼叶有明显差异)。在针对刀鲚、湖鲚和凤鲚的判别分析时发生误判的刀鲚样品皆为瓯江口样品。这 4尾样品其共同点在于 D2/D3偏小,使得其在耳石背部向上拱、变钝(类似于湖鲚样品)。这也验证了以上假设的正确性。不过湖鲚在耳石背后角部分较之刀鲚更向背后方突出,故若要进一步分析可能需要引入背后角上的一个顶点。崇明和黄海样品基、翼叶突出明显大小相近,后端较尖,有明显中央沟,部分样品具有中央突。黄海刀鲚和崇明刀鲚耳石形态类似,聚类分析的结果显示两者相近。在判别分析中发生误判的情况也主要发生两者之间。若将两者合为一类则判别正确率为 91.9%,故其很有可能为同一生态群。瓯江口刀鲚耳石形态和崇明、黄海刀鲚耳石形态间的差异不难看出,其生活环境,生理条件等的不同。同时从分别在 3个地方所获取的样品分析结果来看,其间应该很少有个体间的交流(瓯江口样品与崇明样品、黄海样品之间的误判率分别为 5.6%、11.1%)。这些差异表明瓯江口和其较北面的同种刀鲚可能发生了生境上的隔离。同时,对于样品和其地理位置的对应性我们不难看出,刀鲚在其生殖洄游上可能存在“溯源”性,即对于同一地理群体的个体其产卵洄游的时候应该不会去其他通江河道,而是会回到其固定的通江河道中。
从聚类分析的结果可以发现刀鲚和凤鲚之间差异较为明显;刀鲚种群内部,定居型的湖鲚和洄游型刀鲚间也存在着差异;其次刀鲚不同地理种群间的差异也可能存在,明显黄海刀鲚和崇明刀鲚相近,而瓯江口刀鲚与之差别应该较大。具体表现为种间差异>种内差异。结合前人的研究结果[9,11,24,25],本研究的结果符合实际情况,说明本实验所选择的实验框架应该能够很好地区别凤鲚、刀鲚和湖鲚的耳石形态特征,对于不同地理种群的区分也能提供一定意义上的参考。不过由于样品的收集和保存未对性别对耳石形态的影响进行深入研究,这可能需要在下一步优化测量框架的同时进行进一步的讨论。
此外对于刀鲚长江口个体的观察以及长江内部常熟、江阴、南京、安庆等江段(未发表数据)的个别样品的分析发现其中背部有短脊的个体较多见,这与袁传宓[11]所描述的长江型和钱塘江型的耳石区别中前者背部无短脊而后者有所不同。
对于本判别分析中发生误判的个体可能有几方面原因:(1)个体框架的选择,特别是背顶点 P2和腹端点P3这两个端点对于个别样品特别是部分刀鲚耳石样品背、腹部存在不规则形变这为端点的选择带来困难和偏差,需要进一步的优化选择方法;(2)其次瓯江口刀鲚和崇明、黄海刀鲚之间误判的个体是否是少数可以往来于两水域的个体还有待进一步的研究。本研究中虽然瓯江口刀鲚仅有18尾,但其与崇明刀鲚和黄海刀鲚之间的差异趋势明显。此基础上下一步工作有必要扩大瓯江刀鲚的标本样品数量,以便完善和优化刀鲚耳石的测量框架。
综上所述,本研究中刀鲚、凤鲚和湖鲚耳石形态存在较为明显的差异,且种间(即刀鲚和凤鲚)差异>种内差异;不同水域刀鲚与湖鲚间亦存在着差异,但其程度介于种间与种内之间,同时差异系数的结果也证明湖鲚尚不足以成为有效的亚种;对于刀鲚自身,瓯江口刀鲚和崇明、黄海刀鲚间耳石形态也可能有所不同,崇明和黄海刀鲚应该较为接近,瓯江口刀鲚与之尚存在一定差异。
3.3 影响耳石形态可能的因素
本研究通过对刀鲚、凤鲚和湖鲚以及刀鲚洄游种群之间耳石形态的比较和分析,不难看出其中的差异还是比较明显的。从结果可以推测出影响耳石形态的主要因素为基因(即种间差异,例如凤鲚和刀鲚、湖鲚之间耳石形态上显著的区别,不存在误判);其次为生理或者生境上的区别(例如湖鲚和刀鲚以及刀鲚不同种群间的差别,其间存在一定数量的误判)。目前认为耳石形态影响因素主要有:遗传,生境,生理[14,26-29]。其中遗传主要指基因等影响因子;生境主要指盐度、温度等的影响因子;生理主要指年龄、性别等影响因子。大多数研究结果都证实了遗传(种群)对耳石形态的影响,对于生境和生理的影响还存在争议[14,26],有人认为幼鱼的耳石形态可以反映生理条件但不受体型和年龄的影响[28]。对于性别大多数研究结果都表明其影响不大[14,26-27,29]。
通过聚类分析的结果可以发现种间的差异(遗传)产生的形态差异较同种不同生理习性以及不同地理群间差异影响可能更为明显(凤鲚为一小类,湖、刀鲚成为一个小类),其次是不同生理习性(湖鲚为一小类,3个地区的刀鲚成为一个小类),最后是种内不同地域间的差异(瓯江口刀鲚为一小类,而崇明岛刀鲚和黄海刀鲚成为一小类)。本实验中刀鲚样本样品年份于1到3龄,主要集中于2龄,雌雄皆有。从实验的结果来讲种内不同地域间的形态差异较其他的因子所带来的差异影响最小;其次为刀鲚和湖鲚,比较两者的生理习惯和耳石沉积条件可以发现刀鲚两类型(湖鲚和刀鲚)之间的差异除了生理习性变化所带来的影响之外,盐度变化对耳石的影响可能占较大比重(前者为纯淡水定居型,后者为海淡水洄游型);而凤鲚与其余群体差异最大。也就是说决定耳石形态的因子其影响程度顺序可能为:基因>盐度>其他条件。有关盐度的影响以及刀鲚可能的“溯源”产卵情况,有必要进一步针对耳石元素微化学进行深入的探究。
[1]袁传宓,林金榜,秦安 ,等.关于我国鲚属鱼累分类的历史和现状[J].南京大学学报,1976,2:1-12.
[2]陈渊泉,龚群,黄卫平,等.长江河口区渔业资源特点、渔业现状及其合理利用的研究[J].中国水产科学,1999,6(5):48-51.
[3]袁传宓,秦安 .我国近海鲚鱼生态习性及其产量变动状况[J].海洋科学,1984,5:35-37.
[4]袁传宓.长江中下游刀鲚资源和种群组成变动状况及其原因[J].动物学杂志,1988,23(3):12-15.
[5]朱孝锋,高成洪,姚彩媛,等.长江刀鱼资源的危机和保护对策[J].中国渔业经济,2009,3(27):41-44.
[6]刘引兰,吴志强,胡茂林.我国刀鲚研究进展[J].水产科学,2008,27(4):205-209.
[7]刘凯,张敏莹,徐东坡,等.长江口凤鲚资源变动及最大持续产量的研究[J].上海水产大学学报,2004,13(4):298-303.
[8]施炜纲,王博.长江河口区凤鲚的资源现状[J].水生生物学报,2002,26(6):648-653.
[9]郭弘艺,唐文乔,魏凯,等.中国鲚属鱼类的矢耳石形态特征[J].动物学杂志,2007,42(1):39-47.
[10]程起群,温俊娥,王云龙,等.刀鲚与湖鲚线粒体细胞色素 b基因片段多态性及遗传关系[J].湖泊科学,2006,18(4):425-430.
[11]袁传宓,秦安 ,刘仁华,等.关于长江中下游及东南沿海各省的鲚属鱼类种下分类的探讨[J].南京大学学报(自然科学版),1980,3:67-77.
[12]唐文乔,胡雪莲,杨金权.从线粒体控制区全序列变异看短颌鲚和湖鲚的物种有效性[J].生物多样性,2007,15(3):224-231.
[13]高永华,李胜荣,任冬妮,等.鱼耳石元素研究热点及常用测试分析方法综述[J].地学前缘,2008,15(6):11-17.
[14]Reichenbacher B,Feulner G,Mirbach T.Geographic vatiation in otolith morphology among freshwater populations ofAphanius dispar(Teleosteim,Cyprinodontiformes) from the southeastern Arabian Peninsula[J].J Morphol,2009,270:469-484.
[15]张波,戴芳群,金显仕.黄海重要饵料鱼种矢耳石的形态特征[J].中国水产科学,2008,15(6):917-923.
[16]叶振江,孟晓梦,高天翔,等.两种花鲈(Lateolabraxsp.)耳石形态的地理变异[J].海洋与湖沼,2007,38(4):356-360.
[17]Turan C.The use of otolith shape and chemistry to detemine stock structure of Mediterranean horse macherelTrachurus mediterraneus(Steindachner)[J].J Fish Biol,2006,69:165-180.
[18]郭弘艺,魏凯,唐文乔,等.基于矢耳石形态特征的中国鲚属鱼类种类识别[J].动物分类学报,2010,35(1):127-134.
[19]杨金权,胡雪莲,唐文乔,等.长江口邻近水域刀鲚的线粒体控制区序列变异与遗传多样性[J].动物学杂志,2008,43(1):8-15.
[20]陆化杰,陈新军,刘必林.西南大西洋阿根廷滑柔鱼耳石外部形态特征分析[J].上海海洋大学学报,2009,18(3):338-344.
[21]张晓霞,叶振江,王英俊,等.青岛海域小眼绿鳍鱼耳石形态的初步研究[J].中国海洋大学学报,2009,39(4):622-626.
[22]Mayr E,Linsley E G,Usinger R L.Methods and principles of systematic zoology[M].NewYork,Toronto and London:McGraw Hill Book Company,1953:23-39,123-154.
[23]Ponton D.Is geometric morphometrics efficient for comparing otolith shape of different fish species? [J].J Morphol,2006,267:750-757.
[24]刘文斌.中国鲚属4种鱼的生化和形态比较及其系统发育的研究[J].海洋与湖沼,1995,26(5):558-564.
[25]Chen Q,Han J.Morphological variations and discriminant analysis of two populations ofCoilia ectens[J].J Lake Sci,2004,16(4):356-364.
[26]Cardinale M,Arjes P,Kastowsky M,et al.Effects of sex,stock,and enviroment on the shape of known-age Atlantic cod (Gadus morhua) otoliths[J].Can J Fish Aquat Sci,2004,61:158-167.
[27]Reichenbacher B,Kamrani E,Esmaeili H,et al.The endangered cyprinodontAphanius ginaonis(Holly,1929)from southern Iran is a valid species:evidence from otolith morphology[J].Environ Biol Fish,2009,86:507-521.
[28]Gagliano M,Mccormick M.Feeding history influences otolith shape in tropical fish[J].Mar Ecol-Prog Ser,2004,278:291-296.
[29]Hunt J.Morphological characteristics of otoliths for selected fish in the Northwest Atlantic[J].J Nothw Atl Fish Sci,1992,13:63-75.

