刺参染色体制备的初步研究
(中国水产科学研究院 黄海水产研究所,山东 青岛 266071)
刺参(Apostichopus japonicus)因其营养价值和保健作用极高而名列海产八珍之首。进入21世纪,随着我国国民经济的持续稳定发展和水产品消费水平的提高,刺参的增养殖业得到迅速发展。2008年全国刺参苗种年生产能力达 273多亿头,刺参增养殖面积约112 468 ha,产量达到92 567 t,行业经济总产值达到 200多亿元,是目前我国重要养殖经济水产品中单一经济总量最大的养殖品种。刺参增养殖业的发展亟需刺参遗传学研究和育种工作的开展。染色体制备是细胞遗传学研究的一项基本技术,是倍性检测、杂种鉴定、基因定位等育种工作的基础。
目前,对刺参染色体制备的研究已有报道。许伟定等[1]首次对刺参的染色体核型进行了分析,报道刺参染色体数目为2n=40。Okumura等[2]以不同发育时间的刺参胚胎为材料,采用敲片法对刺参染色体数目进行了研究,得出结果刺参染色体数目为2n=44。以上研究均以刺参胚胎为材料,在取样时间上存在限制,得出的结果也不尽相同。而且,贝类的杂交育种工作证明,杂种鉴定要得到可靠的结果需要对成体的染色体组成进行分析[3-4]。因此,有必要开展以成体组织为材料的刺参染色体制备工作。本文以刺参胚胎、成体呼吸树、成体肠为材料,采用常规方法、去受精膜法、植物血球凝集素(PHA)注射法等方法,对刺参染色体制备进行了研究,建立以刺参成体组织为材料的染色体制备方法,对不同材料不同方法的效果进行了比较,为染色体基因定位和染色体原位杂交等刺参遗传育种后续工作提供基础材料。
1 材料和方法
1.1 材料
实验用的刺参精卵及各期胚胎通过人工催产和授精获得,亲参来自蓬莱刺参育苗厂。所用刺参成体于2008年10月底取自烟台,为6月龄的幼参,体质量2.5 g左右,取回后于实验室中暂养。
1.2 方法
1.2.1 胚胎制片
以胚胎为材料进行染色体制备采用3种方法。
1.2.1.1 常规方法
选择发育良好的亲本刺参,通过人工催产促其产卵。人工授精后,受精卵按3~4个/mL的孵化密度进行孵化,孵化温度控制在20~22℃。
从授精后3 h开始取样,以后每隔1 h取样1次,至授精后24 h结束。取样时,取刺参的胚胎20个左右与过滤海水一起装入 10 mL的试管中,以质量分数为0.08%的秋水仙素处理1 h,7%柠檬酸钠溶液低渗 40 min,加入甲醇固定 1次后再加入卡诺氏固定液(甲醇与冰醋酸体积比为 3 :1)进行固定两次,每次15 min。取适量固定的胚胎,加入50%的冰醋酸后用吸管吹打进行解离,热滴片法滴片,自然干燥后用质量分数为5%吉姆萨染色液染色1 h,显微镜观察,统计染色体数目,进行显微摄影。同时在 100×显微镜下,随机统计 30个视野,计算细胞的有丝分裂指数。
1.2.1.2 二硫苏糖醇(DTT)去受精膜法
参考胡庆明[5]制备海胆染色体的方法。将刺参未受精卵用3 mmol/L浓度的DTT处理10 min,之后用自然海水漂洗,将经海水漂洗的未受精卵进行人工授精,然后受精卵于常温海水中培养。其余步骤同常规方法。
1.2.1.3 机械方法去受精膜法
参考Saotome[6]制备海胆染色体的方法。将刺参卵子吸入盛有海水的培养皿中,加进 1滴精液行人工授精。10 min后,倾去多余海水,加入5~10倍的无钙海水。待受精膜举起膨胀到最大时用吸管吹打使受精膜破裂。去膜胚胎用海水洗涤两次,培养于海水中。其余步骤同常规方法。
1.2.2 成体组织制片
以成体组织为材料进行染色体制备采用两种方法。
1.2.2.1 常规方法
解剖刺参取出呼吸树及肠组织,取长度为2~3 mm的肠组织及适当大小呼吸树,分别用质量分数为0.04%的秋水仙素处理1 h,其余步骤同胚胎制片。
1.2.2.2 PHA体内注射法
参考鱼类染色体研究中常用的PHA体内注射法,每克体质量注射PHA 10 µg于刺参体腔中,处理18~24 h后,解剖刺参取出呼吸树及肠组织,其余步骤同常规方法。
2 结果
2.1 胚胎受精膜的去除
用DTT对刺参未受精卵进行处理,人工授精后,镜检观察卵子发生畸形,并不发生卵裂,不能够获得早期胚胎。而采用机械方法去除刺参受精卵受精膜时,用吸管吹打刺参受精卵后,镜检发现受精膜很难去除,滴片后也没有发现分裂相。因此参考海胆染色体制备方法制备刺参染色体不成功。
2.2 不同方法和材料效果的比较
以胚胎为材料采用常规方法时,从授精后 18 h至24 h所取样品均能观察到中期分裂相,其中以授精后21 h所取胚胎为材料时有丝分裂指数最高。以刺参成体肠和呼吸树组织为材料采用常规方法制片,很难获得细胞的中期分裂相。在体内注射 PHA后,可有效提高分裂指数,获得分裂相。
对以胚胎、肠、呼吸树为材料进行染色体制片的效果进行比较。结果如表1和图1所示。其中原肠后期胚胎为受精后21 h的胚胎,成体呼吸树和成体肠是采用PHA体内注射法获得的结果。可以看出,以胚胎为材料获得的有丝分裂指数最高,以胚胎和呼吸树为材料获得的分裂相较清晰,而以肠为材料获得的分裂相较模糊。

图1 不同材料制备的刺参染色体Fig.1 Chromosomes of A.japonicus prepared by different materials

表1 不同材料制备的刺参染色体有丝分裂指数比较Tab.1 Mitotic division index with the different chromosome prepared materials of A.japonicus
2.3 刺参染色体二倍体数目
对 100个图像清晰、染色体分散良好的中期分裂相进行染色体数目统计,具46条染色体的分裂相为 55个,占分裂相总数的 55%,由此可以确定刺参的染色体基数为n=23,2n=46(表2)。
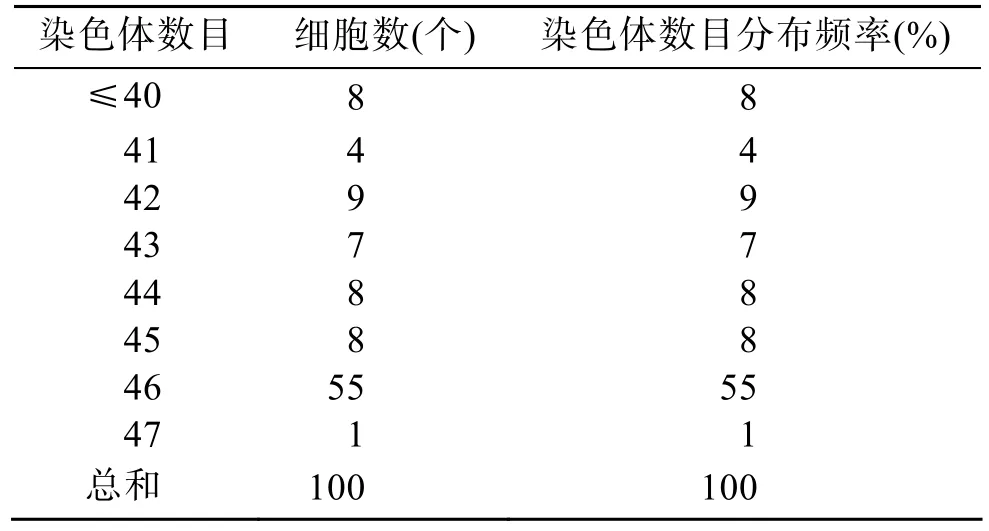
表2 刺参染色体二倍体计数结果Tab.2 Diploid chromosome number of A.japonicus
3 讨论
动物胚胎发育期的细胞分裂最旺盛,并且采用早期胚胎为制备染色体的材料,因其卵黄少、细胞大,在染色体制备过程中,可获得大量的分裂相,并且试验重复性好,用做染色体的制片常常会收到很好的效果,因此胚胎是许多水产动物染色体研究的首选材料。在棘皮动物的染色体的研究方面,海胆染色体的研究是开展得最早的。前期的海胆染色体研究主要以早期胚胎为材料采用切片法和压片法制备分裂相[7-10],但这些研究都没有得到满意的结果,难以得出准确的染色体数目。由于棘皮动物受精卵的受精膜在海水中钙化后非常有韧性,并且很难除去,因此在染色体的制片方面很难达到理想的效果。自20世纪80年代以来,研究人员通过药物处理或者机械方法除去海胆、海星受精卵的受精膜后进行染色体分裂相的制备取得了较好的效果[11-15]。本研究参考胡庆明[5]的方法,用 DTT处理刺参未受精卵后进行人工授精,镜检观察卵子发生畸形,并不发生卵裂,不能够发育至胚胎。这可能是因为刺参的卵膜被DTT破坏,影响了刺参的精卵识别,阻止了卵子受精。而参考Saotome[6]的方法通过吹打去除刺参受精膜,发现刺参受精卵受精膜很难去除,滴片后也没有发现分裂相,这可能是因为刺参受精卵的受精膜比海胆受精卵的受精膜更为坚韧,难以通过机械方法去除。因此本研究通过去受精膜的方法制备刺参的染色体不成功,只有以脱膜上浮以后的胚胎即囊胚后期和原肠期胚胎为材料,采用常规方法,能得到较好的分裂相。
PHA作为致有丝分裂原在细胞体外短期培养中的广泛应用,使专供鱼类染色体制片的血培养、鳞培养、以及肾细胞培养等短期培养方法先后建立。林志浩首次采用PHA体内注射刺激肾细胞的有丝分裂,建立了一种快速简捷的鱼类染色体的制备方法[16],在鱼类染色体的研究中得到广泛的应用[17-19]。此后,PHA注射法制备染色体被应用到贝类染色体的制备,并得到较好的效果[20-22]。刺参成体的呼吸树和肠组织分裂指数低,不易得到分裂相,为此将 PHA注射法应用到刺参的染色体制备中,有效促进了刺参呼吸树和肠组织细胞的分裂。
本研究得到刺参染色体数目为 2n=46条,与许伟定报道刺参的染色体数目为 2n=40以及Okumura报道刺参的染色体数目为 2n=44不一致。Okumura认为其实验结果与许伟定得到结果不同的原因是刺参染色体存在着种内变异。笔者认为造成这种实验结果的差异更可能的原因是各研究者制片时的处理条件不同。在取样材料上,本研究与许伟定一致,均以原肠后期胚胎为材料时,获得最好结果,而Okumura以未脱膜上浮的囊胚期胚胎为材料获得有丝分裂中期分裂相,以原肠后期胚胎为材料时反而得不到中期分裂相。而且,各研究间秋水仙素处理浓度差异较大,本研究秋水仙素质量分数为 0.08%与许伟定的0.1%接近,而Okumura秋水仙素质量分数为 0.005%,这说明,实验处理条件不同,对结果影响较大。此外,我们在研究中发现,刺参染色体极易丢失,这可能是造成本研究与许伟定得出的结果不同的原因。实验室在进行刺参DNA的提取时,DNA极易降解,常林瑞在进行刺参 DNA的提取时,遇到同样的问题[23]。而染色体主要由DNA和蛋白质这两类化学物质所组成,所以DNA的降解与染色体的丢失有必然的联系。这可能是因为刺参在受到外界刺激或外界环境变化时,细胞内核酸内切酶激活,基因组的DNA在核小体连接区发生非随机性降解,产生寡核小体片段,造成DNA的降解和染色体的丢失。本研究参考 Saotome制备海星染色体的方法,低渗时用7%柠檬酸钠处理40 min,固定后马上进行解离滴片,缩短了药物处理的时间,有效避免了DNA降解造成的染色体丢失。而许伟定低渗时间为2 h,固定后样品于冰箱中冷藏后再进行滴片,增加的处理时间加大了DNA降解和染色体丢失的可能性。此外,本研究与许伟定在对样品进行固定时的处理也有所不同。刺参体内富含的胶质、酸性黏多糖等成分使得固定的材料极难解离,造成解离时吹打力量过大使细胞破碎,是刺参染色体易丢失的另一可能原因。Korthof[24]在进行人外周血淋巴细胞染色体制备时发现,纯甲醇固定处理人外周血淋巴细胞对中期细胞染色体的收获率没有影响。经纯甲醇处理的细胞固定更彻底,对机械作用力的敏感性下降,因而在收获过程中细胞不容易破裂,不易造成染色体丢失。但纯甲醇固定处理不利于染色体的分散,作者对Korthof的方法做了调整。在纯甲醇固定处理后,再用常规的固定液(甲醇 :冰醋酸=3 :1)对样品再进行两次固定,从而避免纯甲醇固定产生的不利影响,也一定程度上避免了因解离时细胞破裂造成的染色体丢失。
[1]许伟定,隋锡林,胡庆明,等.刺参染色体的初步研究分析[J].水产科学,1997,16(5):9-11.
[2]Okumura I,Kimura K,Sakai M,et al.Chromosome number and telomere sequence mapping of the Japanese sea cucumberApostichopus japonicus[J].Fish Sci,2009,75:249-251.
[3]吕振明.栉孔扇贝和虾夷扇贝杂交过程中的细胞与分子遗传学分析[D].青岛:中国海洋大学,2006.
[4]赵洋.杂交扇贝的细胞遗传学研究[D].青岛:中国海洋大学,2003.
[5]胡庆明,许伟定,隋锡林,等.大连紫海胆染色体制备的研究[J].水产科学,1993,12(3):11-12.
[6]Saotome K.A method for chromosome preparation of sea urchin embryos[J].Stain Technol,1982,57(2):103-105.
[7]Pinney E.A study of the chromosomes ofHipponoe esculentaandMoira atropos[J].Biol Bull,1911,21(3):168-186.
[8]Tennent D H.The behavior of the chromosomes in Cross fertilized echinoid eggs[J].J Morphol,1912,23(1):17-29.
[9]Makino S,Niiyama H.A study of chromosomes in echinoderms[J].J Fac Sci,1947,9:225-232.
[10]Makino S.A review of the chromosome number in aninals[M].Tokyo:Hokuryukan,1956:33-35.
[11]Saotome K.Chromosomes numbers in 8 Japanese species of Sea Urchin[J].Zool Sci,1987,4(3):483-487.
[12]Saotome K.Chromosome number of sea urchinStrongylocentrotus intermedius[J].Chrom Infor Serv,1989,46:11-12.
[13]Saotome K.Chromosome number of sea urchin andromerogones during early development[J].Zool Sci,1999,16(1):87-92.
[14]Saotome K.Chromosomes of Japanese starfishes[J].Zool Sci,2002,19:1095-1103.
[15]董宝贤,林泰喜.马粪海胆的染色体制备和染色体数目[J].青岛海洋大学学报,1991,21(3):129-132.
[16]林义浩.快速获得大量鱼类肾细胞中期分裂相的PHA体内注射法[J].水产学报,1982,6(3):201-208.
[17]郭丰,王军,苏永全,等.云纹石斑鱼染色体核型研究[J].海洋科学,2006,30(8):1-3.
[18]刘楚吾,曹伏君.军曹鱼染色体组型分析[J].海洋科学,2008,32(1):29-31.
[19]周丽青,杨爱国,柳学周,等.半滑舌鳎染色体核型分析[J].水产学报,2005,29(3):417-419.
[20]王金星,赵小凡,周岭华,等.缢蛏的染色体研究[J].海洋与湖沼,1998,29(2):191-196.
[21]贾志良,李智盈,包振民,等.增加贝类染色体分裂相的方法初探[J].青岛海洋大学学报,2001,31(2):232-236.
[22]孙振兴,郭胜超,邵雁群,等.三种海产帘蛤目贝类的核型研究[J].海洋学报,2004,26(1):88-94.
[23]常林瑞,孙振兴,李莉,等.刺参基因组DNA的提取及RAPD条件的优化[J].湖北农业科学,2007,46(1):18-20.
[24]Korthof G.An improved fixation method for chromosome preparation of Chinese hamster,Chinese hamster-human hybrid,and mouse cell lines[J].Cytogenet Cell Genet,1986,41(3):181-184.

