缺氧诱导胃癌多药耐药的机制研究
雷 婷,刘理礼,韩 霜,郭雪艳,丁 杰
1.兰州军区乌鲁木齐总医院消化病中心,新疆乌鲁木齐 830000;2.第四军医大学唐都医院肿瘤科;3.第四军医大学西京医院消化病院全军消化病研究所肿瘤生物学国家重点实验室;4.陕西省人民医院消化内科
缺氧是实体瘤普遍存在的现象,多年来,人们对肿瘤组织缺氧重要性的认识来源于一个事实,缺氧细胞对治疗具有固有的耐受性。近年来不断有文献报道在例如结肠癌、前列腺癌、神经胶质瘤、睾丸癌等多种肿瘤细胞对阿霉素、铂剂、丝裂霉素和环磷酰胺等化疗药物发生了耐药[1-3]。本研究发现缺氧能够显著降低胃癌细胞对于多种化疗药物的敏感性,其主要是通过上调药物转运蛋白的表达及增加抗凋亡分子Bcl-2/Bax的比例实现的。
1 材料与方法
1.1 主要材料 人胃癌细胞系SGC7901引自军事医学科学院。鼠抗人p-gp、MRP、Bcl-2和Bax单克隆抗体购自Santa Cruz公司。细胞培养用1640培养液(Gibco公司),胎牛血清(浙江杭州四季青公司。RTPCR试剂盒(Promega),缺氧培养箱:Forma Scientific公司(1%O2,5%CO2,94%N2)。
1.2 M TT比色法 将待检细胞预先缺氧(1%O2)或常规培养 8 h,将化疗药物按不同浓度加入各孔细胞,继续缺氧或常规培养48 h;MTT呈色后,选择490 nm波长比色,计算胃癌细胞在缺氧和常氧条件下化疗药物不同浓度下的存活率。细胞存活率(%)=(实验组A值-空白对照组A值)/(阴性对照组A值-空白对照组A值)×100%。IC50的计算以细胞存活率为纵轴,药物浓度对数为横轴作半对数图,并按作图法求出胃癌细胞黏附于不同成分后对两种药物的 IC50值。
1.3 Annexin V/PI染色法 收获对数生长期的待检细胞,细胞贴壁后加入VCR,剂量为2.5 mg/L,37℃缺氧或常氧培养48 h;加入5μL的Annexin V-FITC后收集细胞,PI染液,流式细胞仪分析。计算细胞的凋亡指数:细胞凋亡指数=(早期凋亡细胞数+晚期凋亡细胞数)/总细胞数×100%。
1.4 阿霉素蓄积潴留实验 收获对数生长中期的待检细胞,按照每孔 1×105个细胞接种于6孔板中;培养过夜后,缺氧或常氧培养12 h后每孔加入ADR至终浓度为5mg/L,继续培养1 h;收获细胞上流式细胞仪检测细胞内的ADR荧光强度,计算药物的泵出率:细胞药物泵出率(%)=(阿霉素的蓄积量-阿霉素的潴留量)/阿霉素的蓄积量×100%。
1.5 W estern blot 提取不同时间暴露于缺氧的胃癌细胞SGC7901的总蛋白,一抗分别为p-gp、MRP、Bcl-2和Bax单克隆抗体分别缺氧不同时间的蛋白水平的变化。
1.6 半定量RT-PCR 利用细胞总RNA提取试剂Trizaol提取细胞的总RNA,共20μL的反应体积用于1~2μg总RNA的反转录反应,cDNA产物于-20℃保存。半定量PCR引物根据MDR1、MRP、Bcl-2、Bax和β-actin mRNA序列用Primer Primere 5软件设计。引物由上海英骏生物工程公司合成,序列如下:上游引物5′-AACGGAAGCCAGAACATTCC-3′,下游引物5′-AGGCTTCCTGTGGCAAAGAG-3′(MDR1);上游引物5′-ATACCTGCTGTTCGGATTT-3′,下游引物5′-CGC ATAGTGGATGGCTTT-3′(MRP-1);上游引物5′-AGGATTGTGGCCTTCTTTGAG-3′,下游引物5′-GAGACAGCCAGGAG AAATCAAA-3′(Bcl-2);上游引物5′-CAGGATCGAGCAGGGCGAATG-3′下游引物5′-GCTTGAGGAGTCTCACCCAACCA-3′(Bax);上游引物5′-ATCCTGCCAGTAGCATATGC-3′,下游引物5′-ACCGGGTTGGTTTTGATCTG-3′(β-actin)。PCR反应条件94℃40 s,57℃40 s,72℃1min,70℃10min,30个循环。
1.7 统计学分析 根据数据不同,相应采用配对 t检验、方差分析及Dunnett's多均数比较等方法,使用SPSS 10.0统计软件完成数据处理。P<0.05表示差异有统计学意义。
2 结果
2.1 缺氧对于化疗药物敏感性的影响
2.1.1 MTT比色法检测常氧状态下和缺氧状态下的胃癌细胞SGC7901对于化疗药物5-氟尿嘧啶(5-Fu)和长春新碱(VCR)等5种化疗药物的药物敏感性:缺氧状态下胃癌细胞对 5种化疗药物的敏感性均明显低于常氧状态下的胃癌细胞,提示缺氧能够显著降低化疗药物的敏感性(P<0.05,见表1)。
表1 SGC 7901在缺氧和常氧条件下对 5种化疗药物的IC50 (μg/m L,±s)Tab 1 IC 50 of chemotherapeutic d rugs under normoxic and hypoxic condition in SGC 7901 cells(μg/m L,±s)
与常氧状态下的SGC7901的IC50相比,*P<0.05
化疗药物常氧状态(IC50)缺氧状态(IC50) 耐药指数5-Fu 2.16±0.86 8.92±1.13* 4.1±0.13 VCR 1.23±0.01 6.23±0.15* 5.1±1.51 CDDP 3.23±1.18 7.51±1.03* 2.3±0.33 VP16 4.43±1.59 12.09±3.46* 2.7±0.11 ADM 0.33±0.22 0.72±0.19* 2.1±0.91
2.1.2 Annexin V/PI染色法借助流式细胞仪检测胃癌细胞SGC7901在常氧和缺氧状态下对于化疗药物诱导下的凋亡情况:常氧状态下VCR诱导SGC7901的凋亡指数为44.7%,而在缺氧条件下,VCR诱导SGC7901细胞的凋亡指数下降了 20.7%,差异具有显著的统计学意义(P<0.01)。而未加VCR的两组细胞中常氧和缺氧状态下的细胞凋亡指数无显著性差异。提示缺氧能够增加胃癌细胞抵抗化疗药物诱导的凋亡能力(见图1)。
2.1.3 流式细胞仪(FCM)检测常氧状态和缺氧状态下胃癌细胞SGC7901内阿霉素的蓄积和潴留,并计算相应的药物泵出率:与常氧状态下相比,缺氧条件下的SGC7901细胞内阿霉素蓄积和潴留均明显减少,药物泵出率显著增加(见表2)。
表2 胃癌细胞的阿霉素蓄积潴留和药物泵出率(±s)Tab 2 Accumu lation and retention of Adriam ycin in SGC 7901 cells under normoxic and hypoxic condition(±s)
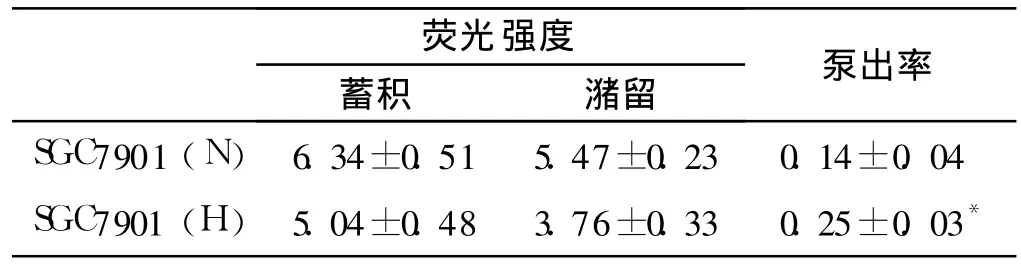
表2 胃癌细胞的阿霉素蓄积潴留和药物泵出率(±s)Tab 2 Accumu lation and retention of Adriam ycin in SGC 7901 cells under normoxic and hypoxic condition(±s)
与常氧状态下的SGC7901细胞的泵出率相比,*P<0.05
荧光强度蓄积 潴留 泵出率SGC7901(N)6.34±0.51 5.47±0.23 0.14±0.04 SGC7901(H)5.04±0.48 3.76±0.33 0.25±0.03*
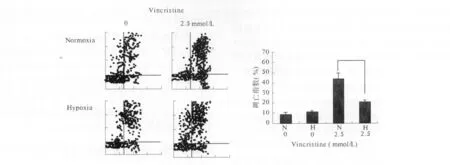
图1 SGC 7901细胞在常氧和缺氧下VCR诱导的凋亡指数Fig 1 Apoptosis index induced by VCR under normoxic and hypoxic condition in SGC 7901 cells
2.2 缺氧上调MDR和MRP的表达 通过Western blot检测不同时间缺氧处理的SGC7901细胞中药物转运蛋白p-gp和MRP的表达,结果显示(见图2A):与常氧状态下的SGC7901细胞相比,在缺氧培养8 h后细胞内的p-gp和MRP蛋白水平明显增加,具有显著的统计学差异(P<0.05)。
半定量RT-PCR检测不同时间处理的SGC7901细胞中MDR1和MRP1的mRNA水平,结果发现(见图2B):与常氧状态下相比,缺氧能够明显上调细胞内MDR1和MRP1的mRNA水平。
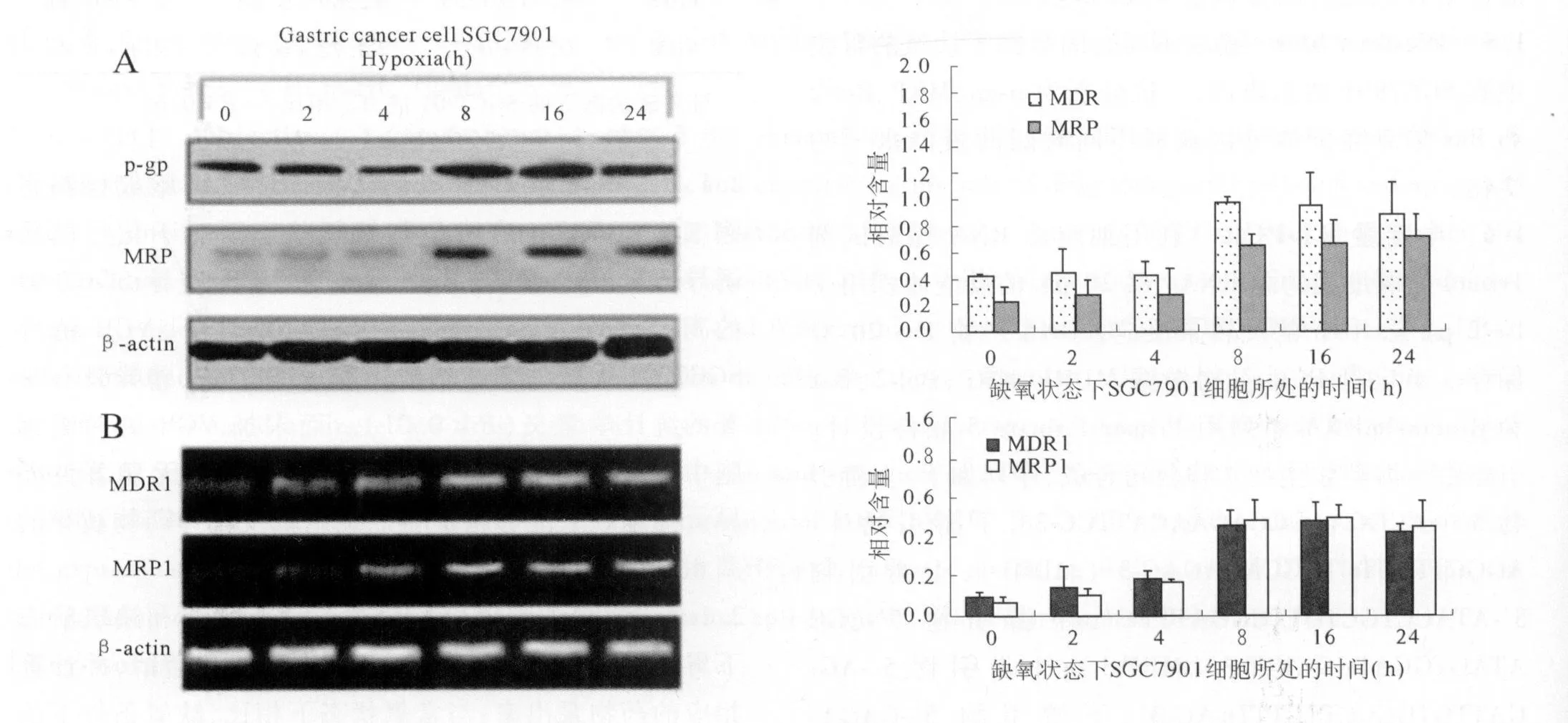
图2 M DR和MRP在常氧和缺氧条件下的表达Fig 2 Exp ression o f MDR and M RP under normoxic and hypoxic condition
2.3 缺氧增加抗凋亡分子 Bcl-2和降低促凋亡分子Bax的表达 通过Western blot检测不同时间缺氧处理的SGC7901细胞中凋亡相关蛋白Bcl-2和Bax的表达,结果显示(见图 3A):与常氧状态下的细胞相比, SGC7901细胞在缺氧培养4 h后,抗凋亡分子Bcl-2的蛋白水平呈时间依赖性的增加,并在缺氧 8 h后达到高峰,差异具有显著的统计学意义(P<0.05);而凋亡相关分子Bax的表达在缺氧2 h后明显下降,且随着缺氧时间的延长,Bax的表达也逐渐下降。
半定量RT-PCR检测不同时间处理的SGC7901细胞中Bcl-2和Bax的mRNA水平,结果发现(见图3B):与常氧状态下的细胞相比,缺氧能够明显上调Bcl-2mRNA水平,下调Bax mRNA水平,且变化趋势与蛋白水平一致。
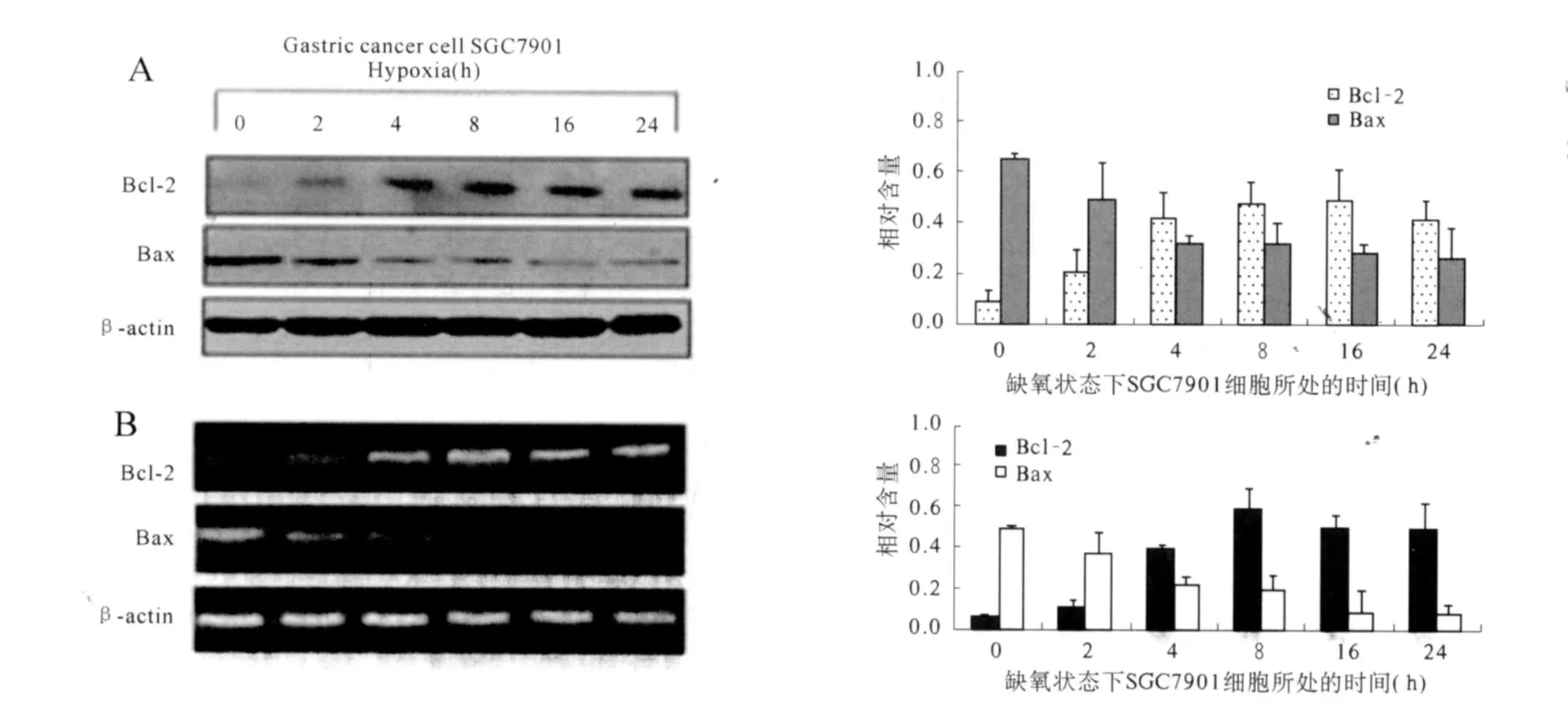
图3 Bcl-2和Bax在缺氧和常氧条件下的表达Fig 3 Expression of Bcl-2 and Bax under normoxic and hypoxic condition
3 讨论
早在 20世纪七、八十年代,研究人员就发现在暴露于缺氧条件下或缺氧应激后,肿瘤细胞对阿霉素、铂剂和环磷酰胺等化疗药物发生耐药[4]。而后研究者相继在不同肿瘤组织和细胞中发现,缺氧会增加肿瘤细胞对化疗药物的耐受。Kinoshita等[5]研究发现,缺氧可以增加结肠癌细胞对化疗药物的抗凋亡能力,促进肿瘤细胞的生存。另有文献报道,在睾丸癌细胞[6]、神经胶质瘤[7]、胰腺癌[8]缺氧均可以降低化疗药物的疗效。我们的研究发现,在胃癌细胞SGC7901中,缺氧显著增加了 5-氟脲嘧啶、长春新碱、顺铂等 5种化疗药物的药物敏感性,尤其是对于 5-氟尿嘧啶和长春新碱的耐受更为显著。
多药耐药(multidrug resistance,MDR)是指肿瘤细胞同时对多种化学结构和作用机理并不相同的药物产生的耐受性。p-gp(ABCB1)是第一个被确定可介导多药耐药现象的药物转运蛋白,也是研究最广泛深入的一个成员,是ABC(ATP binding cassette family)超家族的成员,研究证实 p-gp高表达或活性增强可降低药物在细胞内的蓄积,导致MDR。MDR1基因的诱导表达取决于细胞类型:多种诱导剂在不同的细胞中以不同的方式影响该基因的活性。例如,射线照射过的中国仓鼠细胞对长春新碱耐药,其机制可能与翻译或翻译后调节有关[9]。化学致癌剂诱导大鼠肝细胞 MDR1基因活性增强,再生大鼠肝细胞进行部分肝切除后也产生同样的作用[10]。某些细胞因子在特定类型的培养细胞中诱发ABCB1-MDR现象。热休克和细胞分化诱导剂也会影响 MDR1基因的活性。近年来发现缺氧能够诱导一些肿瘤细胞内药物转运蛋白的基因表达,参与了缺氧诱导的MDR。
Katrina等[11]用RNA定量微阵分析显示,缺氧后上皮细胞中MDR1增加了7倍;而且缺氧条件下p-gp功能较常氧增强(7±0.4)倍;并证实MDR1基因上存在HIF-1的结合位点。从而进一步证实MDR1是缺氧反应基因。Wartenberg等[12]发现缺氧时p-gp在肝癌细胞中表达增高,氧化剂 H2O2和丁硫氨酸亚矾胺降低p-gp的表达,而自由基清除剂N-乙酰半胱氨酸和维生素E则增加了p-gp的表达,提示缺氧可诱导p-gp的表达。缺氧可以通过对 MDR1的转录激活参与肿瘤细胞的多药耐药。
但是,也有两个实验室报道,在乳腺癌和结肠癌细胞中缺氧诱导了化疗药物的抵抗,但缺氧并无改变pgp和MRP的表达水平,提示缺氧导致的化疗诱导的抵抗存在细胞特异性[13,14]。我们的研究发现,在胃癌细胞中,缺氧能够增加MDR1基因及其产物p-gp的表达,降低化疗药物在胃癌细胞中的潴留和蓄积,从而部分诱导胃癌细胞的MDR。除此以外,我们还发现缺氧还能够增加另外一个药物转运蛋白MRP1的表达。提示,在胃癌细胞中,缺氧诱导的 MDR表型部分通过增加p-gp和MRP的表达,从而降低了化疗药物在细胞内的蓄积。
另外,缺氧可以降低化疗药物诱导的凋亡,主要是通过上调抗凋亡分子的表达或是降低凋亡分子的表达,从而降低化疗药物的杀伤效能。而在此过程中,文献报道,缺氧能够抑制凋亡分子Bid的表达,降低依托泊甙对于结肠癌细胞的杀伤效能。在口腔鳞状上皮癌细胞中,缺氧通过抑制Caspase-9和Caspase-3的活性以及增加抗凋亡分子Bcl-2和Bcl-X(L)的表达从而抑制凋亡的发生。但是,缺氧还存在着促进细胞凋亡的效应。Moritz等[15]发现人和小鼠胰岛β细胞缺氧6 h即出现核固缩,Caspase-3表达增高;研究还发现缺氧能够诱导胰岛素瘤细胞系(MIN6)凋亡比例增加。缺氧还可激活促凋亡分子RTP801、NIX、NIP3[16],由此引起细胞凋亡。
在凋亡的发生机制中,凋亡调节蛋白Bcl-2及其家族成员在其中起着重要的作用。Bcl-2与Bax的比例调节了凋亡的发生[17]。我们的研究发现,在胃癌细胞中,缺氧4 h后能够明显上调抗凋亡分子Bcl-2的表达,缺氧2 h后能够明显下调促凋亡分子 Bax的表达,因此,我们推测,在胃癌细胞 SGC7901中,缺氧通过增加抗凋亡分子Bcl-2/Bax的比例抑制了化疗药物诱导的凋亡,从而介导胃癌细胞的MDR。众所周知,缺氧诱导因子(hypoxia-inducible factor-1,HIF-1)是缺氧活化的一个重要转录调控因子,可以通过转录调控多种靶基因来维持肿瘤细胞在缺氧条件下的生存。有研究证实缺氧上调p-gp的表达是通过HIF-1转录活化MDR1基因的机制调节的,那么在胃癌细胞中我们发现的缺氧上调的MRP、Bcl-2是否也是通过HIF-1转录活化的还有待于进一步的研究。
[1]Harrison L,Blackwell K.Hypoxia and anemia:factors in decreased sensitivity to radiation therapy and chemotherapy[J]?Oncologist, 2004,9(Suppl 5):31-40.
[2]Greco O,Marpels B,Joiner MC.How to overcome(and exploit) tumor hypoxia for targeted gene therapy[J].J Cell Physiol,2003, 197(3):312-325.
[3]Brown JM.Exploiting the hypoxic cancer cell:mechanisms and therapeutic strategies[J].Mol Med Today,2000,6(4):157-162.
[4]Teicher BA,Lazo JS,Sartorelli AC.Classification of antineoplastic agents by their selective toxicities toward oxygenated and hypoxic tumor cells[J].Cancer Res,1981,41(1):73-81.
[5]Kinoshita M,Johnson DL,Shatney CH,et al.Cancer cells surviving hypoxia obtain hypoxia resistance and maintain anti-apoptotic potential under reoxygenation[J].Int JCancer,2001,91(3):322-326.
[6]Koch S,Mayer F,Honecker F,etal.Efficacyof cytotoxic agentsused in the treatment of testicular germ cell tumoursunder normoxic and hypoxic conditions in vitro[J].Br J Cancer,2003,89(11): 2133-2139.
[7]Yang DI,Chen SD,Yang YT,et al.Carbamoylating chemoresistance induced by cobaltpretreatment in C6 glioma cells:putative rolesof hypoxia-inducible factor-1[J].Br J Pharmacol,2004,141(6): 988-996.
[8]Yokoi K,Fidler IJ.Hypoxia increases resistance of human pancreatic cancer cells to apoptosis induced by gemcitabine[J].Clin Cancer Res,2004,10(7):2299-2306.
[9]Hill BT,Deuchars K,Hosking LK,et al.Overexpression of P-glycoprotein inmammalian tumor cell linesafter fractionated X irradiation in vitro[J].JNatl Cancer Inst,1990,82(7):607-612.
[10]Burt RK,Thorgeirsson SS.Coinduction of MDR-1 multidrug-resistance and cytochrome P-450 genes in rat liver by xenobiotics[J].J Natl Cancer Inst,1988,80(17):1383-1386.
[11]Katrina M,Timothy J,Karhausen J,et al.Hypoxia-inducible factor-1-dependent regulation of the multidrug resistance(MDR 1)gene[J]. Cancer Res,2002,62(15):3387-3394.
[12]Wartenberg M,Gronczynska S,Bekhite MM,etal.Regulation of the multidrug resistance transporterP-glycoprotein inmulticellularprostate tumor spheroidsby hyperthermia and reactive oxygen species[J].Int JCancer,2005,113(2):229-240.
[13]Greijer AE,de Jong MC,Scheffer GL,etal.Hypoxia-induced acidification causesmitoxantrone resistance notmediated by drug transporters in human breast cancer cells[J].CellOncol,2005,27(1):43-49.
[14]Hyun JY,Chun YS,Kim TY,et al.Hypoxia-inducible factor 1alphamediated resistance to phenolic anticancer[J].Chemotherapy, 2004,50(3):119-126.
[15]MoritzW,Meier F,Stroka DM,et al.Apoptosis in hypoxic human pancreatic islets correlates with HIF-1alpha expression[J].FASEB J,2002,16(7):745-747.
[16]Shoshani T,Faerman A,Mett I,et al.Identification of a novel hypoxia-inducible factor 1-responsive gene,RTP801,involved in apoptosis[J].Mol Cell Biol,2002,22(7):2283-2293.
[17]Salomons GS,Brady HJ,Verwijs-Janssen M,et al.The Bax alpha/ Bcl-2 ratiomodulates the response to dexamethasone in leukemia cells and ishighly variable in childhood acute leukem ia[J].Int JCancer, 1997,71(6):959-965.

