Th17在自身免疫性肝炎病理形成中的作用
韩 冰 综述,张顺财 审校
1.第二军医大学附属长征医院内科,上海 200003;2.复旦大学附属中山医院消化科
肝脏损伤的病因包括肝炎病毒、药物、酒精性肝病、非酒精性脂肪肝、遗传代谢、自身免疫等多种因素,一旦疾病发展到肝病的终末期状态肝硬化,无疑给患者带来身心上巨大的痛苦。虽然我国慢性肝病的发病率居高不下,但是随着现代疾病谱的改变及诊断水平的不断提高,自身免疫性肝病如自身免疫性肝炎(autoimmune hepatitis AIH)的病例报道日益增多,诊断率也较前大为提高,从而临床医生能够早期干预,使患者改善症状、缓解生化指标异常、减轻肝脏炎症并且阻止肝纤维化进展等[1,2]。AIH的发病机制至今尚未完全明确,对它的研究也以免疫学方面的研究居多,Th17细胞是新近发现的CD4+Th细胞亚家族,被认为与传统的Th1、Th2分化来源乃至于功能均有所不同,从而成为目前研究的焦点。本文就Th17细胞与AIH的发病机制相关研究作一简单介绍及展望。
1 AIH概述
早在 1930年就有报道发现伴有高蛋白血症及重度黄疸的肝病,1950年Waldenström提出了一种慢性肝病,它多发于女性,同时伴有外周血 γ球蛋白的升高,随着疾病的发展可导致黄疸并最终将演变为肝硬化,此后,该种疾病逐步为全世界的学者所认知,这就是我们现在所知道的 AIH。AIH[1,2]是一种慢性进行性肝脏炎性疾病,其组织学特点主要表现为汇管区淋巴细胞浆细胞的浸润,并侵入肝脏实质,形成界面性肝炎,外周血血清中出现自身抗体、高免疫球蛋白(IgG)及对免疫抑制剂治疗有所反应等特征。根据疾病中出现不同的自身抗体,AIH被分为2种亚型,其中抗核抗体(ANA)及抗平滑肌抗体(SMA)是1型AIH的标志性抗体,而2型AIH则是以表达抗肝肾微粒体抗体-1为主(LKM-1)。对于AIH的诊断,首先需排除病毒、药物诱导、酒精及遗传因素并结合实验室指标及肝脏病理综合判断。目前,AIH的诊断依旧沿用 1993年国际自身免疫性肝炎小组(International Autoimmune Hepatitis Group,IAIH-G)提出的评分标准[3,4],在疾病治疗之前,当AIH评分>15分时即可确诊为AIH,但是该评分标准较为复杂,需要临床和肝脏病理相结合才能提高诊断率,此后在2008年Hennes等[5]提出一种更为简便的诊断标准,但该诊断标准建立在原有的评分系统基础上,其应用价值仍待进一步研究证实。
研究者在探究AIH的发病机制时发现,基因易感性、病毒分子模拟机制、自身免疫反应及各种理化因素均可诱发自身免疫攻击而导致肝脏损伤,但是迄今为止,对于AIH确切的病因及发病机制仍不完全明确。其中,自身免疫反应被认为在AIH的多种发病机制中起着较为重要的作用,自身免疫平衡状态的破坏是目前广泛被接受的论点,也是肝脏自身抗原特异性的细胞攻击肝细胞的重要因素,因此,目前AIH的标准治疗也是以皮质类固醇激素为基础辅以免疫抑制剂等药物为主[1,2]。
在肝脏组织病理学上,AIH的特点是以汇管区淋巴细胞、浆细胞浸润,并侵入肝脏实质形成界面性肝炎,其中炎症细胞包括了CD4+CD8+T淋巴细胞、B淋巴细胞、单核巨噬细胞、浆细胞等,炎症细胞反应一旦促发,肝脏细胞将受到持续性损伤,因此,AIH的免疫学相关性研究较多。研究发现,介导 AIH的淋巴细胞主要以CD4+T淋巴细胞为主,外源性抗原肽借由人类白细胞抗原-Ⅱ(HLA-Ⅱ)类分子及抗原递呈细胞(APC)通过细胞间多种共刺激分子有效地提呈给初始CD4+Th0细胞,CD4+Th0细胞活化后因微环境中的细胞因子不同而分化成为功能不同的Th辅助细胞,进而分泌不同的细胞因子形成错综复杂的炎症介质网进一步损害肝脏。其中,当Th0分化形成Th1辅助细胞后分泌的干扰素-γ(IFN-γ)和白介素-2(IL-2)可以刺激细胞毒性的T淋巴细胞(CTL),增加人类白细胞抗原-Ⅰ(HLA-Ⅰ)类分子的表达,从而使得肝细胞更易遭受CD8+T淋巴细胞的攻击,同时也上调了肝细胞上HLA-Ⅱ类分子的表达,并且激活了巨噬细胞释放肿瘤坏死因子-α(TNF-α)和IL-1等炎症介质。另外,当Th0分化形成Th2辅助细胞后能够分泌产生IL-4、IL-10、IL-13细胞因子,促使 B淋巴细胞产生自身抗体。因此,AIH的免疫机制是从细胞免疫和体液免疫两方面共同对肝细胞造成损伤,所以,AIH也可以看作是T细胞介导为主的免疫性肝炎。除此之外,Th0细胞除了能够分化成具有促发免疫反应的Th1和Th2辅助细胞外,还能够分化成具有调控作用的调节性T细胞(T-regs),起到调节免疫平衡效果。
既往的研究多将目光放在CD4+T淋巴细胞分化的Th1及Th2两类效应Th细胞所介导的免疫应答上,而在新近的研究中,Th17细胞被认为是参与免疫调节中的重要分子,在自身免疫及炎症反应中起着重要作用,在许多实验中尤其是自身免疫性疾病[6-10]中如类风湿关节炎(rheumatoid arthritis,RA)、多发性硬化病(multip le sclerosismodels,MS)、自身免疫性脑脊髓炎(autoimmune encephalomyelitis,EAE)、系统性红斑狼疮(systemic lupus erythematosus,SLE)、炎症性肠病(inflammatory bowel disease,IBD)中都起着一定的作用,这意味着自身免疫性疾病的发病机制进一步为人们所知,无疑可以为治疗提供新的线索。那么Th17细胞与AIH的发病机制是否密切相关,能否通过调节Th17细胞及相关细胞因子达到治疗AIH的目的,本文就这两方面的研究进展对Th17细胞与AIH之间的联系进行概述。
2 Th17细胞诱导分化及其免疫调节作用
10年前免疫学家用疱疹病毒基因编码出一种新型细胞因子,因其可以既与CTLA8相结合,也能与一种新的细胞因子受体相结合,且不同于既往已知的细胞因子受体家族,故称为 IL-17[11]。在很长一段时间里,IL-17的来源及分化调控并不十分明确,最初人们将分泌IL-17的CD4+T细胞归类为Th1细胞,后来逐渐发现,产生IL-17的CD4+T细胞在细胞因子表达谱及免疫功能上与Th1和Th2细胞截然不同,并不表达IL-4或IFN-γ,却高水平分泌IL-17,因此被称作Th17细胞[12]。
Th17细胞除了高分泌 IL-17外,同时也能分泌TNF-α、IL-6、IL-22、IL-21及IL-26等细胞因子,因这类新型的CD4+Th细胞亚群的分化需要其独特的细胞因子和转录因子,因此被独立于既往的Th1、Th2和Treg细胞(见图1)。
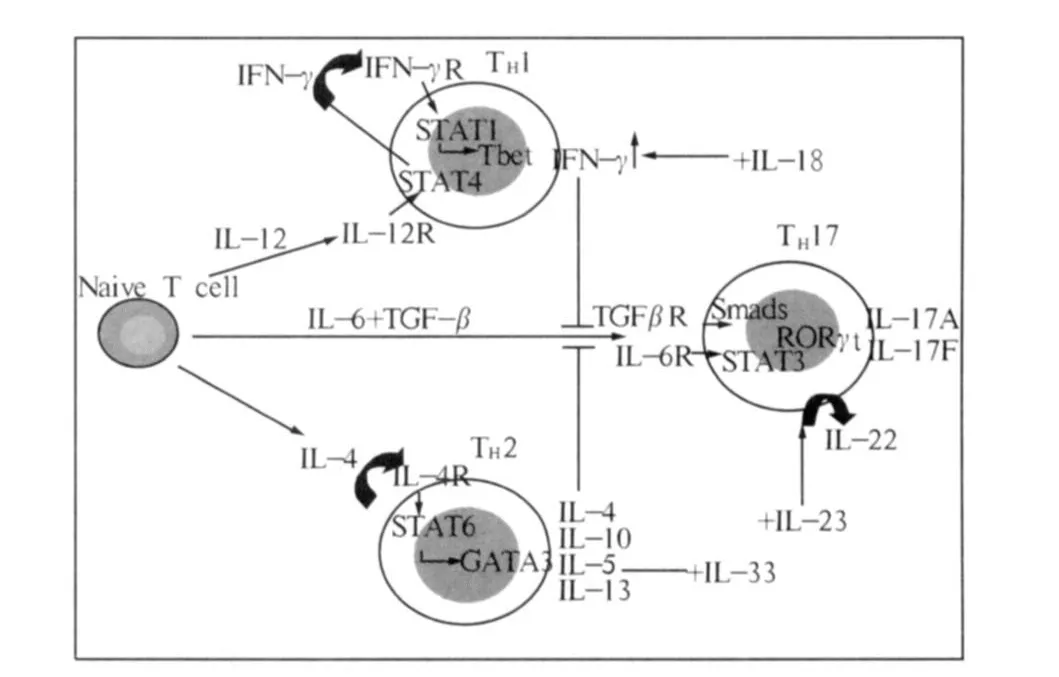
图 1 CD 4+T淋巴细胞亚群分化示意图[20]Fig 1 D istribution of CD 4+T lymphocy te subset
2.1 Th17细胞分化中的细胞因子 Th17细胞是CD4+Th0细胞下一类亚家族,与既往Th1、Th2及Treg有所不同,主要因为其分化所需的细胞因子不同。研究发现IL-6和TGF-β则是启动Th0细胞分化成Th17的主要细胞因子[13,14],其维持及扩增需要 IL-23和 IL-21的存在,而INF-γ和IL-4则是分化过程中的抑制性因素。
TGF-β和 IL-6:不同研究发现[14,15]转化生长因子β(TGF-β)是启动Th17分化的必要因素,在CD4+CD25+T调节细胞存在的情况下刺激静息T细胞,活化的T细胞减少IFN-γ及IL-2细胞因子的分泌,而IL-17分泌水平却明显升高,用抗体封闭 TGF-β,能够减少IL-17的产生,证明TGF-β是Th17细胞分化的重要因素。但同时Fantini等[16]研究也发现,单独以TGF-β诱导CD4+Th0细胞并不能向Th17细胞分化,而是分化形成表达FoxP3+T调节细胞,只有在IL-6协同下, Th0可以向Th17细胞进行有效的分化,并且同时能抑制FoxP3+T调节细胞的产生。因此认为TGF-β和IL-6的共同存在是 Th17细胞分化启动的必要条件。
IL-23:先前一些研究发现IL-23可引起由效应性T细胞分泌的促炎性反应细胞因子 IL-17的产生,参与Th17细胞诱导的自身免疫性疾病的发生,因此,一段时间以来IL-23被认为在Th17细胞分化中发挥重要作用,但后来研究发现[14-17],IL-23并不是启动初始CD4+T淋巴细胞分化成Th17细胞的因子,IL-23受体只在活化的Th细胞和记忆T细胞中表达,IL-23虽然能促进IL-17的表达,增强Th17细胞的效应,但并不是促进 Th17分化的因素,IL-23的缺陷并不能影响Th17细胞的分化,但是在Th17分化后期起到稳定分化作用,如IL-23缺陷可能导致Th17细胞不能正常扩增或生存。
IL-21:IL-21能够由Th17细胞自分泌产生,与IL-2属于同一家族,进一步的研究证实[18],IL-21能够潜在诱导Th17的分化并抑制FoxP3的表达,在IL-21或IL-21R的基因敲除小鼠模型中,即使IL-6和TGF-β同时存在也不能诱导 Th17完全分化,并且小鼠体内CD4+IL-17+T细胞也明显减少,这表明除了经典TGF-β联合IL-6模式,IL-21也是Th17细胞完全分化的必要细胞因子。
IFN-γ和 IL-4:近年来有研究[12]发现,IFN-γ和IL-4可以干扰TGF-β诱导Th17细胞分化的过程,在Th17细胞分化过程中具有抑制作用;也有实验发现在体外细胞培养中,当存在抗 IFN-γ单抗时大多数的初始型CD4+T细胞都向着Th17细胞分化,阻断IL-4的作用后也能观察到类似的结果。这些研究发现均证明Th17与Th1和Th2的不同。
2.2 Th17细胞分化中的转录因子 Th细胞的分化及效应细胞因子的表达是由转录因子所决定的,不同的Th细胞亚群其转录因子有所不同,初始CD4+T淋巴细胞分化为Th1过程中表达T-bet、STAT1和STAT4等转录因子,其中IL-12主要通过STAT4转录因子来调节Th1的分化,IFN-γ则是通过STAT1、T-bet转录因子促使Th0向Th1转化,而STAT6、GATA-3、c-Maf等转录因子与Th2分化密切相关,研究发现,除去这些转录因子均不影响Th17的分化。Park等[12]认为,IL-17的表达在组织炎症反应中起着重要作用,且是Th效应细胞一个独立的体系,与Th1、Th2亚群的细胞因子表达及转录程序并不相同,其分化经历完全不同的路径。研究发现[19,20],RORγt、STAT3是Th17分化过程中的重要转录因子,这些转录因子与 Th1、Th2分化无关,这进一步说明了Th17是一类与Th1、Th2、Treg不同的亚群。
3 Th17细胞在AIH中的作用
随着Th17的发现,一些既往无法以Th1、Th2解释的慢性炎症性疾病的病理生理逐渐为人们所了解,在一些啮齿类动物的自身免疫性脑脊髓炎模型中,除去了 IL-17表达,疾病进程得以延缓,严重程度下降,组织损伤有所改善,并且模型动物恢复时间明显提前[21,22]。另外,与 Th17细胞相关的一些人类的炎症性疾病如病毒性肝炎等[23]也逐步为人们所发现,然而,Th17与自身免疫性肝病尤其是AIH的研究十分少见。
3.1 肝脏与免疫 肝脏是人体免疫系统中一个重要的免疫器官,它有着特殊的解剖结构(肝动脉及门静脉的双重血供)和免疫相关性细胞,并且为细胞因子、补体、急性反应蛋白提供作用场所,因此,肝脏在免疫应答、免疫调节及免疫耐受中发挥重要作用。AIH的肝脏损伤中是以CD 4+T淋巴细胞浸润为主,另外包括了Kupffer细胞、NK细胞等,这些免疫细胞一旦激活就可通过释放不同细胞因子来实现免疫应答,清除人体内的病原菌,然而自身免疫系统是一把“双刃剑”,一旦调解机制失去平衡,在清除病原菌的同时也可以产生自身免疫反应而导致自身组织损伤。
3.2 Th17在AIH发病机制中的作用 AIH本质上是肝脏免疫系统紊乱所致的疾病,主要表现在AIH患者自身肝脏免疫攻击增强及以Treg细胞为主的肝脏免疫调节机制的破坏上。因为AIH患者较正常人容易促发自身免疫反应,既往研究发现,AIH患者的肝细胞较正常人的肝细胞高表达HLA-Ⅱ及HLA-Ⅰ类分子[24],并且在肝组织活动性病变区聚集分布着大量树突状细胞[25],为促发免疫反应提供大量的“物质传递者”,一旦免疫促发后Th分泌的细胞因子构成的炎症介质网就对肝脏造成直接损害,其中IFN-γ、IL-4、TNF-α是主要参与损伤的因子。另外,AIH患者同时存在抑制性调节 T细胞的破坏,表现为在对免疫应答负调节及免疫耐受中发挥重要作用的CD4+CD25+调节性T细胞在数量及功能上均有缺陷[26],从而肝脏免疫攻击得不到控制以至于肝脏进一步损伤。近年来随着对Th17的不断研究,发现Th17细胞在许多器官特异性自身免疫性疾病的发病机制中发挥着重要作用,虽然Th17与自身免疫性肝病相关研究并不多,但是已经引起了广泛关注。
研究发现,急性肝损伤中 IL-17有所升高,相比其他炎症介质IL-17水平在重症肝损伤及暴发性肝衰竭升高更为显著[27],在慢性 HBV感染患者的外周血及肝脏中 IL-17也存在高表达[28],在感染所致肝脏肉芽肿性疾病[29]、肝脏缺血再灌注的动物模型[30]中均发现有IL-17的升高现象。Lan等[31]在研究Th17细胞与肝脏疾病之间的联系时,发现与对照组相比,肝脏相关性疾病包括AIH、PBC、CHC、NASH等患者肝脏汇管区IL-17表达明显增多,其中以AIH的IL-17表达数量最多;另外该实验中也发现IL-2RαKO小鼠及正常B6小鼠在肝脏及脾脏中均表达IL-17,但IL-2RαKO小鼠的PBC动物模型中,肝脏组织门管区Th17的表达较脾脏中多,同时也较正常 B6小鼠表达多,血清 IL-17水平明显增高,第 8周达到高峰,持续至第 13周开始下降,这提示 IL-17可能参与自身免疫性肝病早期的发展,且肝脏微环境在Th17细胞效应时起着不可或缺的作用。此外,在研究胆管固有免疫在PBC发病过程中作用时发现[32],Th17相关细胞因子IL-17等在PBC患者胆管的慢性炎症中起着重要作用。Lafdil等学者认为[33],细胞因子 IL-17受体几乎表达于所有类型肝脏细胞上,它主要通过刺激多种类型的肝脏非实质细胞产生前炎症介质及趋化因子,从而对肝脏造成了损伤。综上所述,我们认为Th17细胞及其分泌的炎症介质可能参与了自身免疫性肝病AIH的发病机制过程。
其次,目前认为肝脏免疫调节机制的破坏同样是自身免疫性肝病发病机制中的不可或缺的部分。我们已知Treg是一类起到免疫调节的T淋巴细胞,它在维持机体免疫自稳状态和诱导免疫耐受中发挥重要所用。如前所述,Treg是由初始CD4+T分化而成的一类T淋巴细胞,近来不少学者发现Treg与Th17的分化和功能效应有着某些相互联系[34],TGF-β可以诱导CD4+Th0细胞分化为FoxP3+Treg细胞从而维持免疫耐受,阻止疾病的发生,但是当TGF-β和IL-6共同存在时,CD4+Th0则朝向Th17细胞分化,介导炎症反应。AIH患者的肝脏免疫调节机制遭到破坏,体现在肝脏Treg的缺陷,具体表现为CD4+CD25+调节性T细胞在数量及功能上均有缺陷[26]以及 TGF-β的表达异常。Sakaguchi等[35]发现,AIH患者外周血单核细胞TbetaRⅡmRNA表达降低,提示调节性细胞的异常参与了AIH的免疫功能破坏。另外发现在其他自身免疫性肝病中如PBC患者的外周血中Treg细胞数量明显低于正常对照组,但与疾病的严重程度无明显相关性。因为Treg细胞在肝脏免疫中起着重要的作用,如在病毒性肝炎和肝癌中表现为过度调节,又如在自身免疫性肝病、移植排异反应及急性肝衰竭中表现为抑制不足等[34],因此,我们有理由可以相信 Th17细胞与Treg细胞之间的相互关系极可能在AIH的发病机制中起着一定的作用。
3.3 Th17在AIH中的治疗作用 作为CD4+T族群的一种新型Th细胞,早期研究发现Th17细胞及其产生的细胞因子与炎症反应及自身免疫性疾病的发病机制密切相关,近年来又有实验指出Th17在机体防御机制中发挥作用。IL-22也是由Th17细胞分泌的一种重要的细胞因子,研究发现,上皮细胞很有可能是IL-22的主要靶细胞,可以与一些组织器官的腺泡细胞、肝细胞、角质形成细胞、结肠上皮下肌成纤维细胞等作用,诱导其产生细胞因子、趋化因子、急性反应蛋白等炎症因子和多种抗菌肽等[36]。研究证明了IL-22不仅有促炎作用,同时也存在着宿主防御、组织修复等作用,此外在感染性疾病和自身免疫性疾病中IL-22都发挥着相当重要的作用,其中既有促炎反应,又有宿主防御作用。Zenewicz等发现,在急性肝炎中,Th17所分泌的IL-22而非IL-17具有肝细胞保护作用,而IL-22缺乏的小鼠极易导致肝脏有害的免疫反应[23]。随后又有学者同样发现了 IL-22受体存在于肝脏上皮细胞上[33],其效应主要表现为促进肝细胞的存活及增殖。然而,IL-22在疾病过程中这种双重作用的具体调节机制并不完全明确,但仍旧可以考虑用 IL-22作为靶分子来设计药物抑制炎症反应。另外,近来实验[37]也发现了激活骨髓中STAT3能够抑制STAT1依赖的Th1分化途径产生炎症因子IFN-γ,从而抑制T细胞介导的肝炎,而激活T细胞中的STAT3则能够减轻T细胞介导肝炎的疾病程度,这无疑为 T细胞介导的肝炎治疗提出了新的战略。
Th17是炎症微环境中的重要效应细胞,可以分泌多种细胞因子,其分化也受多种细胞因子影响,虽然目前对于Th17细胞及其相关分子并不完全清楚,但是随着研究的深入,以Th17作为靶点可以为AIH的治疗提供新的思路。
4 研究价值
既往肝脏免疫性疾病尤其是AIH的药物治疗主要着重于抑制肝脏的免疫反应,药物主要有皮质类固醇激素,作用于免疫系统,抑制 T淋巴细胞活性,硫唑嘌呤则能阻止淋巴细胞前体的成熟。此外尚有环孢素A、KF506及抗代谢药物抗自身免疫反应,合理的免疫抑制治疗的缓解率可达 60%~80%,10年生存率达90%[1,2],但仍有 20%患者对治疗无应答,这就需要对AIH的发病机制更加深入的研究,从而更好地指导治疗。Th17细胞的发现不仅对AIH的发病机制有了进一步了解,而且为治疗的进展也提供了新的视野,考虑以抑制Th17细胞为基础的自身免疫系统疾病的治疗尚处于研究阶段,在自身免疫性关节炎(CIA)治疗中发现,青蒿素衍生物SM905治疗的机制在于抑制胶原诱导的T细胞增殖和IL-17的产生,降低IL-17A、IL-26、ROR2γ的 mRNA表达[38],从而减轻疾病严重程度,这表明抑制 Th17相关因子的活性有助于缓解疾病。另外,IL-6作用于肝细胞可产生急性期反应,加速肝脏铁调素的合成,产生自身抗体,引起一系列临床症状,抗IL-6受体抗体tocilizumab被证明可以改善此类情况,且IL-6对Th17的分化启动起着重要作用,进而推动了自身免疫性疾病的发生发展,这又间接说明了tocilizumab除了抗炎作用外对基础免疫也有所影响[39]。IL-22也是Th17细胞分泌的重要细胞因子,既往认为IL-22与Th17分泌的其他细胞因子如IL-17等是慢性炎症疾病的前炎症介质,参与炎症反应。据新的研究发现,在肝脏急性炎症反应中 IL-22起着保护肝细胞作用[23,33],这一发现无疑为新药的开发提供新的靶点。此外,近来发现[37]激活骨髓细胞中 STAT3也能成为一种新的治疗方法。这些研究结果意味着对于Th17细胞研究有着十分重要的临床价值,它对于肝脏免疫性疾病乃至AIH的治疗进展提供了新的线索。
5 展望
AIH是当今医学界仍旧未能完全攻克的肝脏疾病,其发病机制尚不完全清楚,临床表现或轻或重。治疗方面,多数患者对免疫抑制剂的反应较好,但对于少数难治性AIH或对免疫抑制剂治疗不能耐受的患者,以及进展至终末期肝病的患者仍旧需要肝移植治疗。虽然肝移植治疗技术现今越来越成熟,存活率也越来越高,但因为费用昂贵及资源有限不可能满足所有患者,这就对研究者提出了高难度的挑战,需要在药物治疗方面有新的突破。
了解病因无疑可以指导治疗,所以对AIH的发病机制进一步探讨及深入研究对临床应用有着重要的意义,Th17细胞为新近发现的与免疫相关的Th辅助细胞,它的发现虽然尚在研究阶段,与AIH的相关研究报道也十分少见,但是已有的研究逐渐证明了Th17在肝脏免疫系统中的地位,进一步展开这方面的研究很有必要,其意义也很深远。
[1]Krawitt EL.Autoimmune Hepatitis[J].N Engl JMed,2006,354 (1):54-66.
[2]Czaja AJ,FreeseDK,American Association for the Study of Liver Disease.Diagnosis and treatment of autoimmune hepatitis[J].Hepatology,2002,36(2):479-497.
[3]Johnson PJ,McFarlane IG.Meeting report:International Autoimmune Hepatitis Group[J].Hepatology,1993,18(4):998-1005.
[4]Alvarez F,Berg PA,Bianchi FB,et al.International Autoimmune Hepatitis Group report:review of criteria for diagnosis of autoimmune hepatitis[J].JHepatol,1999,31(5):929-938.
[5]Hennes EM,Zeniya M,Czaja AJ,etal.Simplified criteria for the diagnosis of autoimmune hepatitis[J].Hepatology,2008,48(1):169-176.
[6]Kohno M,Tsutsumi A,Matsui H,et al.Interleukin-17 gene expression in patients with rheumatoid arthritis[J].Mod Rheumatol,2008, 18(1):15-22.
[7]Lock C,HermansG,Pedotti R,etal.Genemicroarrayanalysisofmultiple sclerosis lesions yields new targets validated in autoimmune encephalomyelitis[J].Nat Med,2002,8(5):500-508.
[8]Cua DJ,Sherlock J,Chen Y,et al.Interleukin-23 rather than interleukin-12 is the critical cytokine for autoimmune inflammation of the brain[J].Nature,2003,421(6924):744-748.
[9]Wong CK,Ho CY,Li EK,et al.Elevation of proinflammatory cytokine(IL-18,IL-17,IL-12)and Th2 cytokine(IL-4)concentrations in patientswith systemic lupus erythematosus[J].Lupus,2000,9(8): 589-593.
[10]Fujino S,Andoh A,Bamba S,etal.Increased expression of interleukin 17 in inflammatory bowel disease[J].Gut,2003,52(1): 65-70.
[11]Yao Z,Fanslow WC,Seldin MF,et al.Herpesvirus Saimiriencodes a new cytokine,IL-17,which binds to anovel cytokine receptor[J]. Immunity,1995,3(6):811-821.
[12]Park H,LiZ,Yang XO,et al.A distinct lineage of CD 4 T cells regulates tissue inflammation by producing interleukin 17[J].Nat Immunol,2005,6(11):1133-1141.
[13]Kimura A,Naka T,Kishimoto T.IL-6-dependent and-independent pathways in the development of interleukin 17 producing T helper cells[J]. PNAS,2007,104(29):12099-12104.
[14]Veldhoen M,Hocking RJ,Atkins CJ,et al.TGFbeta in the context of an inflammatory cytokinem ilieu supports de novo differentiation of IL-17-producing T cells[J].Immunity,2006,24(2):179-189.
[15]Mangan PR,Harrington LE,O'Quinn DB,et al.Transform ing growth factor-beta induces developmentof the T(H)17 lineage[J]. Nature,2006,441(7090):231-234.
[16]Fantini M C,Becker C,Monteleone G,etal.Cutting edge:TGF-beta induces a regulatory phenotype in CD4+CD25-T cells throμgh FoxP3 induction and down-regulation of Smad7[J].J Immunol, 2004,172(9):5149-5153.
[17]Aggarwal S,Ghilardi N,Xie MH,et al.Interleukin-23 promotes a distinct CD 4 T cell activation state characterized by the production of interleukin-17[J].JBiol Chem,2003,278(3):1910-1914.
[18]Nurieva R,Yang XO,Martinez G,et al.Essential autocrine regulation by IL-21 in the generation of inflammatory T cells[J].Nature, 2007,448(7152):480-483.
[19]Ivanov II,McKenzie BS,Zhou L,etal.The orphan nuclear receptor RORγtdirects the differentiation program of proinflammatory IL-17+ T helper cells[J].Cell,2006,126(6):1121-1133.
[20]Stockinger B,Veldhoen M.Differentiation and function of Th17 T cells[J].Curr Opin Immunol,2007,19(3):281-286.
[21]Komiyama Y,Nakae S,Matsuki T,et al.IL-17 plays an important role in the development ofexperimental autoimmune encephalomyelitis[J].J Immunol,2006,177(1):566-573.
[22]Fitzgerald DC,Ciric B,Touil T,et al.Suppressive effectof IL-27 on encephalolithogenic TH17 cellsand the effector phase of experimental autoimmune encephalomyelitis[J].J Immunol,2007,179(5): 3268-3275.
[23]Zenewicz LA,Yancopoulos GD,ValenzuelaDM,et al.IL-22but not IL-17 provides protection to hepatocytes during acute liver inflammation[J].Immunity,2007,27(4):647-659.
[24]Senaldi G,Portmann B,Mowat AP,et al.Immunohistochem ical featuresof the portal tractmononuclear cell infiltrate in chronic aggressive hepatitis[J].A rch Dis Child,1992,67(12):1447-1453.
[25]MiyakawaH,KitazawaE,Kikuchi K,et al.Immunoreactivity to various human cytochrome P450 proteins of sera from patients with autoimmune hepatitis,chronic hepatitis B,and chronic hepatitis C[J]. Autoimmunity,2000,33(1):23-32.
[26]Longhi MS,Hussain MJ,Mitry RR,etal.Functionalstudy ofCD 4+ CD25+regulatory T cells in health and autoimmune hepatitis[J].J Immunol,2006,176(7):4484-4490.
[27]Yasum i Y,Takikawa Y,Endo R,et al.Interleukin-17 as a new marker of severity of acute hepatic injury[J].Hepatol Res,2007, 37(4):248-254.
[28]Zhang JY,Zhang Z,Lin F,et al.Interleukin-17-producing CD 4+T cells increase with severity of liver damage in patients with chronic hepatitis B[J].Hepatology,2009,51(1):81-91.
[29]Rutitzky LI,Bazzone L,Shainheit MG,et al.IL-23 is required for the development of severe egg-induced immunopathology in schistosomiasis and for lesional expression of IL-17[J].J Immunol,2008, 180(4):2486-2495.
[30]Caldwell CC,Okaya T,Martignoni A,et al.Divergent functions of CD4+T lymphocytes in acute liver inflammation and injury after ischem ia-reperfusion[J].Am J Physiol Gastrointest Liver Physiol, 2005,289(5):G969-G976.
[31]Lan RY,Salunga TL,Tsuneyama K,et al.Hepatic IL-17 responses in human and murine primary biliary cirrhosis[J].J Autoimmun, 2009,32(1):43-51.
[32]Harada K,Shimoda S,Sato Y,et al.Periductal interleukin-17 production in association with biliary innate immunity contributes to the pathogenesisof cholangiopathy in primary biliary cirrhosis[J].Clin Exp Immunol,2009,157(2):261-270.
[33]Lafdil F,Miller AM,Ki SH,et al.Th17 cells and their associated cytokines in liver diseases[J].Cell Mol Immunol,2010,7(4): 250-254.
[34]Zhao L,Qiu de K,Ma X,etal.Th17 cells:the emerging reciprocal partner of regulatory T cells in the liver[J].JDig Dis,2010,11 (3):126-133.
[35]Sakaguchi K,Kitano M,Nishimura M,et al.Serum levelof transforming growth factor-beta1(TGF-beta1)and the expression of TGF-beta receptor type II in peripheral blood mononuclear cells in patients with autoimmune hepatitis[J].Hepatogastroenterology,2004,51 (60):1780-1783.
[36]Sa SM,Valdez PA,Wu J,etal.The effects of IL-20subfamily cytokines on reconstituted human epidermis suggestpotential roles in cutaneous innatedefense and pathogenic adaptive immunity in psoriasis[J].J Immunol,2007,178(4):2229-2240.
[37]Lafdil F,Wang H,Park O,et al.Myeloid STAT3 inhibits T cell-mediated hepatitis by regulating T helper 1 cytokine and interleukin-17 production[J].Gastroenterology,2009,137(6):2125-2135.e1-2.
[38]Wang JX,TangW,Zhou R,et al.The new water soluble artemisinin derivative SM 905ameliorates collagen-induced arthritisbysuppression of inflammatory and Th17 responses[J].Br JPharmacol,2008,153 (6):1303-1310.
[39]Ohsugi Y.Recent advances in immunopathophysiology of interleukin-6:an innovative therapeutic drug,tocilizumab(recombinant humanized anti-human interleukin-6 receptor antibody),unveils themysterious etiology of immune-mediated inflammatory diseases[J].Biol Pharm Bull,2007,30(11):2001-2006.

