鸭肝炎病毒现场分离株单克隆抗体的研制
周珍辉,陈万荣,周育森,向双云,曹金元,李玉冰,杨久仙,曹授俊 ,田璐,张浩
(1.北京农业职业学院 畜牧兽医系,北京 102442;2.中国军事医学科学院 微生物流行病研究所,北京 100071)
Ⅰ型鸭病毒性肝炎(serotypeⅠ duck viral hepatitis,DHV Ⅰ )由Ⅰ型鸭肝炎病毒引起,以发病急、传播快、病程短、死亡率高为主要特征,临床表现为痉挛、抽搐和角弓反张等神经症状,主要病变为肝脏出血、坏死和肿胀,是危害养鸭业最严重的疾病之一[1-4]。笔者对分离的DHV进行纯化,并制备单克隆抗体,旨在建立特异性强、敏感性高、简便快速的DHV检测方法。
1 材料与方法
1.1 材 料
毒株由北京某鸭场分离,经动物试验、鸭胚尿囊腔接种、PCR诊断,确诊为Ⅰ型鸭肝炎病毒[5-6]。试验动物BALB/c小鼠由中国军事医学科学院试验动物中心提供;SP2/0骨髓瘤细胞由中国军事医学科学院分子病原研究室提供;抗体亚类试剂盒购自Gibco公司;10日龄鸭胚及1日龄雏鸭购自北京三江宏利牧业有限公司。
1.2 抗原制备及鉴定
1.2.1 DHV抗原的纯化
将临床发病鸭的肝脏制成悬液,通过尿囊腔接种10日龄鸭胚,收集接种后4~5 d死亡的鸭胚尿囊液,反复冻融后,4 ℃ 6 000 r/min离心,去沉淀,取上清,加等量氯仿,振摇20 min,4 ℃ 6 000 r/min离心,去沉淀,取上清,重复上述过程6次,收集上清液。在收集的上清液中加入10% PEG6000及终浓度为0.4 mol/mL的NaCl,4 ℃磁力搅拌过夜后,4℃1 2 000 r/min离心,去上清,沉淀加少量pH7.4、0.01 mol/mL PBS重悬,再经蔗糖密度梯度超速离心纯化[7]。设30%和60% 2个蔗糖梯度,于10 mL离心管中,每一梯度溶液加4 mL,最后在溶液面上加粗提抗原2 mL,经35 000 r/min离心4 h,分别收集各明显的梯度带。纯化抗原作适当稀释,磷钨酸负染,透射电镜观察病毒粒子的形态及纯度。纯化病毒作免疫原免疫动物用和包被抗原检测抗体用。纯化抗原的蛋白质量浓度为0.77 mg/mL,-80 ℃冰柜冻存备用。
1.2.2 正常尿囊液抗原的制备
在制备DHV尿囊液的同时,取正常14至15日龄鸭胚尿囊液,同步纯化蛋白。除不进行超速离心外,其余按1.2.1的方法进行,检测蛋白质量浓度为1.94 mg/mL,作包被抗原间接ELISA法筛选抗体时排除非特异用,-80 ℃冰柜冻存,作为阴性抗原对照。
1.2.3 纯化抗原的病原性鉴定
将提纯抗原经0.22 µm滤膜处理,接种10日龄鸭胚5枚,对照组鸭胚注射生理盐水,每天照蛋2次,逐日统计鸭胚死亡情况;采取颈背部皮下注射的方式,注射1日龄雏鸭5只,对照组雏鸭注射生理盐水,观察雏鸭发病死亡情况。
1.3 免疫BALB/c小鼠
第1次免疫时取纯化抗原与福氏完全佐剂等量混合,充分乳化后,按每只100 µg(每只0.5 mL)的抗原量,采取腹部皮下两点注射的方式,注射8 周龄BALB/c 雌性小鼠3 只,另取1只小鼠注射生理盐水为对照;2周后取纯化抗原与福氏不完全佐剂乳化后进行第2次免疫,方法与第1次免疫相同;4周后进行第3次免疫,方法与第1次免疫相同;6周后从免疫小鼠和对照小鼠的尾尖采血,分离血清,将纯化的DHV抗原分别以2、5、10 µg/mL包被96孔板,同时用纯化的正常尿囊液蛋白按上述浓度分别包板,用间接ELISA法检测血清中的抗体含量。当免疫小鼠抗体含量较高时,融合前加强一次免疫,直接用纯化抗原经腹部皮下分两点注射免疫小鼠,第4天后取抗体含量最高的小鼠脾细胞与SP2/0骨髓瘤细胞融合,筛选抗体。
1.4 杂交瘤细胞株的融合和筛选
参照文献[8-9],取抗体含量最高免疫小鼠的脾细胞和处于对数生长期的SP2/0 细胞,按(1∶5)~(1∶10)的比例进行融合,融合后分装5块96孔板,置37 ℃5%CO2培养箱中,用筛选培养基进行培养,1周后改用HT培养基进行培养,每日观察细胞生长状况,7~9 d用间接ELISA法 进行检测筛选。用纯化抗原与纯化正常尿囊液蛋白分别包被96孔板,蛋白浓度为10 µg/mL,每孔100 µL,4 ℃过夜,次日用PBS-Tween-20洗涤3次,每孔加入100 µL初筛抗体,37 ℃作用1 h,用同样的方法洗板3次,加入酶标记的羊抗鼠IgG,37 ℃作用30 min,洗涤3次,加入显色剂显色后,再加终止液终止,用酶标仪测定OD值。选择经纯化抗原检测后OD值较高且与正常纯化尿囊液蛋白无反应的阳性孔进行亚克隆。用有限稀释法对阳性杂交瘤细胞连续进行3次亚克隆后,上清检测阳性率达100%的单克隆孔进行扩大培养,冻存细胞株,制备腹水。
1.5 腹水的制备、效价检测及特异性鉴定
1) 腹水的制备。参照文献[8],给每只BALB/c小鼠腹腔注射灭菌液体石蜡油0.5 mL,2 周后再注射杂交瘤细胞,每株单抗注射4只小鼠,每只0.5 mL,每1 mL含1×106个杂交瘤细胞。2 周左右有腹水产生,抽取腹水,56 ℃灭活冻存,备用。
2) 腹水效价的测定。将纯化抗原与纯化正常尿囊液蛋白包板后,用间接ELISA法检测腹水中的抗体效价。包被用抗原量为10 µg/mL,每孔100 µL。
3) 腹水的特异性鉴定。将腹水1∶100稀释,分别用纯化DHV抗原、正常纯化尿囊液蛋白和乙型肝炎表面抗原(HBS)包板,用间接ELISA法检测。
1.6 单克隆抗体亚类鉴定
用单克隆抗体亚类鉴定试剂盒测定8株单抗的类型。按说明书,用ELISA法进行检测。
1.7 鸭胚中和试验
采用固定病毒-稀释抗体法[10]进行EID50的测定:取经尿囊腔繁殖的病毒液用PBS进行10-1、10-2、10-3、10-4、10-5、10-6稀释,每个稀释度尿囊腔接种5枚10日龄鸭胚,7 d内逐日观察鸭胚的死亡情况,计算出200个TCID50的含量。将7株单抗所产生的腹水用滤膜过滤后,用PBS作1∶2、1∶4、1∶8、1∶16、1∶32稀释,用含200个TCID50的DHV病毒液分别与7株单抗原液不同稀释度的腹水等量混合,37 ℃作用2 h后,各稀释度尿囊腔接种10日龄鸭胚5枚,0.2 mL/枚,另设5枚接种病毒,作为对照。逐日观察9 d,记录鸭胚死亡情况。
1.8 雏鸭保护试验
1日龄雏鸭分为8组,每组8只,前7组分别颈背部皮下接种DHV-1、DHV-6、DHV-7、DHV-8、DHV-9、DHV-10、DHV-11、DHV-12腹水0.5 mL,24 h后接种含毒尿囊液0.2 mL,第8组只接种含毒尿囊液0.2 mL,作为对照。各组鸭分开饲养,连续观察7 d,记录各组鸭的死亡情况。
2 结果与分析
2.1 抗原的纯化及鉴定结果
病毒经冻融氯仿反复处理及离心后,去除了大量的杂蛋白,经PEG-6000 浓缩后,病毒蛋白含量大大提高。浓缩抗原经蔗糖密度梯度离心,共出现了2个明显条带。约位于30%蔗糖梯度间的条带为病毒带。在电镜下可见直径20~40 nm的病毒粒子,呈球形或类球形,颗粒结构清晰,大小、结构均符合Ⅰ型DHV特征(图1)。将纯化抗原接种鸭胚后可导致鸭胚全部死亡,胚体出血明显。攻毒1日龄雏鸭2~3 d后死亡,肝脏上有针尖到米粒大小的出血斑点。
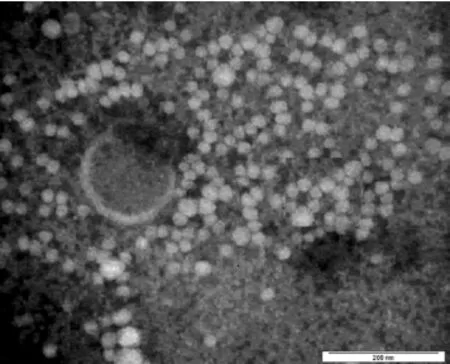
图1 鸭肝炎电镜照片Fig.1 Electricity lens picture of DHV
DHV病毒的纯化方法较多,在前期工作中用硫酸铵沉淀病毒后,发现杂蛋白多,病毒的形态被破坏,结构模糊[11-12]。通过反复冻融,氯仿去脂,PEG沉淀,蔗糖密度梯度离心后,得到了较纯的DHV,电镜下可见大量DHV颗粒,通过鸭胚尿囊腔接种,感染鸭胚全部死亡,说明经过上述纯化后,抗原保持了良好的活性。
2.2 小鼠免疫结果
小鼠三免后采血,纯化抗原包板后,检测出3只免疫小鼠血清抗体的效价为(1∶400)~(1∶16 000),正常小鼠的效价<(1∶100)。正常纯化尿囊液蛋白包板后,用间接ELISA法检测出3只免疫小鼠及正常小鼠血清抗体的效价均<1∶100。由此,可以排除分泌针对正常尿囊液抗体的杂交瘤细胞株。10 µg/mL抗原用量包板后所测得的OD值优于2、5 µg/mL的抗原用量,故在进行单克隆抗体的筛选中,将包板的最佳抗原用量定为l0 µg/mL。
免疫小鼠血清抗体含量检测结果显示,用纯化抗原包板检测的OD值显著高于用正常纯化尿囊液蛋白包板所测得的OD值。由此可知,免疫小鼠血清中的抗体主要由注射DHV抗原所致,小鼠免疫效果好,免疫用的DHV抗原纯度较高。
2.3 杂交瘤细胞株的融合和筛选结果
细胞融合经过初次检测,3次亚克隆后,共筛选出阳性杂交瘤细胞8株,分别命名为DHV-1、 DHV-6、DHV-7、DHV-8、DHV-9、DHV-10、DHV-11、DHV-12。在亚克隆过程中,有DHV-2、DHV-3、DHV-4、DHV-5共4株杂交瘤细胞分泌抗体特性丢失。DHV-1、DHV-6、DHV-7、DHV-8、DHV-9、DHV-10、DHV-11、DHV-12经过多次传代、冻存复苏后,保持了稳定分泌抗体的功能。在初次筛选时,选用OD值0.5以上的阳性孔进行亚克隆,这样可以更多地筛选出阳性的杂交瘤细胞株而不致于丢失。正常纯化的尿囊液以10 µg/mL包板筛选单克隆抗体时,OD值均为0.01~0.10,因此,筛选阳性孔时基本排除了非特异性反应。
2.4 腹水的效价及特异性鉴定结果
正常纯化尿囊液蛋白包板后,用间接ELISA法检测8株单抗腹水中的抗体效价均<(1∶100)。将纯化抗原包板后,用间接ELISA法检测8株单抗腹水中的抗体效价,DHV-7、DHV-8为1∶1 000,DHV-6、DHV-10为1∶8 000,DHV-1、DHV-9、DHV-11和DHV-12为(1∶32 000)~(1∶512 000)。由此可知,腹水中的抗体主要是针对DHV抗原产生的。经间接ELISA法鉴定,所制备的单克隆抗体与乙型肝炎表面抗原、正常纯化尿囊液蛋白无交叉反应,表明所制备的杂交瘤细胞具有良好的特异性。
2.5 单克隆抗体亚类鉴定结果
经MAb亚类鉴定,所获得的杂交瘤细胞株DHV-6、DHV-7、DHV-8、DHV-10为IgG1亚类,DHV-1、DHV-12为IgG2a亚类,DHV-2、DHV-9、DHV-11为IgG2b亚类,轻链均为k链。
2.6 鸭胚中和试验结果
接种病毒的鸭胚在接种后3~4 d全部死亡。DHV-6、DHV-7、DHV-9、DHV-10能原倍中和病毒,2倍稀释后中和保护率为50%,各稀释度均能明显延缓鸭胚的死亡。DHV-1、DHV-8、DHV-11、DHV-12原倍中和的保护率为50%,各稀释度均能明显延缓鸭胚的死亡。
2.7 雏鸭保护试验结果
保护试验结果显示,DHV-6、DHV-7、 DHV-9、DHV-10单抗对雏鸭的保护率为50.0%~62.6%。DHV-1、DHV-8、DHV-11、DHV-12 4株单抗对雏鸭的保护率差,在25%以下。
3 结论与讨论
正常鸭胚尿囊液中的混杂物很多,需对尿囊液中的病毒进行纯化。本研究中,在抗原纯化、小鼠免疫、杂交瘤细胞株的融合筛选、腹水效价检测试验中,均以正常尿囊液作对照,免疫用的DHV抗原纯度较高,排除了非特异性反应。在试验过程中,为防止细胞的突变返祖,确保骨髓瘤细胞对HAT的敏感性,每3~6个月应用8-氮杂鸟嘌呤(8-AG)筛选1次。细胞融合后第1次克隆化的时间应尽可能早,越早越不容易丢失阳性克隆。要尽早检测,以确定细胞融合后的克隆是否分泌特异性抗体。一旦检测为阳性,则不论其细胞克隆的大小,应立即进行克隆化,这是保证克隆化成功、获得稳定分泌McAb杂交瘤细胞系的非常重要的一环。即使克隆化过的杂交瘤细胞也需要定期再克隆,以防止杂交瘤细胞的突变或染色体丢失,从而丧失产生抗体的能力。
[1] 孙刚, 张加勇, 王宇祥, 等. 黑龙江省鸭肝炎病毒HD-I的分离与鉴定[J]. 中国兽医科技, 2007, 34(7): 63-65.
[2] 张展. Ⅰ型鸭病毒性肝炎的诊断与防治[J]. 兽医导刊, 2008, 126(2): 19-20.
[3] 苏环. 雏鸭病毒性肝炎的诊治[J]. 浙江畜牧兽医, 2009 (4): 14.
[4] 谢运锋. 中药在防治雏鸭病毒性肝炎中的应用[J]. 广西畜牧兽医, 2009, 25 (5): 276-277.
[5] 周珍辉, 李玉冰, 杨新建,等. 雏鸭病毒性肝炎的分离与初步鉴定[J]. 中国畜牧兽医, 2008, 35(3): 75-76.
[6] 周珍辉, 陈万荣. 用RT-PCR诊断Ⅰ型鸭肝炎病毒[J]. 湖南农业大学学报:自然科学版, 2008, 34(3): 338-340.
[7] 孙泉云, 刘虹, 李劲松, 等. 间接ELISA检测鸭肝炎病毒抗体的研究[J]. 中国兽医学报, 1997, 17(5): 347-349.
[8] 徐志凯. 实用单克隆抗体技术[M]. 西安: 陕西科学技术出版社, 1992: 55-68.
[9] 金伯泉. 细胞和分子生物免疫学实验技术[M]. 西安:第 四军医大学出版社, 2003: 21-45.
[10] 殷震, 刘景华. 动物病毒学[M]. 2版. 北京: 科学出版社, 1997: 11.
[11] 杨萍萍, 宋敏训, 艾武, 等. 鸭肝炎病毒单克隆抗体的研制[J]. 中国预防兽医学报, 2006, 28(8): 212-216.
[12] 罗函禄, 徐汉祥, 范文明, 等. 鸭病毒性肝炎病毒的纯化及电镜观察[J]. 中国畜禽传染病, 1990, 52(3): 1-2.
英文编辑:罗文翠

