猪繁殖候选基因HoxA10的克隆及表达分析
周晓宁,方梅霞,何小梅,聂庆华*,张细权
(1.华南农业大学 动物科学学院,广东 广州 510642;2.广东省农业动物基因组学与分子育种重点实验室,广东广州 510642;3.暨南大学 医学院,广东 广州 510632)
HoxA10是同源框基因(HomeoBox,Hox) 亚类腹 B(AbdB)基因成员之一[1],在生殖与胚胎着床、发育等方面有重要作用。HoxA10基因敲除小鼠的子宫输卵管连接处消失,子宫近侧25%部分呈输卵管状狭窄卷曲[2]。Satokata等[3]的研究证实了这一点,HoxA10(–/–) 小鼠可以存活,但由于子宫内膜缺乏胚胎着床环境,子宫内膜不能进入容受状态,导致胚胎死亡,表现为不孕。雄性动物的研究也显示出生殖障碍。Benson 等[4]发现,HoxA10(–/–) 突变雄鼠出现双侧隐睾和副性器官以及精子发育障碍等形态异常,可见,HoxA10基因在生殖器官的完整发育以及胚胎着床过程中有重要的调控作用,是动物繁殖性状的重要候选基因。近年来,对HoxA基因的研究主要集中在对人和啮齿类的研究中。人HoxA10基因定位于染色体7p15.3[2]。在成人子宫内膜,HoxA10的表达依赖于月经周期,是子宫蜕膜化过程的一个关键因素[5]。李红等[6]发现,HoxA10基因在正常育龄妇女和不明原因不孕患者的增殖早、晚期及分泌早期,子宫内膜腺上皮和间质均有表达,相互之间无显著差异,但在分泌中、晚期,正常育龄妇女子宫内膜的腺体和间质HoxA10基因mRNA有显著高表达。关于啮齿类的研究[2]表明,小鼠HoxA10基因定位于6号染色体。在小鼠胚胎发育过程中,HoxA10基因在苗勒管和成熟子宫内膜中均有表达[7]。桂耀庭等[8]发现,在正常人和隐睾症患者的睾丸组织中,HoxA10均有表达,但是与正常人相比,HoxA10基因在隐睾症睾丸组织的表达显著降低。HoxA10基因在生殖与胚胎着床、发育等方面有重要的作用, 对HoxA10基因的研究有利于了解猪的繁殖性状,进而提高猪的繁殖性能。目前对猪HoxA10基因的研究较少[9],对猪HoxA10基因的序列、结构等相关信息都还缺乏研究。笔者在对猪HoxA10基因生物信息学进行分析的基础上,用RT-PCR、Real-Time PCR等方法,研究该基因的克隆及表达,现将结果报道如下。
1 材料与方法
1.1 材 料
于广东省农业科学院畜牧研究所随机选取120日龄长白母猪1头,放血屠宰后,立即采集垂体、大脑、小脑,丘脑、卵巢、肺、胃、背肌、大肠、腹脂、肝、后肌、淋巴、脾、前肌、肾、输卵管、小肠、子宫、背膘等组织,-80 ℃保存。子宫组织用于HoxA10基因cDNA序列扩增,所有组织用于基因表达规律分析。
1.2 猪HoxA10基因预测
将人HoxA10基因 cDNA序列(GeneBank NM_153715.3)与猪全基因组序列比对,定位猪HoxA10基因。根据人HoxA10基因信息及外显子-内含子交接的GT-AG规则,对猪HoxA10基因进行预测,并对外显子进行拼接,最终获得猪HoxA10基因的预测cDNA序列及可能的基因结构。
1.3 引物设计
根据预测的猪HoxA10基因cDNA序列,共设计了3对引物(表1)。P1用于猪HoxA10基因cDNA序列扩增;qs-hoxa用于该基因各组织表达分析,qs-actin为内参基因β-actin引物。所有引物均使用Genetool软件设计,送由上海生工生物工程有限公司合成。

表1 各引物基本信息Table 1 Descriptions of the 3 primers used in this study
1.4 HoxA10基因 cDNA序列扩增
用常规Trizol方法,抽提猪各组织中总RNA,用 TOYOBO公司的反转录试剂盒将各组织的总RNA反转录成cDNA,并以看家基因(β-actin)引物扩增,验证反转录是否成功,将反转录产物-20 ℃保存备用。以子宫cDNA为模板,RT-PCR 扩增HoxA10基因cDNA序列,10 µL反应体系中包括:0.4 µL cDNA、0.25UTaqDNA polymerase (东盛生物)、12.5 pmol P1或P2、5 µL 2×PCR Reaction Mix,其余用ddH2O补齐。PCR反应条件:94 ℃预变性3 min,94 ℃变性30 s,58 ℃退火30 s,32个循环,最后72℃延伸5 min,4 ℃保存。
PCR产物用1%琼脂糖凝胶电泳检测,并切胶纯化后连接至pMD18-T载体,转化至大肠杆菌感受态细胞,进行克隆测序。
1.5 猪HoxA10基因序列分析与功能预测
1.5.1 物种间HoxA10基因CDS的同源性分析
登录NCBI的BLAST程序[10],在GenBank数据库选择“Nucleotide blast”,将所得到的猪HoxA10基因CDS序列输入NCBI/Blast软件的序列输入框内,选择程序“Megablast”进行同源性检索;采用DNAstar软件中的MegAlign对猪HoxA10基因CDS序列与 BLAST得到的其他物种的HoxA10基因CDS序列(图2)进行同源性比对。
1.5.2 蛋白质功能预测
采用 ExPASY的 ComputepI/MW 程序和SAPS(statistical analysis of protein sequences),对HoxA10基因蛋白序列的相对分子质量、氨基酸组成、等电点进行分析。
采用网上的motif数据库进行motif、结构位点、机构功能域功能预测。
1.5.3 9个物种HoxA10基因的系统进化分析
利用MEGA3.1程序,对不同动物HoxA10或pHoxA10基因的核苷酸序列进行BLAST分析,再计算物种间的同源距离,并通过邻近归并法构建物种间系统发生树。
1.6 荧光定量PCR
选用SYBR Green PCR Master Mix(TOYOBO,Japan)试剂盒,用 ABI PRISM®7500 Sequence Detection System(Applied Biosystems,Foster City,CA,USA)分析仪对各组织HoxA10基因mRNA丰度进行定量检测。不同组织的HoxA10基因mRNA拷贝数使用β-actin作为内参进行校正。目的基因荧光定量PCR引物为qs-hoxa,内参基因的引物为qsactin。采用20 µL反应体系,其中包括5 µL cDNA模板,10 µL 2 × Q-PCR SYBR Green Mix,0.5 µL的上下游引物,其余用蒸馏水补齐。每个样本设3个重复,分别使用引物qs-hoxa和qs-actin进行扩增。PCR按 ABI公司提供的程序和优化后的退火温度进行。PCR产物特异性使用溶解曲线判定。每个组织HoxA10基因 mRNA的相对表达量用 2-ΔΔCt表示,其中,ΔCt=目的基因Ct- 内参Ct;ΔΔCt=待测样品中目的基因ΔCt- 参照样品中目的基因ΔCt(若无参照样品则选择ΔCt最大的样品为参照进行计算,本试验中以脾脏中目的基因ΔCt为参照) 。
2 结 果
2.1 猪HoxA10 cDNA克隆
对猪HoxA10基因预测的结果显示,HoxA10基因位于猪18号染色体正链44195018—44204802,由2个外显子和1个内含子组成,cDNA序列长2 247 bp,预计编码合成94个氨基酸残基。RT-PCR结果显示,从猪子宫组织中克隆获得HoxA10基因cDNA长538 bp,包括1个285 bp的开放阅读框,共编码合成94个氨基酸残基(图1),与预测相同。

图1 猪HoxA10基因cDNA序列Fig. 1 cDNA sequence of pig HoxA10 gene
2.2 猪HoxA10基因序列分析与功能预测
2.2.1 物种间HoxA10基因CDS的同源性分析
从NCBI网站收集了9个物种HoxA10基因的CDS及氨基酸序列(表 2)。用 DNAstar软件中的MegAlign对各序列间的同源性进行分析(表3),发现猪的CDS与牛的同源性最高,达到94.7%;猪的CDS与人和小鼠的同源性分别为90.9%和90.5%;氨基酸同源性比对显示,猪与人、牛的氨基酸同源性达到了98.9%,与小鼠的同源性为97.9%。
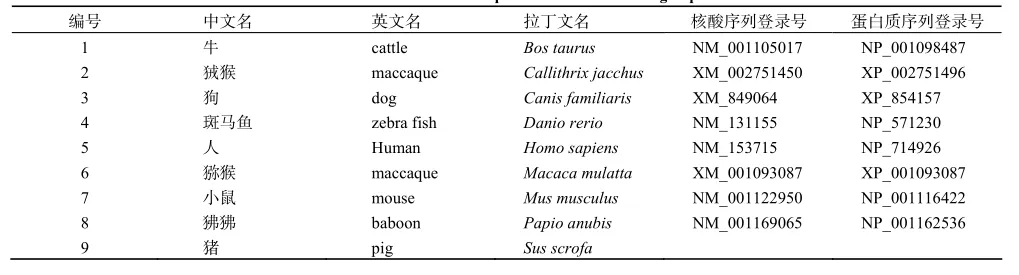
表2 9个物种HoxA10的蛋白质和cDNA序列Table 2 Protein and cDNA sequences of HoxA10 among 9 species

表3 不同物种HoxA10基因CDS序列及氨基酸序列的同源性比较Table 3 Homology of HoxA10 CDS and its amino acid sequences among different species
2.2.2 蛋白质功能预测
猪HoxA10蛋白序列的相对分子质量、氨基酸组成、等电点的分析结果显示,HoxA10蛋白相对分子质量为1.15×104,在94个氨基酸残基中共包含22个强正极性氨基酸(如K、R),9个强负极性氨基酸(如D、E),等电点为10.60,推测为一个碱性氨基酸。
2.3 9个物种HoxA10或pHoxA10基因的系统进化分析
聚类分析显示,9个物种被划分为界线清晰的4个类群,狨猴、狒狒、人等灵长类聚为一类,狗和小鼠聚为一类,鸡和斑马鱼各自成一类(图2)。

图2 9个动物种的系统进化树Fig.2 Phylogenetic tree among 9 animal species
2.4 猪HoxA10基因组织表达
猪HoxA10基因在很多组织都有表达,其中,前肌的表达量最高,腹脂、后肌、肾、大肠、输卵管、子宫也有较高的表达,脾、淋巴、肝、小肠的表达较低。另外,垂体、大脑、小脑、丘脑、卵巢、肺、胃、小肠、背肌、背膘等10种组织中,HoxA10的表达很低或无表达。
3 讨论与结论
本试验中从猪的子宫组织中克隆了HoxA10基因的cDNA,其序列长538 bp,包括一个285 bp的ORF(开放阅读框),编码94个氨基酸残基;144 bp的5'UTR和109 bp的3'UTR;该基因在猪各组织中均有表达,以前肌的表达量最高;其次为肾、子宫、后肌、输卵管等组织;脾、淋巴、肝、小肠的表达较低;在垂体、大脑、小脑、丘脑、卵巢、肺、胃、小肠、背肌、背膘等组织中基本无表达。HoxA10基因在生殖系统的发育以及胚胎着床等生殖过程中有重要作用。HoxA10基因敲除的雌性小鼠会出现胚胎着床障碍,雄性小鼠会出现双侧隐睾和副性器官以及精子发育障碍等;因此,推测HoxA10基因在胚胎形成过程中参与调节泌尿生殖管的发育,也是维持个体生殖力的重要因素[11]。通过对本试验获得的HoxA10序列进行分析,结果显示,该基因的 CDS与牛的同源性最高,达到94.7%;与人和小鼠的同源性分别为90.9%、90.5%。聚类分析也显示,猪与牛的亲缘关系最近,与斑马鱼亲缘关系较远。9个物种的HoxA10氨基酸序列系统进化树也与几类动物(灵长类、低等哺乳动物、禽类、鱼类)的分类学及人类对于动物进化的认识一致;因此,所获序列为猪HoxA10基因序列,与预测的结果相同。据报道,在人和小鼠中,HoxA10基因均有2个转录本,本试验中只利用人的其中一种转录本为参照进行猪HoxA10基因的序列预测。同样,根据人HoxA10基因的另一种转录本进行预测,猪HoxA10基因也与人和小鼠一样存在另一种转录本,本课题组拟对此预测结果进行验证。
从基因的表达规律看,HoxA10基因在猪的各组织中分布不是很广泛,以前肌的表达量最高,肾、子宫、后肌、输卵管等组织也有较高的表达。Blitek等[12]用促性腺激素诱导猪动情,检测猪早期妊娠在第10、11、12、15 d中HoxA10基因在子宫内膜和孕体中的表达,发现HoxA10的表达在第12天和第15天均明显上调,表明HoxA10基因在成年猪的子宫内膜是有表达的。Taylor等[7]也发现,在小鼠胚胎发育过程中,HoxA10基因在苗勒管和成熟子宫内膜中均有表达。本研究结果也显示,猪HoxA10基因在子宫和输卵管中也有较高的表达,与人和小鼠等类似。猪HoxA10基因在肾中表达较高,预示该基因参与调节泌尿生殖管的发育。猪HoxA10基因在子宫和输卵管的较高表达,表明该基因与猪的繁殖性状有显著的相关性,可能是影响猪生殖调控以及与繁殖性状相关的重要的候选基因。
[1] 周生建, 贾咏存, 杨戎, 等.HoxA10基因在小鼠胚胎着床过程中的作用[J]. 解剖学报, 2008, 4(39): 248-251.
[2] Apiou F, Flagiello D, Cillo C, et al. Fine mapping of humanHoxgene clusters [J]. Cytogenet Cell Genet, 1996, 73: 114-115.
[3] Satokata I, Benson G, Mass R. Sexually dimorphic sterility phenotypes in Hoxa-10 deficient mice [J]. Nature, 1995, 374(6521): 460-463.
[4] Benson G V, Lim H, Paria B C, et al. Mechanism s of reduced fertility in Hoxa-10 mutant mice: Uterine homeosis and loss of maternal Hoxa-10 expression[J]. Development, 1996, 122: 2687-2696.
[5] Modi D, Godbole G.HOXA10signals on the highway through pregnancy[J]. J Reprod Immunol, 2009, 83(1/2): 72-78.
[6] 李红, 陈士岭, 邢福祺, 等.HOXA10基因在子宫内膜组织中的表达及与不孕的关系[J]. 中华妇产科杂志, 2002, 37(1): 30-32.
[7] Taylor H S, Arici A, Olive D, et al.HOXA10is expressed in response to sex steroids at the time of implantation in the human endometrium [J]. J Clin Invest, 1998, 101(7): 1379-1384.
[8] 桂耀庭, 张立兵, 张键荣, 等. 同源盒基因A10在人体睾丸组织的表达及其临床意义[J]. 中国男科学杂志, 2006(10): 8-11.
[9] Zhao X, Du Z Q, Vukasinovic N, et al. Association ofHOXA10,ZFPM2, andMMP2genes with scrotal hernias evaluated via biological candidate gene analyses in pigs[J]. Am J Vet Res, 2009, 70(8): 1006-1012.
[10] 王哲, 黄高升. NCBI的数据库资源及其应用[J/OL]. 生命科学, 2002, 14(1): 59-62 [2002-02-15]. http: //www. ncbi. nlm. nih. gov/ blast/ blast. cgi.
[11] 陆阳杰, 王介东.HoxA10基因与生殖[J]. 生殖医学杂志, 2000, 6(9): 187-191.
[12] Blitek A, Kaczmarek M M, Kiewisz J, et al. Endometrial and conceptus expression ofHoxA10, transforming growth factor beta1, leukemia inhibitory factor, and prostaglandin H synthase-2 in early pregnant pigs with gonadotropin-induced estrus[J]. Domest Anim Endocrinol, 2010, 38(4): 222-234.
英文编辑:罗文翠

