诊断抗原的纯化在牛γ-干扰素ELISA法中的应用
邱美珍,周望平,肖兵南,杜丽飞,胡述光,刘毅,陈江
(1.湖南省畜牧兽医研究所,湖南 长沙 410131;2.湖南农业大学 动物医学院,湖南 长沙 410128)
目前,牛结核病的早期临床诊断仍以皮内变态 反应(TST)为主,但其检测的敏感性和特异性不高。随着免疫机理研究的深入,建立了牛 γ-干扰素ELISA诊断法(IFN-γ-ELISA),在国外已通过临床试验,证实了用该法诊断牛结核病的可靠性[1]。大量研究[2-8]表明,特异性诊断抗原影响IFN-γ-ELISA诊断的灵敏度。Amadori等[2]运用分子生物学手段,制备了特异性诊断抗原,使得IFN-γ-ELISA诊断的特异性有所提升。有研究[8]发现,特异性抗原CFP10/ESAT6诱导的IFN-γ释放反应的灵敏度略低于PPD诱导的IFN-γ释放反应。笔者通过亲和层析纯化牛结核菌纯蛋白衍生物(PPD)抗原,并制备兔抗草分支杆菌抗体,将其偶联到CNBr活化的凝胶上,探讨牛结核病的IFN-γ-ELISA诊断。现将结果报道如下。
1 材料与方法
1.1 材 料
(1) 样品。无菌采集长沙某养殖场60份奶牛血。
(2) 菌种与试剂。草分支杆菌购自中国科学院微生物研究所(菌种编号为 4.1180);牛 γ-干扰素(IFN-γ)ELISA 试剂盒购自ADL公司;溴化氰活化的凝胶(CNBr-Sepharose 4B)购自法马西亚公司;牛PPD和禽PPD均购自黑龙江省生物制品一厂。
1.2 方 法
1.2.1 诊断抗原、抗体的制备
1) 草分支杆菌菌体抗原的制备。将草分支杆菌培养后,离心,收集菌泥。将菌泥充分研磨,稀释,静置过夜,将上层液体配成OD525nm为0.4的混悬液。
2) 兔抗草分支杆菌抗体的制备。选取 2只2.0~2.5 kg的健康公兔,在其皮下多点多次注射草分支杆菌进行免疫。每次免疫后于耳静脉采血,收集血清,待试管凝集价达1∶800以上时将兔处死,采血并分离血清。血清用饱和硫酸铵提纯。用Bradford法[9]测定血清抗体蛋白含量。
3) 亲和抗原的制备[10-11]。取纯化的兔抗草分支杆菌抗体约18 mg与1 g胶(CNBr-Sepharose 4B)混匀,室温作用 2 h。离心后装柱,过量的配基用偶联缓冲液洗涤。收集全部未偶联的蛋白,Bradford法[9]测定蛋白含量。加入封闭液,室温下摇匀2 h,弃上清,分别用pH4.0和pH8.0的缓冲液洗胶,洗3个循环。再用磷酸缓冲液(PBS)洗2次。测定最后1次洗涤液的OD280nm,使OD280nm<0.02,保存于4℃备用。加入PPD,上样量3 mg。室温感作30 min。以PBS冲洗,收集洗脱液,洗脱至OD280nm<0.02。将所有蛋白洗脱管合并,所得即为PPD亲和层析抗原。加pH2.4的Gly-HCl缓冲液,收集解吸下来的成分,立即以NaHCO3中和。用Bradford法[9]测定蛋白含量。
1.2.2 牛结核病的检测方法
1) 皮内变态反应(TST)检测。按常规方法[10]对60头奶牛进行检测。参照文献[12],仅用牛型 PPD在牛颈部进行变态反应试验。剂量为2 000 IU。注射前测量皮肤厚度,注射后 72 h再次测定皮肤厚度,皮厚差大于3 mm时判为牛结核病阳性,反之为牛结核病阴性。
2) 抗酸染色检测。按照常规方法[10]对60份奶牛血清进行检测。
3) 牛结核ELISA(PPD-ELISA)法检测。首先,参照1.2.1(1)制备草分支杆菌吸收抗原,简称草吸抗原。其次,用草吸抗原处理血清:对 60份奶牛血检测,取血清100 µL,分别加入草吸抗原100 µL,PBS 800 µL,37 ℃感作1 h;再取上清液100 µL,加入700 µL PBST,混匀后取100 µL加入到检测孔。其他步骤按试剂盒操作程序进行。
4) IFN-γ-ELISA 法检测[13]。对60份奶牛血进行检测,无菌采血,肝素抗凝。采血后8 h内检测。检测步骤按照试剂盒操作程序进行。
5) 用亲和层析抗原IFN-γ-ELISA 法检测。对TST法检测有疑问的奶牛血重新进行检测,无菌采血,肝素抗凝。采血后8 h内检测。将每份检测血分为3份,分别加入禽PPD、未纯化牛PPD、亲和层析纯化的牛PPD,然后在CO2(5%)培养箱37 ℃孵育18 h,离心获得的血浆用于试验。以PBS为对照。其他步骤按照试剂盒操作程序进行。
1.2.3 结果判定
牛γ-干扰素阴性对照OD值<0.130,牛γ-干扰素阳性对照OD值>0.700方可用。阴性对照重复孔差值不能大于0.040[14]。
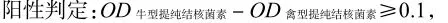

敏感性=真阳性数/(真阳性数+假阴性数)。
特异性=真阴性数/(真阴性数+假阳性数)。
符合率=(真阳性数+真阴性数)/被检总数。
2 结果与分析
2.1 兔抗草分支杆菌抗体的偶联率与亲和层析结果
加入待偶联的蛋白共18 mg,收集到未偶联的蛋白共约3 mg,偶联率为83.3%。亲和层析结果表明,第1次洗脱下来的成分主要是特异性的牛结核PPD抗原;第2次解吸附下来的成分主要是被兔抗草分支杆菌抗体吸附的抗原,是非特异性的成分,用Bradford法测得第1次洗脱和第2次解吸附的蛋白总量分别为2.6、0.4 mg。
2.2 4种方法对牛结核病的检测结果
4种方法对60头牛结核病的检测结果为:TST检测出阳性3例,阴性44例,疑似15例;抗酸染色法检出阳性6例,阴性54例;PPD-ELISA法检出阳性7例,阴性51例,疑似2例;IFN-γ-ELISA法检出阳性6例,阴性54例。可见,阳性检出率最高是PPD-ELISA法,为11.6%,最低的是TST法,为5%;疑似检出率最高的是TST法,为21.6%,其次是 PPD-ELISA法;抗酸染色和 IFN-γ-ELISA法没有疑似病例。
2.3 4种方法的检测敏感性、特异性和符合率
表1结果表明,与抗酸染色相比,IFN-γ-ELISA法的敏感性、特异性和符合率都比较高;TST法的敏感性和特异性为 100%,但符合率比较低,主要是因为疑似病例较多;PPD-ELISA的敏感性较低,也存在疑似病例。
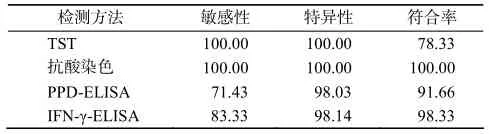
表1 4种检测方法的敏感性、特异性和符合率Table 1 Sensitivity, specificity, consistency of detection results by four tests %
2.4 3种抗原刺激的ⅠFN-ɣ-ELⅠSA检测结果
世界动物卫生组织(OIE)推荐使用牛 PPD、禽PPD比较IFN-γ释放反应,以排除环境分支杆菌对牛结核诊断的干扰.本试验中使用牛/禽结核菌素比较反应(包括皮内变态反应和 IFN-γ释放反应),发现1例抗酸染色阳性的牛(表2),亲和层析抗原纯化PPD(牛PPD’)的IFN-γ-ELISA检测OD值为0.166,判为阴性;未经亲和层析处理PPD的IFN-γ-ELISA检测OD值为0.385,判为阳性,这证明PPD中的非特异成分,经亲和层析后被吸附,从而排除了环境分支杆菌对试验的干扰。虽然本试验中可以用禽PPD刺激IFN-γ释放反应作为对照来排除环境分支杆菌对试验的影响,但是,如果发生牛和禽结核或其他环境分支杆菌的同时感染时,亲和层析抗原刺激的IFN-γ释放反应就具有很大的优势。
3 结论与讨论
本试验结果表明,与抗酸染色相比,IFN-γ-ELISA的特异性、符合率较高,达 90%以上,敏感性也达到了83.33%。该方法有望替代TST法[15-19]在中国推广使用。
结核分支杆菌属于胞内寄生菌,在机体发生免疫的过程中,初期是诱发细胞免疫,并释放出各种细胞因子。IFN-γ是结核菌感染时诱导的主要细胞因子[11-12],因而,检测结核菌特异抗原诱导的 IFN-γ释放反应具有较高的灵敏度与特异性[20]。牛结核 γ-干扰素诊断依据是T淋巴细胞释放的γ-干扰素水平,因此,能在结核病早期作出诊断。本试验结果表明,与IFN-γ-ELISA、PPD-ELISA和抗酸染色法相比,TST法有着本身固有的缺陷:操作和结果判断主观,非特异性反应现象常见,疑似病例较多。PPD-ELISA的敏感性较低,也存在疑似病例。抗酸染色法无法区分死菌和活菌,结果受试验条件和检验人员镜检技术水平的影响较大,灵敏度低(通常需要5 000~10 000个/mL抗酸杆菌才能得到阳性结果),特异性差(各种抗酸杆菌均可着色,需通过进一步试验才能确定是否为结核菌)[16-18],而IFN-γ-ELISA法的敏感性、特异性和符合率都比较高。
牛感染结核杆菌与环境分支杆菌可以分为以下3种情况:只感染牛结核菌,只感染环境分支杆菌,同时感染牛结核菌与环境分支杆菌。在前2种情况下,牛/禽结核菌素比较反应值与牛结核菌感染呈正相关,即比较反应结果为正值时表示牛结核菌感染,比较结果为负值时为环境分支杆菌感染;后一种情况,IFN-γ比较释放反应值与牛结核菌感染实际情况严重不符。混合感染时,牛/禽PPD的IFN-γ比较释放反应灵敏度低,准确度差,阴性牛被判为假阳性。相比之下,亲和层析抗原被吸附掉草分支杆菌及类属抗原成分,所诱导的IFN-γ释放反应很大程度降低了环境分支杆菌感染的影响,亲和抗原诱导的IFN-γ释放水平不比牛PPD低,所以,该反应具有很高的灵敏度与特异性。
[1] 李彤, 张以芳, 罗佳琴. 牛γ-干扰素在牛结核检测中的研究应用[J]. 中国畜牧兽医, 2006, 33(11): 53-56.
[2] Amadori M, Lyashchenko K P, Genaro M L, et al. Use of recombinant protein in antibody test for bovine tuberculosis [J]. Vet Microbiol, 2002, 85(4): 379-389.
[3] Liu S, Guo S, Wang C, et al. A novel fusion protein-based indirect enzyme-linked immunosorbent assay for the detection of bovine tuberculosis[J]. Tuberculosis, 2006, 87(3): 212-217.
[4] Aagaard C, Govaerts M, Meikle V, et al. Optimizing antigen cocktails for detection ofMycobacteriumbovis in herds with different prevalences of bovine tuberculosis: ESAT6-CFP10 mixture shows optimal sensitivity and specificity[J]. J Clin Microbiol, 2006, 44(12): 4326-4335.
[5] Cockle P J, Gordon S V, Hewinson R G, et al. Field evaluation of a novel differential diagnostic reagent for detection ofMycobacteriumbovis in cattle[J]. Clin Vaccine Immunol, 2006, 13(10): 1119-1124.
[6] 郭设平, 刘思国, 张秀华, 等. 牛分支杆菌抗原MPB70、MPB83和ESAT-6的融合表达及重组蛋白的初步应用[J]. 畜牧兽医学报, 2006, 37(7): 676-680.
[7] 吴波, 张书环, 邓铨涛, 等. 牛分支杆菌特异性四联融合蛋白在牛结核病诊断中的临床应用[J]. 中国人兽共患病学报, 2007, 23(11): 1123-1126.
[8] 陈颖钰, 邓铨涛, 郭爱珍, 等. 基于结核菌素与CFP10/ESAT6的牛IFN-γ检测法在牛结核病诊断中的比较研究[J]. 中国奶牛, 2008(6): 12-14.
[9] Bradford M M. A rapid and sensitive method for the qutmtitation of microgram of protein utilizing the principle of protein-dye binding[J]. Anal Biochem, 1976, 72: 248-254.
[10] 杨冲卫. 牛结核病诊断技术的研究进展[J]. 中国人兽共患病杂志, 2004, 20(12): 1090-1093.
[11] 高云航, 何昭阳, 单晓枫, 等. ELISA检测牛结核抗体时假阳性反应的消除[J]. 中国兽医学报, 2004, 9(5): 419-420.
[12] GB/T18645—2002 动物结核病诊断技术[S].
[13] 谢莉. γ-干扰素与结核病[J]. 结核病与胸部肿瘤, 2005(1): 7-13.
[14] 李川, 谭亚娣, 胡巧云, 等. 牛IFN-γ 原核表达、单克隆抗体制备及其ELISA检测方法的建立[J]. 生物工程学报, 2007, 23(1): 40-45.
[15] Andersen P, Munk M E, Pollock J M, et al. Specific immune-based diagnosis of tuberculosis[J]. Lancet, 2000, 356: 1099-1104.
[16] Barnes P F. Diagnosing latent tuberculosis infection: Turning glitter to gold[J]. Am J Respir Crit Care Med, 2004, 170: 5-6.
[17] Lalvani A. Spotting latent infection the path to better tuberculosis control[J]. Thorax, 2003, 58: 916-918.
[18] Dockrell H M, Weir R E. Whole blood cytokine assays-a new generation of diagnostic tests for tuberculosis[J]. Int J Tuberc Lung Dis, 1998(2): 441-442.
[19] Lein A D, Von Reyn C F.In vitrocellular and cytokine responses to mycobacterial response to mycobacterial vaccines[J]. Am J Med Sci, 1997, 31: 364-371.
[20] Connell T G, Rangaka M X, Curtis N, et al. Qusmti-FERON-TB Gold: State of the art for the diagnosis of tuberculosis infection[J]. Expert Rev Mol Diagn, 2006, 6(5): 663-677.
英文编辑:罗文翠

