拟南芥芥子油苷含量对外源茉莉酸的响应
刘庆霞,国 静,阎秀峰
(东北林业大学盐碱地生物资源环境研究中心,东北油田盐碱植被恢复与重建教育部重点实验室,哈尔滨 150040)
芥子油苷(Glucosinolates)是一类含氮、含硫的植物次生代谢产物,主要分布于十字花科植物,其降解产物异硫氰酸酯(Isothiocyanates)、硫氰酸酯(Thiocyanates)和腈类(Nitriles)等化合物在抵御病原微生物以及昆虫的取食等方面具有重要作用,用以介导植物与环境之间的相互作用[1-3]。研究表明,外源激素茉莉酸(Jasmonic acid)等不同程度地影响芥子油苷代谢并调节植物产生防御反应以适应逆境[4],但有关茉莉酸信号调控芥子油苷代谢的规律及机制尚不十分清楚。
外源激素茉莉酸是影响芥子油苷合成的诱导因子[5-6],可诱导一些植物体内吲哚族芥子油苷、脂肪族芥子油苷和芳香族芥子油苷中一些组分含量增加,从而引起植物体内总芥子油苷含量上升[7-8]。由于不同类型的芥子油苷代谢途径存在差异,加之茉莉酸信号途径中各位点对芥子油苷代谢途径的调控又各不相同,因此芥子油苷的合成对茉莉酸的响应非常复杂,其响应规律尚不十分清楚。茉莉酸甲酯(Jasmonic acid methyl)是茉莉酸的甲基衍生物,在植物体内可被茉莉酸甲酯酶(Jasmonic acid methyl esterase)催化生成茉莉酸[9],在植物细胞间以及植物之间的通讯联络中起重要作用[10],通常人们利用茉莉酸甲酯替代茉莉酸,以分析茉莉酸信号途径[7,11]。研究表明,茉莉酸能够诱导一些逆境应答响应基因的表达,如植物防卫素基因PDF1.2,其表达受茉莉酸诱导,通常用作茉莉酸信号途径的标记基因[12]。本研究通过分析外源茉莉酸甲酯喷施处理后,拟南芥叶片中PDF1.2基因的表达量及芥子油苷各组分的含量,探讨拟南芥芥子油苷各组分含量对外源茉莉酸的响应规律。
1 材料与方法
1.1 植物材料及生长条件
试验所用拟南芥(Arabidopsis thaliana)为Columbia生态型,种子由中国科学院植物研究所惠赠。种子消毒冲洗后,于4℃春化3~4 d,播种于盛有土壤与蛭石混合物(体积比1∶2) 的花盆中,在人工培养室中培养(温度19~26℃,人工光照9 L/15 D,光子通量密度约 150μmol·m-2·s-1,空气相对湿度50%~70%)。
1.2 茉莉酸甲酯处理
将茉莉酸甲酯(Sigma)溶于含乙醇(1.5%V/V)和 Triton-100(0.125%V/V)的水溶液[13],配制成200μmol·L-1的茉莉酸甲酯溶液。选取生长7周、长势一致的拟南芥幼苗(未抽薹)分为两组,对其第九片和第十片莲座叶进行处理并取材,处理组用200μmol·L-1茉莉酸甲酯溶液喷施拟南芥莲座叶,对照组用含乙醇(1.5%V/V)和 Triton-100(0.125%V/V)的水溶液进行处理,处理0 h取材1次,而后每12 h取材1次,共采样5次。
1.3 实时荧光定量PCR分析
利用TRIzol试剂(Invitrogen Inc.)提取总RNA,使用DNAase(TaKaRa Inc.)对 RNA中所含痕量基因组DNA进行消化。使用NanoDrop 1000型(Nano-Drop Technologies Inc.)分光光度计检测RNA纯度及浓度。按照Transcriptor First Strand cDNA synthesis kit(TaKaRa Inc.)试剂盒说明书合成cDNA第一链,去离子水稀释10倍作为实时荧光定量PCR的模板。
按照TAIR数据库(Eurogentec,Seraing,Belgium)提供的基因序列,使用Primer Express 2.x软件(Applies Biosystems)设计基因的特异引物。PDF1.2基因的特异引物序列分别为5'TCATGGCT AAGTTTGCTTCC 3'和5'AATACACACGATTTAGC ACC 3';以ACTIN基因作为内参,其引物序列分别为:5'TCCAGGAATCGTTCACAGAA 3'和5'GCT ACAAAACAATGGGACTAAAA 3'。引物由上海生工有限公司合成。
实时荧光定量PCR反应参照董晓丽等的方法[14]。反应体系为25μL,其中SYBR Premix Ex TaqTM(2×)12.5μL,正向、反向引物(10μmol·L-1)各 1μL,cDNA 模板 2μL,超纯水 8.5μL。实时荧光定量PCR在DNA Engine OpticonTM2(MJ Research Inc.)实时荧光定量PCR仪上进行。反应程序为:95℃预变性30 s;95℃20 s,55℃20 s,72℃30 s,80℃ 1 s,读板,45个循环。融解曲线分析:60~95℃,每0.5℃读板1次(温度恒定1 s后读板)。每个样品做3个重复。
1.4 芥子油苷的提取及测定
芥子油苷提取及测定按照Pang等方法[15]。
2 结果与分析
2.1 PDF1.2基因表达对外源茉莉酸甲酯的响应
PDF1.2基因编码一种植物防卫素,研究中通常将其作为茉莉酸信号途径的标记基因[13],本研究通过测定拟南芥莲座叶中PDF1.2基因的表达量来判断外源茉莉酸甲酯处理信号是否传导到植体内并诱发茉莉酸信号反应。以茉莉酸甲酯处理0 h的莲座叶中PDF1.2基因的表达作为一个单位,对不同处理时间的叶片中该基因的相对表达量进行荧光实时定量PCR分析。
由图1可以看出,茉莉酸甲酯处理后,莲座叶中PDF1.2基因的表达显著上调。在处理12 h,其表达量已上调至0 h的6.0倍;处理24 h时,PDF1.2基因表达量约为0 h的350倍,此时处理与对照中PDF1.2基因的表达量均达到最高值,茉莉酸甲酯处理的材料中PDF1.2基因表达量显著高于对照(约为对照的2.8倍);此后该基因表达水平急剧下降。这表明,外源茉莉酸甲酯能够诱导依赖于茉莉酸的信号反应,在12 h内启动诱导,至24 h达到最高值。
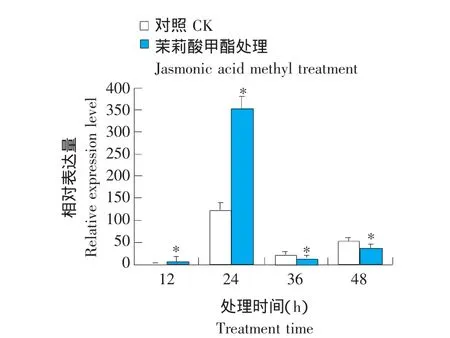
图1 拟南芥莲座叶中PDF1.2基因的表达Fig.1 Expression of PDF1.2 gene in Arabidopsis thaliana rosette leaves
2.2 拟南芥莲座叶芥子油苷总量对外源茉莉酸甲酯的响应
从图2可以看出,茉莉酸甲酯处理后,拟南芥莲座叶中总芥子油苷、脂肪族芥子油苷以及吲哚族芥子油苷含量表现出相似的变化趋势,均在24 h时达到最高值,与相应对照相比显著增加;此后含量开始缓慢下降,但在36 h时其含量仍然显著高于对照,至48 h,仅吲哚族芥子油苷的含量显著高于对照(约为对照的1.1倍,P<0.05),总芥子油苷和脂肪族芥子油苷的含量与对照相比没有显著差异,基本恢复至0 h的初始水平。表明茉莉酸甲酯能够诱导吲哚族芥子油苷和脂肪族芥子油苷的合成。
2.3 拟南芥莲座叶脂肪族芥子油苷含量对外源茉莉酸甲酯的响应
如图3所示,拟南芥莲座叶中共检测出9种脂肪族芥子油苷,茉莉酸甲酯处理后,除4-甲基亚磺酰丁基芥子油苷(4-methylsulphinylbutyl glucosinolate,4-MSOB)含量没有显著变化外,其余组分含量均有显著变化。4-羟基丁基芥子油苷(4-hydroxybutyl glucosinolate,4-OHB)、5-甲基亚磺酰戊基芥子油苷(5-methylsulphinylpentyl glucosinolate,5-MSOP)、6-甲基亚磺酰己基芥子油苷(6-methylsulphinylhexyl glucosinolate,6-MSOH)变化趋势基本相似,在处理24 h含量均达到最高值,分别为相应对照的1.2倍、1.4倍、1.8倍;此后含量均显著低于相应的对照,并低于0 h的水平。3-甲基亚磺酰丙基芥子油苷(3-methylsulphinylpropyl glucosinolate,3-MSOP)和7-甲硫庚基芥子油苷(7-methylthioheptyl glucosinolate,7-MTH)的含量在处理24 h达到最高值,且与对照相比差异显著;之后含量基本恢复到0 h的水平。8-甲硫辛基芥子油苷(8-methylthiooctyl glucosinolate,8-MTO)与 8-甲基亚磺酰辛基芥子油苷(8-methylsulphinyloctyl glucosinolate,8-MSOO)含量均在处理24 h达到最高值,且与对照相比差异显著,均约为相应对照的2.1倍,之后含量有所下降,但明显高于对照。3-羟基丙基芥子油苷(3-hydroxylpropyl glucosinolate,3-OHP)含量的最高值出现较晚,在处理36 h达到最高值,为0 h的2.0倍。
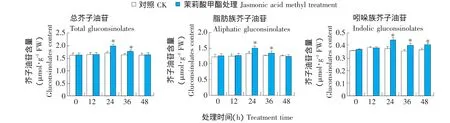
图2 拟南芥莲座叶中总芥子油苷、脂肪族芥子油苷及吲哚族芥子油苷总量Fig.2 Content of total gluconsinolates,aliphatic and indolic gluconsinolates in Arabidopsis thaliana rosette leaves
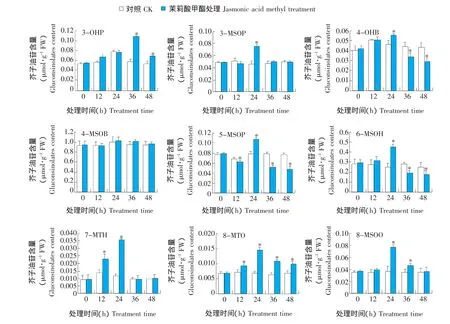
图3 拟南芥莲座叶中脂肪族芥子油苷各组分含量Fig.3 Content of aliphatic glucosinolates in Arabidopsis thaliana rosette leaves
2.4 拟南芥莲座叶吲哚族芥子油苷含量对外源茉莉酸甲酯的响应
由图4可知,拟南芥莲座叶中共检测出4种吲哚族芥子油苷。
茉莉酸甲酯处理后,吲哚基-3-甲基芥子油苷(Indol-3-yl-methyl glucosinolate,I3M)含量在12 h有所降低。1-甲氧吲哚基-3-甲基芥子油苷(1-methoxyindol-3-ylmethyl glucosinolate,1MT-I3M)经茉莉酸甲酯处理后36 h内含量持续增高,至36 h达到最高值,为0 h含量的2.1倍;在48 h含量降低,低于0 h的初始水平。4-羟基吲哚基-3-甲基芥子油苷(4-hrdroxyindol-3-ylmethyl glucosinolate,4OH-I3M)和4-甲氧吲哚基-3-甲基芥子油苷(4-methoxyindol-3-ylmethyl glucosinolate,4MT-I3M)的含量在处理24 h达到最高值,分别为0 h的2.0倍和1.5倍,与相应的对照相比均差异显著,在36 h含量降低,之后又出现上升的趋势,与0 h初始含量相比均有显著差异。
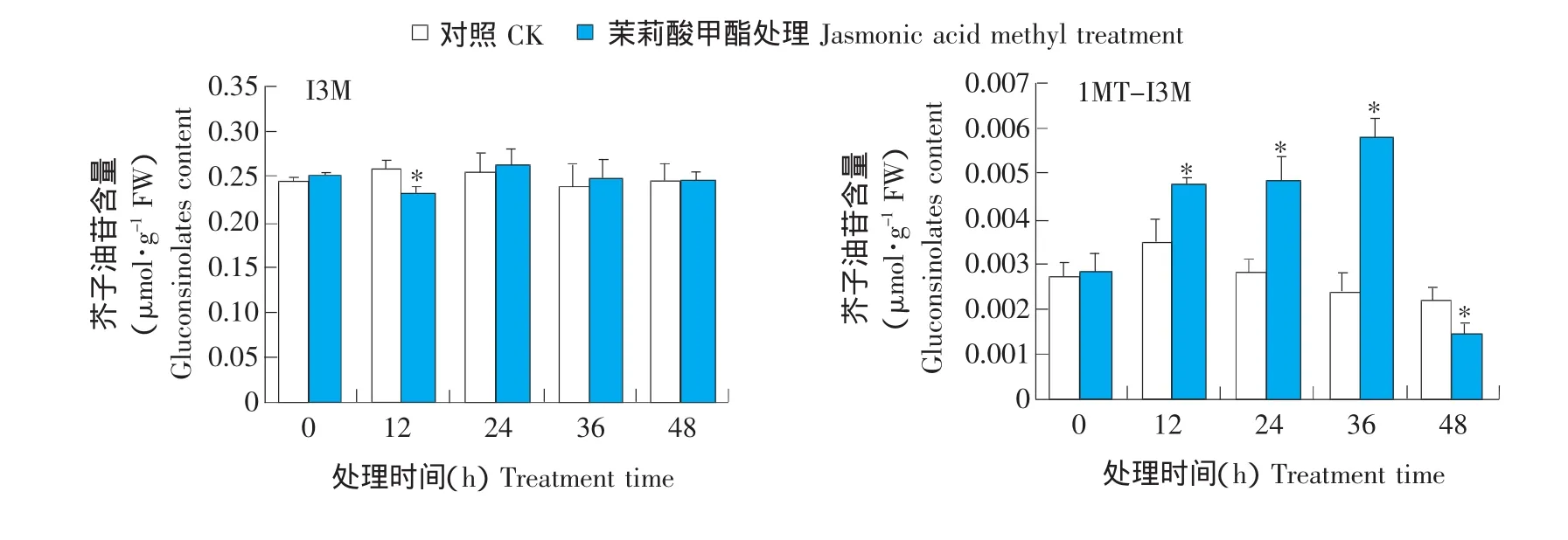

图4 拟南芥莲座叶中吲哚族芥子油苷各组分含量Fig.4 Content of indolic glucosinolates in Arabidopsis thaliana rosette leaves
3 讨论
茉莉酸信号途径标记基因PDF1.2经茉莉酸甲酯处理后表达量显著上调,表明在喷施茉莉酸甲酯后,诱导了茉莉酸信号反应,且在24 h诱导程度最为强烈。与此一致,脂肪族及吲哚族芥子油苷合成响应茉莉酸甲酯的变化趋势与PDF1.2基因表达的变化趋势一致,含量均上调,且同样在24 h达到最大值,表明吲哚族和脂肪族芥子油苷的合成均受外源茉莉酸甲酯诱导(见图2);脂肪族芥子油苷中除4-MSOB含量没有明显增加外,其余组分的含量与相应对照相比均显著增加;在吲哚族芥子油苷中除I3M外,其余组分的含量均明显增加,这与前人的研究结果不同。Doughty等发现,甘蓝型油菜经不同浓度的茉莉酸甲酯处理后增加的组分几乎全是吲哚族芥子油苷[7]。Mikkelsen等利用茉莉酸甲酯处理生长6周的拟南芥莲座叶,发现在检测到的脂肪族芥子油苷各组分中只有5-MSOP、8-MTO、8-MSOO的含量显著增加[11]。这表明不同物种以及同一物种不同发育时期,芥子油苷含量对茉莉酸的响应能力是有差异的。
本研究表明,脂肪族芥子油苷和吲哚族芥子油苷含量对外源茉莉酸的响应能力存在差异。脂肪族芥子油苷的含量在处理48 h已基本恢复至初始水平,而此时吲哚族芥子油苷的含量则高于初始水平,且与相应的对照相比差异显著。暗示这两类芥子油苷合成途径中的酶对茉莉酸信号的响应是存在差异的。芥子油苷生物合成过程可分为氨基酸侧链延长、核心结构合成和次级修饰3个阶段[16]。其中,次级修饰阶段因芥子油苷的种类而异。本研究结果表明,脂肪族(或吲哚族)芥子油苷的一些组分含量对茉莉酸具有特异的响应规律(见图3、4),暗示这些芥子油苷组分合成过程中参与次级修饰的酶对茉莉酸的响应能力不同,并且同一种酶在不同处理时间对茉莉酸的响应能力可能也有所不同。
4 结论
外源茉莉酸甲酯能够诱导拟南芥莲座叶中芥子油苷的合成。脂肪族芥子油苷除4-MSOB以外其余组分含量均受外源茉莉酸甲酯影响,吲哚族芥子油苷除I3M以外其余组分含量均受外源茉莉酸甲酯影响。这两类芥子油苷中多数组分在茉莉酸甲酯处理24 h含量最高。
[1]陈亚州,阎秀峰.芥子油苷在植物-生物环境关系中的作用[J].生态学报,2007,27(6):2584-2593.
[2]Yan X,Chen S.Regulation of plant glucosinolate metabolism[J].Planta,2007,226:1343-1352.
[3]乔世佳,李淑敏,孟令波.芸薹属植物对四种土传病原微生物熏蒸效果的研究[J].东北农业大学学报,2010,41(5):19-24.
[4]Brader G,Tas E,Palva E T.Jasmonate-dependent induction of indole glucosinolates in Arabidopsis by culture filtrates of the nonspecific pathogen Erwinia carotovora[J].Plant Physiol,2001,126:849-860.
[5]Bodnaryk R P.Potent effect of jasmonates on indole glucosinolates in oilseed rape and mustard[J].Phytochemistry,1994,35(2):301-305.
[6]Smolen G,Bender J.Arabidopsis cytochrome P450 cyp83B1 mutations activate the tryptophan biosynthetic pathway[J].Genetics,2002,160:323-332.
[7]Doughty K J,Kiddle G A,Pye B J,et al.Selective induction of glucosinolates in oilseed rape leaves by methyl jasmonate[J].Phytochemistry,1995,38(2):347-350.
[8]Cipollini D F,Sipe M L.Jasmonic acid treatment andmammalian herbivory differentially affect chemical defenses and growth of wild mustard(Brassica kaber)[J].Chemoecology,2001,11:137-143.
[9]Thines B,Katsir L,Melotto M,et al.JAZ repressor proteins are targets of the SCFCOI1complex during jasmonate signaling[J].Nature,2007,448:661-666.
[10]Arimura G,Ozawa R,Shimoda T,et al.Herbivory-induced volatiles elicit defence genes in lima bean leaves[J].Nature,2000,406(6795):512-515.
[11]Mikkelsen M D,Petersen B L,Glawischnig E,et al.Modulation of CYP79 genes and glucosinolate profile in Arabidopsis by defence signaling pathways[J].Plant Physiol,2003,131:298-308.
[12]Brown R L,Kazan K,McGrath K C,et al.A role for the GCC-box in jasmonate-mediated activation of the PDF1.2 gene of Arabidopsis[J].Plant Physiol,2003,132:1020-1032.
[13]Mewis I,Appel H M,Schultz J C,et al.major signaling pathways modulate Arabidopsis glucosinolate accumulation and response to both phloem-feeding and chewing insects[J].Plant Physiol,2005,138:1149-1162.
[14]董晓丽,王加启,卜登攀,等.免疫刺激后小鼠肝脏内参基因稳定性研究[J].东北农业大学学报,2009,40(5):80-85.
[15]Pang Q,Chen S,Li L,et al.Characterization of glucosinolate-myrosinase system in developing salt stress Thellungiella halophila[J].Physiol Plant,2009,136(1):1-9.
[16]钟海秀,陈亚州,阎秀峰.植物芥子油苷代谢及其转移[J].生物技术通报,2007(3):44-48.

