气孔导度和叶片内部导度制约C3 和C4 作物光合作用的比较分析
王建林,杨新民
(青岛农业大学农学院,山东 青岛 266109)
气孔是植物体与外界大气进行气体交换的门户,是陆地植物不可或缺的器官[1]。水汽、CO2、O2都要共用气孔这个通道,气孔的开闭会影响植物的蒸腾、光合、呼吸等生理过程。Hetherington和Woodward[2]总结了自20世纪以来有关植物气孔的研究结果后,在《Nature》撰文指出,气孔在感应和驱动环境变化的过程中扮演着越来越重要的角色,确定了其在植物生理学、甚至全球生态学等学科中的核心地位。植物的蒸腾和光合作用作为生态系统物质能量循环的两个最基本的生理生态学过程,共同受叶片气孔行为控制[3]。但对于不同光合途径的植物,由于其内部光合途径不同、固定CO2的酶不同,必然造成气孔导度对光合作用的制约效应不同[4]。气孔导度直接影响植物的光合作用、蒸腾作用和水分利用效率[5-6]。大豆与玉米是我国北方最主要的粮食和油料作物,其光合特征直接关系粮食和油料的产量,本研究对比分析了大豆、玉米叶片气孔导度和叶片内部导度的差异,旨在揭示C3和C4作物气孔导度和叶片内部导度对光合作用制约性的差异。
1 材料与方法
1.1 试验地概况
试验于2009年在青岛农业大学试验田进行。试验田为棕壤土,质地粘重,地力中等。试验材料大豆为鲁豆4、玉米为郑单958,均是该地区当前主栽品种。6月6日播种,行距60 cm,行长10 m,8行区,3次重复。田间施纯氮量225 kg·hm-2、P2O582.5 kg·hm-2、K2O 187.5 kg·hm-2。整个生育期常规栽培管理。
1.2 测定方法
在玉米吐丝期和大豆结荚期用LI-6400便携式光合测定仪(美国Li-cor公司生产)对玉米穗位叶和大豆功能叶的净光合速率、气孔导度、胞间CO2浓度以及相应的生态环境要素进行了测定。在光合速率和气孔导度对环境变量响应机制的测定过程中,光合测定仪的流速设定为500 μmol·s-1,叶室温度控制为30℃,光量子通量密度(PPFD)设定为2 000、1 800、1 600、1 400、1 200、1 000、800、600、400、200、100、50、0 μmol·m-2·s-1,参比室CO2浓度设定为 350 μmol·CO2·mol-1。测定时田间气温(31.2±1.7)℃,叶室温度(30.0±0.2)℃。
2 结果与分析
2.1 大豆和玉米气孔导度的差异
在植物叶片的气体交换过程中,水汽会从气孔下腔扩散到叶片表面,同时叶片表面的CO2也会通过气孔扩散到气孔下腔,完成气体交换。气孔对该过程的阻力称为气孔阻力(rs),气孔阻力的倒数称为气孔导度(gs),并有以下关系:

式中,Tr为蒸腾速率,Pn为光合速率,Wi、Ci、Ws、Cs分别为气孔下腔水汽、CO2浓度和叶片表面水汽、CO2浓度,rsw、rsc分别为气孔对水汽和CO2的阻力,gsw、gsc为气孔对水汽和CO2的导度。
由图1可知,随着光量子通量密度的增强,大豆和玉米的气孔导度均增大,且在0~2 000 μmol·m-2·s-1的光量子通量密度下,大豆的气孔导度始终大于玉米的气孔导度。

图1 气孔导度对光强的响应Fig.1 Response of leaf stomatal conductance to PPFD
2.2 大豆和玉米叶片内部导度的差异
相对于蒸腾作用的物理扩散过程而言,光合作用碳同化过程要复杂的多。光合作用碳同化并不发生在气孔下腔,而是发生在叶绿体内。因此,光合作用对CO2的固定过程还要经历叶肉阻力和在叶绿体内发生的羧化阻力。将叶肉阻力(rmc)和羧化阻力(rxc)统称为叶片内部阻力(ric)。内部阻力(ric)的倒数称为内部导度(gic)。根据Fick原则有以下关系:

式中,Γ为CO2补偿点(含暗呼吸),由于Γ*与Γ间在数值上不存在显著差异[7],故用Γ*代替Γ。C3植物的补偿点Γ*用Brooks和Farquar提出的经验性二次多项式估算[8]:

式中,TL为叶片温度。C4植物的补偿点约为C3植物的1/10[7],即:

利用方程(4)计算得到叶片内部导度(gic)。从图2可以看出,大豆和玉米叶片的内部导度都随着光量子通量密度的增强而逐渐增大,PPFD在0~800 μmol·m-2·s-1范围内,二者的差异不大,但PPFD 在 800 μmol·m-2·s-1以上时,玉米叶片的内部导度大于大豆叶片的内部导度。因为叶片的内部阻力主要是由叶肉阻力和羧化阻力构成,CO2在叶肉间隙扩散的阻力相差不大,而羧化阻力则取决于羧化酶对CO2的亲和力。在较高的光照强度下,C4植物的PEP羧化酶对CO2的亲和力远远大于C3植物的RuBP羧化酶,所以造成玉米叶片的内部导度大于大豆叶片的内部导度。

图2 叶片内部导度对光强的响应Fig.2 Response of leaf inter conductance to PPFD
2.3 gic /gsc 比值对光合作用的制约性
由于气孔导度和内部导度共同制约了光合速率,因此二者的比例关系对于解析光合作用的限制因素有重要意义。由图3可见,随着PPFD的增强,大豆和玉米的gic/gsc比值逐渐增大,且当光照强度大于 400 μmol·m-2·s-1时,玉米的gic/gsc比值远远大于大豆。当 PPFD 达到 800 μmol·m-2·s-1时,大豆的gic/gsc比值不再增大,而PPFD达到1 600 μmol·m-2·s-1时,玉米的gic/gsc比值也不再增大。进一步计算不同PPFD下,气孔阻力和叶片内部阻力对光合作用制约的比例(见图4),可见弱光下,气孔阻力对两种植物光合作用的制约率基本相同;但强光下,气孔阻力(CO2扩散到气孔下腔)的限制,更多的制约了玉米光合作用;而大豆气孔阻力对光合作用的限制远远小于其内部阻力的制约,即因其自身羧化能力差,而更多的制约了光合作用。
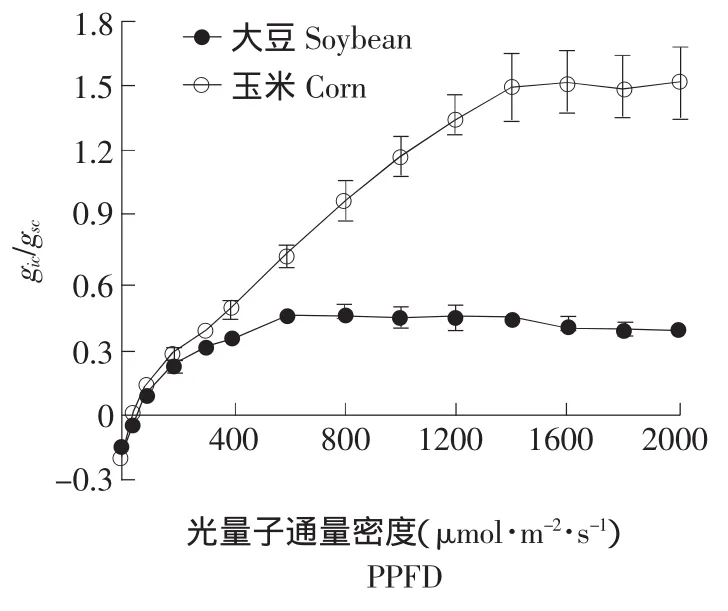
图3 gic /gsc 对光强的响应Fig.3 Response of gic /gsc to PPFD

图4 气孔对光合作用的制约率对光强的响应Fig.4 Response of rate of stomatal limit to PPFD
2.4 光合速率与胞间CO2 浓度的关系
图5表示了光合速率与胞间CO2浓度的关系,从图5中可以看出,随着光合速率的增强,玉米的胞间CO2浓度下降的更快,或者说,相同的胞间CO2浓度下,玉米具有较高的光合速率。这反映了两个辩证的问题:一方面说明玉米可以利用更低的CO2浓度进行光合作用(光合作用过程中的“脱羧”作用起到“CO2泵”的作用),另一方面也说明了玉米的气孔严重限制了大气CO2进入叶片,造成CO2饥饿。而由于大豆的气孔导度大,可以快速补充CO2,但其自身的羧化能力制约光合速率的进一步增大。由此可见,大豆只有维持更高的胞间CO2浓度下才能获得与玉米相当的光合速率,这也就需要气孔开得较大以保证较小的气孔阻力。

图5 光合速率与胞间CO2 浓度的关系Fig.5 Relationship between Pn and Ci
3 讨论
玉米为C4作物,其CO2补偿点比C3作物大豆低,这意味着CO2由细胞间隙到达叶绿体的阻力比大豆高,即其导度低。从本研究结果看,只是在PPFD<800 μmol·m-2·s-1时,玉米的内部导度低于大豆,而当 PPFD>800 μmol·m-2·s-1时,其内部导度高于大豆。这说明在较低的光强下,玉米需要克服其CO2补偿点低所带来的更大阻力;而在高光强下,大豆羧化能力低限制了CO2的同化,表现为在高光强下内部导度低于玉米。这也可以在一定程度上解释大豆耐弱光、玉米喜强光的客观事实。
从内部导度的定义可知,gic由三个因子决定:即从细胞间隙到羧化基液态CO2的物理扩散、羧化效率和暗呼吸速率。Yu等对内部导度和各种环境变量的相关分析表明[7],gic与PPFD、VPD、叶片温度和叶片水势均存在线性相关关系,与PPFD的相关性最强,PPFD是决定gic的最重要的因子。Farquha、Collatz 和 Leuning 等研究表明[9-12],羧化效率实际上可以用光合速率与光照强度的关系、光合速率与胞间CO2浓度的关系来描述,即叶片的光合速率为Rubisco活性和RuBP再生限制的同化速率的较小值。在本研究中gic与PPFD高度相关,表明光辐射限制的羧化效率是决定gic的重要因子,与Yu等的研究结果一致[7]。但本研究也表明,gic与PPFD的相关性不是简单的线性相关,而是米氏响应关系(见图2),这是由于羧化效率对PPFD呈米氏响应,这也进一步证明了PPFD对gic的决定作用。
4 结论
以大豆和玉米为研究对象,对气孔导度和内部导度进行了对比分析。结果表明,大豆的气孔导度大于玉米,而玉米的内部导度大于大豆,这说明玉米的光合作用主要受气孔限制,大豆的光合作用主要受羧化能力限制。玉米可以利用低浓度的CO2进行光合作用,但同时也因气孔导度低而限制了大气CO2进入叶片,因而高强光下造成CO2饥饿;大豆的气孔导度大,可以快速补充CO2,但其自身的羧化能力制约着光合速率的进一步增大。
[1]Woodward F I.Do plants really need stomata?[J].Journal of Experimental Botany,1998,49:471-480.
[2]Hetherington A M,Woodward F I.The role of stomata in sensing and driving environmental change[J].Nature,2003,424:901-908
[3]王建林,于贵瑞,房全孝,等.不同植物叶片水分利用效率对光和CO2的响应与模拟[J].生态学报,2008,28(2):525-533.
[4]潘瑞炽主编.植物生理学[M].北京:高等教育出版社,2004.
[5]李严坤,张忠学,仲爽,等.水肥处理对玉米叶片水分利用效率及其光合特性的影响[J].东北农业大学学报,2008,39(10):15-19.
[6]刘守伟,于慧颖,吴凤芝.不同蔬菜轮作栽培模式对黄瓜生理特性及产量的影响[J].东北农业大学学报,2009,40(8):28-31.
[7]Yu G R,Zhuang J,Yu Z L.An attempt to establish a synthetic model of photosynthesis-transpiration based on stomatal behavior for maize and soybean plants grown in field[J].Journal of Plant Physiology,2001,158:861-874
[8]Brooks A,Farquar G D.Effect of temperature on the CO2/O2specificity of ribulose-1,5-bisphosphate carboxylase/oxygenases and the rate of respiration in the light[J].Planta,1985,165:397-406.
[9]Farquhar G D,von Caemmerer S,Berry J.A biochemical model of photosynthesis CO2assimilation in leaves of C3species[J].Planta,1980,149:78-90.
[10]Collatz G J,Ball J T,Grivet C,et al.Physiological and environmental regulation of stomatal conductance,photosynthesis and transpiration:A model that includes a lam in a boundary layer[J].Agricultural and Forest Meteorology,1991,54:107-136.
[11]Leuning R.Modeling stomatal behavior and photosynthesis of Eucalyptus grandis[J].Australian Journal of Plant Physiology,1990,17:159-175.
[12]Leuning R.A critical appraisal of a combined stomatal-photosynthesis model for C3plants[J].Plant,Cell and Environment,1995,18:339-355.
