感觉神经损伤性盐敏感性高血压大鼠心、肾AT1R的表达
殷丽天,李 媛,李 莉,崔慧慧,黄 幸,杨建一
(山西医科大学基础医学院,太原 030001)
高盐摄入被认为是高血压发生最重要的因索之一[1]。20世纪70年代,Luft等[2]根据高血压患者对高盐摄入后的血压反应及潴钠的程度,首先提出了盐敏感性的概念。之后,对于盐敏感性高血压的研究逐步展开。盐敏感性高血压是指由于相对高盐摄入所引起的血压升高[3-6]。除流行病学外,对盐敏感性高血压的研究多采用动物模型进行。血压升高过程涉及到肾素-血管紧张素系统(RAS)和各种细胞因子的作用,血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)是RAS的主要活性肽,AngⅡ的大多数生理效应是通过细胞表面的血管紧张素Ⅱ性受体(angiotensinⅡ type 2 receptor,AT1R)进行的。AT1R主要存在于血管平滑肌表面、上皮细胞、心肌细胞、心脏成纤维细胞和肾小球膜细胞等,其激活导致血管收缩,升高血压等。国内外学者研究发现自发性高血压大鼠(SHR)肾素血管紧张素系统研究已有一定进展[7],但在感觉神经损伤性盐敏感性高血压大鼠模型尚未见报道。在盐敏感性高血压大鼠中,血管紧张素Ⅱ1型受体(AT1R)的表达如何?本研究建立感觉神经损伤性盐敏感性高血压大鼠模型,观察探讨大鼠心肌和肾脏组织中AT1R在基因和蛋白水平的表达水平,探讨其在盐敏感性高血压发病机制中的作用。
1 材料和方法
1.1 实验动物
雄性Wistar大鼠,由山西医科大学生理学系实验动物室提供[合格证号:医动字第070102,动物实验室许可证号:SYXK(晋)2009-0001号]。
1.2 主要仪器设备
YD-202C切片机,浙江金华市益迪医疗设备厂;Progene Techne PCR扩增仪;DYY-7C型电泳仪,北京六一仪器厂;JY-SPCT水平电泳槽,北京君意东方电泳设备有限公司;Neofuge15R台式高速冷冻离心机,上海力申科学仪器有限公司;Tanon 2500凝胶成像系统,天能(上海)科技有限公司;UV-2602型紫外分光光度计,尤尼柯(上海)仪器有限公司;BL-410生物信号显示与处理系统,成都泰盟电子有限公司;HX-Ⅱ小动物血压计。
1.3 药品与试剂
辣椒辣素(CAP),美国Sigma公司;苏木素,FMP公司;溴化乙锭(EB),美国Sigma公司分装;琼脂糖,Solarbio公司;高效切片石蜡,上海华申康复器材有限公司生产;免疫组化试剂盒,武汉博士德生物工程有限公司生产;RT-PCR试剂盒,宝生物工程有限公司(大连)生产。
1.4 实验方法
1.4.1 动物模型复制及分组:参考相关文献[8]建立模型与分组:雄性Wistar大鼠生后第1~2天,实验组皮下注射辣椒辣素50mg/kg(溶解在含5%乙醇、5%吐温80的生理盐水中);对照组皮下注射同体积的溶液(含5%乙醇、5%吐温80的生理盐水)。哺乳期(3周)后,雄性大鼠被随机分成以下4组:对照+正常盐饮食组(饲料中含1%NaCl,CON-NS);对照+高盐饮食组(饲料中含4%NaCl,CON-HS);辣椒辣素+正常盐饮食组(CAP-NS);辣椒辣素+高盐饮食组(CAP-HS)。每组8只动物分别接受以上不同的处理4周。
1.4.2 实验过程:分组时及分组后各周用尾套法测量大鼠清醒时尾收缩压,测三次取均值。动物8周龄时模型建立。心尖部取约100mg心肌组织,置于冻存管,液氮中保存,准备行RT-PCR检测。沿房室环剪去大血管、心房及右室游离壁,将余下的室间隔、左室游离壁作为左心室,左心室侧壁取一块状心肌组织,以4%甲醛液固定,准备行免疫组化检测;取右侧肾脏约100mg组织,置于冻存管,液氮中保存,用于RT-PCR检测;左侧肾脏组织,以4%甲醛固定,准备行免疫组化检测。
1.4.3 免疫组化检测大鼠心肌和肾脏AT1R蛋白表达:操作步骤按免疫组化试剂盒说明书进行。用Image-Pro Plus 5.1图像分析软件分析大鼠心肌和肾脏AT1R的表达水平,以吸光度(A)值表示其相对含量。
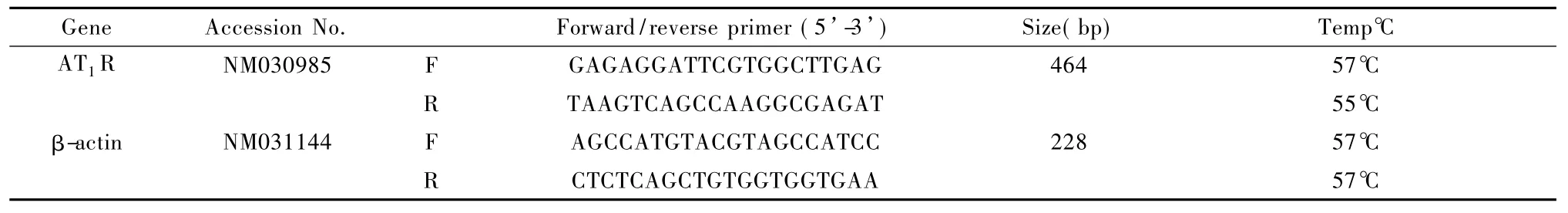
表1 引物序列Tab.1 Sequences of the primers
表2 各组大鼠血压的变化(±s,n=8)Tab.2 Changes of the blood pressure the rats of the four groups(±s,n=8)
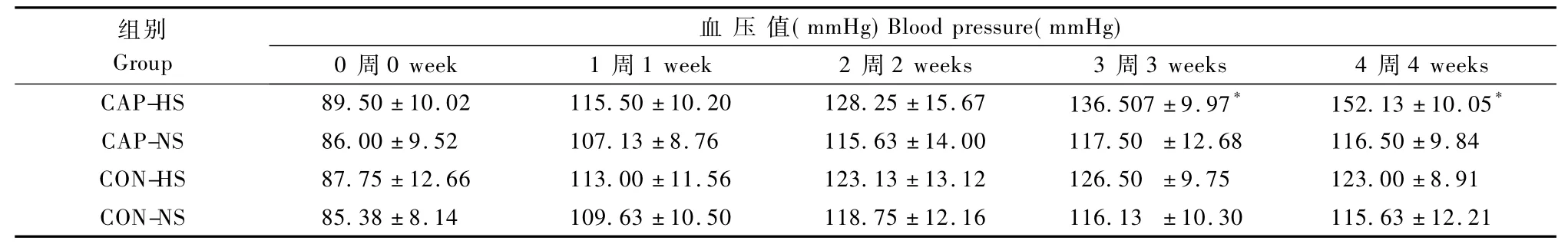
表2 各组大鼠血压的变化(±s,n=8)Tab.2 Changes of the blood pressure the rats of the four groups(±s,n=8)
注:*与CON-NS组比较,P<0.01。Note:* Compared with the CON-NS group,P<0.01.
组别Group血 压 值(mmHg)Blood pressure(mmHg)0周0 week 1周1 week 2周2 weeks 3周3 weeks 4周4 weeks CAP-HS 89.50±10.02 115.50±10.20 128.25±15.67 136.507±9.97* 152.13±10.05* CAP-NS 86.00±9.52 107.13±8.76 115.63±14.00 117.50 ±12.68 116.50±9.84 CON-HS 87.75±12.66 113.00±11.56 123.13±13.12 126.50 ±9.75 123.00±8.91 CON-NS 85.38±8.14 109.63±10.50 118.75±12.16 116.13 ±10.30 115.63±12.21
1.4.4 反转录-聚合酶链式反应(RT-PCR)检测大鼠心肌和肾脏AT1RmRNA表达:操作步骤按试剂盒说明书进行。从NCBI的nucleotide中查得目的基因,用Primer Premier 5.0设计ACE和ACE2上下游引物。AT1R、β-actin的序列参考Lan He等[9]文献设计,进行产物半定量分析,比值表示其相对含量。各对引物序列如表1。
1.5 统计学方法:
用SPSS 11.5统计软件进行统计分析。实验结果以均数±标准差(±s)表示,用单因素方差分析检验其显著性。
2 结果
2.1 收缩压变化
在实验过程中各组大鼠尾收缩压均有明显增加。从第2周开始,CAP-HS组尾收缩压开始高于正常组,到第3、4周,CAP-HS组的尾收缩压与CON-NS组比较差异有显著性(P>0.05)。CAPNS、CON-HS、CON-NS三个组的尾收缩压均在正常血压范围之内,差异不显著(表2)。
2.2 大鼠心肌和肾脏组织AT1R蛋白表达
CAP-HS组大鼠肾脏组织中AT1R蛋白呈弥散性高表达(图1);CAP-NS组有少量表达(图2);CON-HS组表达较多(图3);CON-NS组表达同CAP-NS组相似,少量表达(图4)。在心肌组织中,CAP-HS组组织中高表达AT1R蛋白(图5);CAPNS组有少量表达(图6);CON-HS组表达也比较多(图7);CON-NS组表达同CAP-NS组相似,有少量表达(图8),(图1~8见彩插1)。
2.3 免疫组织化学图像分析
采用Image-Pro-Plus图象分析软件对免疫组化染色切片进行计量分析。随机从每张切片左上、左下、右上、右下和中部采集5个区域计算每个视野阳性染色的累积光密度值(integrated optical density,IOD),对免疫组化进行定量分析,计算心肌、肾脏组织中AT1R的表达量。IOD是阳性面积与阳性平均光密度的乘积。面积越大,光密度越大,IOD的值越大。分析方法同Gomori染色图像分析。
CAP-HS组大鼠心肌、肾脏组织中AT1R蛋白表达阳性率远远高于CON-NS组,具有统计学意义,P<0.01;CON-HS组AT1R蛋白表达阳性率较CONNS有差异,且P<0.05(表3)。
表3 各组大鼠心肌、肾脏AT1R免疫组化IOD值比较(±s,n=8)Tab.3 Comparison of IOD of kidney and heart in the rats of the four groups(±s,n=8)

表3 各组大鼠心肌、肾脏AT1R免疫组化IOD值比较(±s,n=8)Tab.3 Comparison of IOD of kidney and heart in the rats of the four groups(±s,n=8)
注:**与CON-NS比较,P<0.01;*与CON-NS比较,P<0.05。Note:**Compared with the CON-NS group,P<0.01;*Compared with the CON-NS group,P<0.05.
组别Group 心肌Heart 肾脏Kidney CAP-HS 31979.5±7873.6** 30942.8±2252.1**CAP-NS 9747.8±5215.8 3802.1±643.8 CON-HS 15370.7±4621.6* 10571.1±1126.2* CON-NS 8116.9±4988.8 3682.9±780.6
2.4 肾脏、心肌组织AT1RmRNA表达
RT-PCR结果显示,肾脏、心肌组织AT1RmRNA表达中:β-actin在228bp位置上有清晰明亮的条带,亮度相似(图9、图10);肾脏和心肌组织中的AT1R表达在464bp位置上有清晰条带,但明亮程度有差别。其中第4泳道CAP-HS组AT1RmRNA条带最亮,第2泳道CON-HS组条带次亮,第3、1泳道CAPNS、CON-NS组亮度相似(图11、图12)。
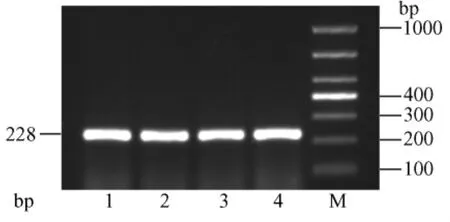
图9 各组大鼠肾脏AT1R与β-actin表达电泳图Fig.9 AT1R and β-actin expression in the kidney
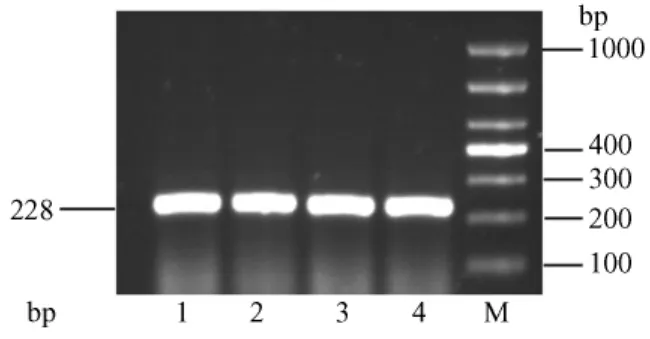
图10 各组大鼠心肌AT1R与β-actin表达电泳图Fig.10 AT1R and β-actin expression in the heart
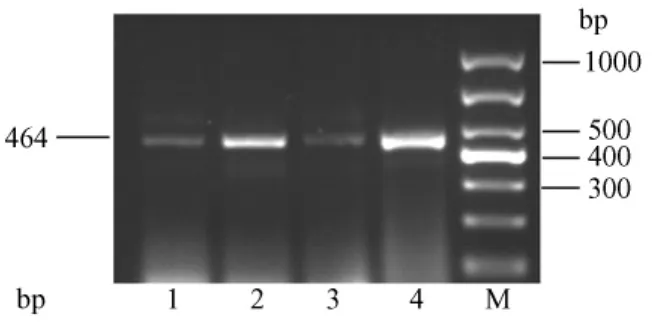
图11 各组大鼠肾脏AT1RmRNA表达电泳图Fig.11 AT1RmRNA expression in the kidney
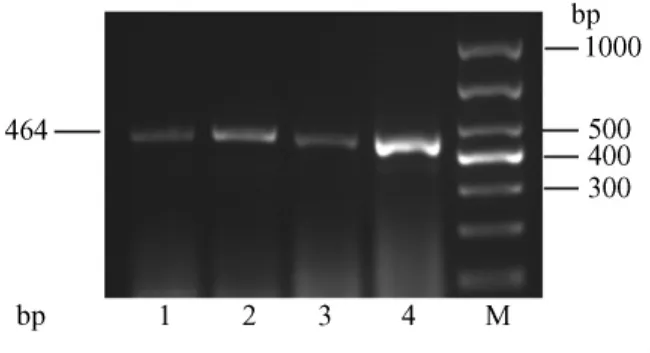
图12 各组大鼠心肌AT1R mRNA表达电泳图Fig.12 AT1R mRNA expression in the heart
2.5 大鼠肾脏、心肌组织AT1R mRNA表达分析
采用凝胶成像系统和紫外分光光度计分析AT1R mRNA表达。大鼠心肌组织CAP-HS组和COH-HS组AT1R mRNA的表达与其CON-NS组比较差异有显著性(P<0.01);肾脏组织中,CAP-HS组表达与CON-NS组比较差异有显著性(P<0.01);CON-HS组较CON-NS比较差异有统计学意义,且P<0.05(表4)。
表4 各组大鼠心肌、肾脏组织AT1R mRNA表达图像分析IOD值比较(±s,n=8)Tab.1 Image analysis of the IOD of AT1R mRNA in the heart and kidney of rats(±s,n=8)

表4 各组大鼠心肌、肾脏组织AT1R mRNA表达图像分析IOD值比较(±s,n=8)Tab.1 Image analysis of the IOD of AT1R mRNA in the heart and kidney of rats(±s,n=8)
注:**与CON-NS比较,P<0.01;*与CON-NS比较,P<0.05。Note:**Compared with the CON-NSgroup,P<0.01;*Compared with the CON-NS group,P<0.05
组别Group 心肌Heart 肾脏Kidney CAP-HS 0.779±0.04** 0.711±0.05**CAP-NS 0.311±0.01 0.318±0.05 CON-HS 0.609±0.01** 0.463±0.07* CON-NS 0.303±0.04 0.305±0.06
3 讨论
AT1R的激活可以产生血管收缩、升高血压、细胞增殖、氧化、醛固酮释放、水钠重吸收、血管内皮细胞生长以及纤维化等作用。AT1R主要存在于血管平滑肌表面(VSMCs)、上皮细胞、心肌细胞、心脏成纤维细胞和肾小球膜细胞,介导血管舒缩、水盐代谢以及血管平滑肌细胞增殖与肥大、功能调节等生理学效应,是RAS作用于效应器的关键环节。据研究,除细胞膜上有AT1R外,细胞核及染色体上也均发现有AngⅡ的特异性结合位点。细胞自身合成的AngⅡ能以胞内分泌的方式通过细胞核及染色体上的AngⅡ特异性结合位点介导其生理功能[10]。
高血压疾病中,AngⅡ是主要的缩血管物质和致血管重构的重要因素。AngⅡ调节血管结构及功能的主要过程是与其特异的受体(AT1R)结合,激活PLC-β(G蛋白偶联的磷脂酶C-β),产生两种重要的第二信使分子,三磷酸肌醇(IP3)和三酰甘油(DAG),导致细胞内钙释放和蛋白激酶C激活,并对包括转录因子在内的多种底物进行磷酸化调节,发挥生物学效应[11,12]。后来发现,AngⅡ与AT1R结合后,还可激活可溶性酪氨酸激酶PP60,然后磷酸化和刺激PLC-γ1,PLC-γ1进一步水解磷酯酰肌醇,最终生成IP3和DAG。IP3可激活肌浆网,致细胞内Ca2+释放,细胞内钙增加又可激活低电导的氯离子通道,使膜去极化激活钙通道,致钙内流增加[13,14]。一方面使游离Ca2+浓度增高,另一方面通过特异的离子流激活核基因及增加胞浆蛋白合成。AT1R介导多种活性,其表达是通过AngⅡ,生长因子、雌激素、类固醇、低密度脂蛋白的改变来完成的[15,16]。
本课题组曾经在感觉神经损伤性高血压大鼠中研究RAS系统中ACE和ACE2的表达[17],作为此系统中血管紧张素的相应受体(AT1R),本研究进一步用免疫组化法和RT-PCR法分别检测AT1R在蛋白和mRNA水平的表达,进一步阐明RAS系统在盐敏感性高血压中的作用。分析结果显示,CAPHS组大鼠的心肌、肾脏组织AT1R的表达与CONNS组比较差异均有显著性(P<0.01),提示血压明显升高,AT1R的表达显著增多。结果与黄建寨等[18]在SHR(自发性高血压)和RHR(肾性高血压)大鼠所作结果基本一致。CON-HS组心肌AT1R mRNA表达较肾脏更为显著,出现此结果的原因可能与左心室肥厚有关[19]。以上说明,感觉神经损伤性盐敏感性高血压大鼠心肌和肾脏组织中存在AT1R mRNA和蛋白的高表达,AT1R mRNA和蛋白的高表达与大鼠血压有一定的相关性。对于探讨盐敏感性高血压发病机制,以及临床使用AT1R拮抗剂防治高血压及其所带来的危害有一定的临床意义。至于AT1R蛋白和mRNA在其他组织中的表达情况,例如血管、脑等与高血压密切相关的器官中是否有同样结果或差异,将进一步研究。
[1]卢荔红,陈慧,骆杰伟,等.a-adducin基因与盐敏感性高血压、肾损害的相关性[J].中国分子心脏病学杂志2007,7(2):66-71
[2]Luft FC,Grim CE,Willis LR,et al.Natriuretic response to saline infusion in normotensive and hypertensive man.The role of renin suppression in exaggerated natriuresis[J].Circulation,1977,55(5):779-784.
[3]Beeks E,Kesseis AG,Kroon AA,et al.Genetic predisposition to salt-sensitivity:a systematic review[J].Hypertetions,2004,22(7):1243-1249.
[4]Hurwitz S,Fisher ND,Ferri C,et al.Controlled analysis of blood pressure sensitivity to sodium intake:interactions with hypertention tpye[J].Hypertens,2003,21(5):951-959.
[5]Weinberger MH.Sodium and blood pressure 2003[J].Curr Opin Cardiol,2004,19(4):353-356.
[6]王曼,牟建军,陈恩让,等.血压盐敏感性及相关因素家庭聚集性分析[J].中国公共卫生,2007,23(1):38-39.
[7]王东,蒋湘莲,聂亚雄.高血压大鼠模型的研究进展[J].中国动脉硬化杂志,2006,14(3):271-273.
[8]Wang DH,Li JP,Qiu JX.Salt-sensitive hypertension induced by sensory denervation:introduction of a new model[J].Hypertension,1998,32:649-653.
[9]He L,Qi Y,Rong X,et al.The Ayurvedic medicine Salacia oblonga attenuates diabetic renal fibrosis in rats:suppression of angiotensinⅡ/AT1 signaling[J].Evid Based Complement Alternat Med,2009,Aug 25(Epub ahead of print)
[10]郑红霞,罗兵.AT1R基因与人类疾病的相关性研究[J].中国实用医药,2007,2(5):91-92
[11]Regitz-Zagrosek V,Neuss M,Holzmeister J,et al.Molecular biology of angiotensin receptor and their role in human cardiovascular disease[J].Mol Med,1996,74(5):233-251.
[12]Leclerc PC,ProulxCD,Arguin G,etal.Ascorbicacid decreases the binding affinity of the AT1 receptor for angiotensinⅡ[J].Am J Hypert,2008,21(1):67-71.
[13]Griendling KK,Ushio-Fukai M,Lassegue B,et al.Angiotensin signaling in vascular smooth muscle[J].Hypertension,1997,29(1 pt 2):366-373.
[14]Schieffer B,Paxton WG,Marrero MB,et al.Importance of tyrosine phosphorylation in angiotensin Ⅱ type 1 receptor signaling[J].Hypertention,1996,27(3 pt 2):476-480.
[15]Mueller CF,Wassmann K,BergerA,etal.Differential phosphorylation of calreticulin affects AT1 receptormRNA stability in VSMC[J].Biochem Biophys Res Commun,2008,370(4):669-674.
[16]Mueller CF,Berger A,Zimmer S,et al.The heterogenous nuclear riboprotein S1-1 regulates AT1 receptor gene expression via transcriptional and posttranscriptional mechanisms[J].Arch Biochem Biophys,2009,488(1):76-82.
[17]崔慧慧,李莉,杨建一,等.感觉神经损伤性盐敏感性大鼠心肾ACE和ACE2的表达[J].中国比较医学杂志,2010,20(8):38-43.
[18]黄建寨,魏立,王晓军,等.高血压大鼠心肌肾素-血管紧张素系统的日变化[J].中国临床药理学与治疗学杂志,2006,11(8):863-867.
[19]李媛,李莉,崔慧慧,等.感觉神经损伤性盐敏感性大鼠左心室肥厚与血压的关系[J].中国比较医学杂志,2009,19(11):38-41.

