动态分析沙鼠非酒精性脂肪肝病形成及生化影响
李 巍,石巧娟,郭红刚,楼 琦,卢领群,萨晓婴
(浙江省医学科学院,浙江省实验动物中心,杭州 310013)
非酒精性脂肪肝病(nonalcoholic fatty liver disease,NAFLD)是一种无过量饮酒史,以肝实质细胞脂肪蓄积和脂肪变性为特征的临床病理综合症,包括单纯性脂肪肝以及由其演变的脂肪性肝炎、肝纤维化和肝硬化。近年来,随着人类生活水平的提高和饮食结构的变化,NAFLD的发病率呈逐年上升趋势,且发病呈低龄化。然而,由于NAFLD病因复杂,确切致病机理至今仍尚未形成定论,对NAFLD的预防、诊断、治疗策略也很有限。有关脂肪肝的病因学、预防和治疗的研究具有极其重要的意义,并已经成为研究热点。越来越多的证据表明,部分NAFLD并不是一种良性的、静止的病变,它可在较短期内发展为不可逆的肝损害,其肝纤维化的发生率高达25%,其中约1.5~8.0%的患者可进一步发展为肝硬化[1,2]。研究非酒精脂肪肝发展过程是澄清脂肪肝发病机理,开发药物和发展针对性预防和治疗方案的关键所在。
动物模型是研究人类疾病的重要手段,现有的单纯高质饮食诱导的NAFLD动物模型与人类疾病的病因、病机及病程发展都存在一定的差别,对模型动物在不同的造模时间所处的组织病理及相关生理生化变化鲜有报道。脂肪肝被认为是代谢综合征在肝脏的表现形式,而长爪沙鼠是研究代谢综合征比较理想的实验动物,目前已建立了长爪沙鼠高胆固醇血症、Ⅱ型糖尿病模型及肥胖等代谢综合征模型[3-6]。长爪沙鼠的脂代谢有许多特点与人类脂代谢相似[7,8],同时由于其个体小,易于实验的管理和操作,是一个良好的研究脂代谢方面的动物。本研究以单纯高脂饮食建立沙鼠NAFLD模型,通过动态分析肝脏病理变化,检测同时期肝组织游离脂肪酸含量、脂质代谢、肝功能、抗氧化等指标,探讨沙鼠NAFLD形成及发展的机理,为研究NAFLD的发病发展机制和治疗靶点选择提供理论依据。
1 材料和方法
1.1 材料
1.1.1 主要试剂:蛋黄粉为浙江省长兴县艾格生物制品有限公司产品。胆固醇、三号胆盐购于华东医药股份有限公司。食用猪油购于超市。天冬氨酸氨基转移酶(GOT)、丙氨酸氨基转氨酶(GPT)、胆固醇(CHO)、甘油三酯(TG)、高密度脂蛋白(HDL-c)和低密度脂蛋白(LDL-c)诊断试剂盒均购自上海丰汇医学科技有限公司。总蛋白定量测试盒、超氧化物歧化酶(SOD)测试盒、谷胱甘肽-过氧化物酶(GSH-PX)测试盒、过氧化氢酶(CAT)测试盒和游离脂肪酸(FFA)测试盒均购自南京建成生物工程研究所,并由南京建成生物工程研究所完成盲样检测。
1.1.2 实验仪器:意大利Autolab全自动生化分析仪PM4000,日本Olympus生物显微镜SZX7、美国Media Cybernetics公司多功能真彩色细胞图象分析管理系统,德国莱卡切片机,低温高速台式离心机TGLY6G。
1.1.3 实验动物:(50±10)g雄性长爪沙鼠120只,由浙江省医学科学院实验动物中心提供(生产许可证号:SCXK(浙)2008-0034;使用许可证号:SYXK(浙)2008-0114)。
1.1.4 饲料配方:普通饲料及高脂饲料由浙江省医学科学院实验动物中心加工生产。高脂饲料配方为:普通饲料80.5%、蛋黄粉10%、猪油7%、胆固醇2%、三号胆盐0.5%[9-12]。
1.2 方法
1.2.1 模型建立:实验动物适应性饲养1周后,按体重随机分为对照组与模型组,每组60只。对照组给予普通饲料作为阴性对照,模型组给予高脂饲料建立NAFLD模型。于对比饲养第1、2、4、6、8、16周末,随机抽选模型组与对照组各10只沙鼠,进行标本采集及相应的指标测定。
1.2.2 标本采集及指标测定:动物称重后用1%戊巴比妥钠麻醉,腹主动脉采血方式致死。分离血清,测定CHO、TG、HDL-c、LDL-c、GOT及GPT的含量。取肝脏称重,以脏器重量/体重×100%计算脏器指数。将取自肝最大叶中部组织用4%甲醛固定并制备石蜡切片,进行HE染色和Mallory三色染色后,用光学显微镜观察病理变化。另切0.5g肝右叶,匀浆后,测定SOD、GSH-px、CAT、FFA的含量。
1.2.3 统计学方法:计量资料以均值±标准差表示,采用SPSS11.5统计分析软件分析。各组间比较采用两样本均数的T检验。
2 结果
2.1 肝脏病理学分析
2.1.1 外观特征:对照组沙鼠肝脏均柔润,暗红色,有光泽(图1 A)。模型组(图1 B~G)随饲喂时间延长,肝脏色泽逐渐由暗红变成赭色(2周)、土褐色(6周)和奶黄色(16周);肝脏边缘由尖锐逐渐变为圆钝,包膜越来越紧张,肿胀程度逐步加剧。这表明,模型组沙鼠脂肪肝程度随时间加剧。
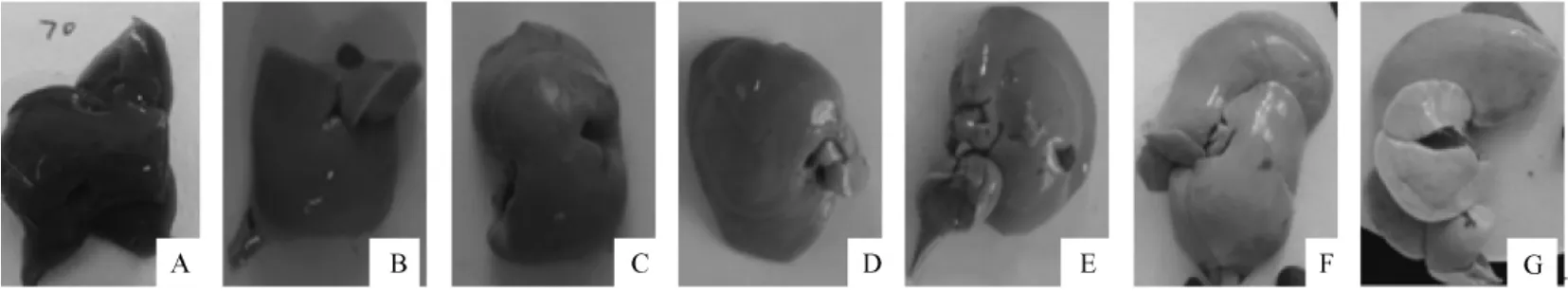
图1 随高脂饲喂时间的延长沙鼠的肝脏外观变化(图中由A到G依次为对照组,1,2,4,6,8,16周)Fig.1 Gross appearance of the livers at different time points(A to G:control,1,2,4,6,8,16 weeks)
2.1.2 光镜观察:HE染色和Mallory三色染色显示,对照组肝组织结构正常,肝窦清晰可见,肝索排列整齐,小叶结构及汇管区均未见异常,细胞完整(图2)。模型组1、2、4、6、8、16周所有动物肝组织均出现不同程度的肝细胞脂肪变性,而且,NAFLD进展程度与高脂饮食时间正相关。具体来讲,1周时肝组织约10%~30%的肝细胞发生脂肪变性(图3),肝索结构尚存;2周约30%~40%肝细胞脂肪变性,肝索结构排列紊乱(图4),形成单纯性脂肪肝模型;4周时约40%~60%肝细胞脂肪变性,模型动物单纯性脂肪肝进一步加剧(图5);6周时60%~80%肝细胞脂肪变性,肝细胞排列混乱,部分动物门管区有炎症(图6),形成脂肪性肝炎模型;8周肝细胞体积增大,胞质疏松淡染,肝细胞内充满细小泡沫样脂滴空泡,腺泡Ⅲ带局灶性窦周/细胞周纤维化(图7);16周时,75%~90%肝细胞脂肪变性,腺泡Ⅲ带肝细胞内充满大小不一、形态各异的脂滴空泡,(图8),局灶性或广泛的中度桥接纤维化(图9),形成脂肪性肝纤维化模型(图2~9见彩插2)。
2.2 肝功能及肝指数指标分析
由图10可知,1周末,模型组沙鼠肝指数已高于对照组(P<0.05),在1~16周模型组沙鼠肝指数表现出进行性增长趋势,16周时模型组肝指数达到对照组的2倍以上。由表1可知8周末,GOT、GPT出现了升高但无显著性;16周末,GOT、GPT出现了显著性升高(P<0.01)。数据说明,8周末开始模型组动物出现肝细胞破损。
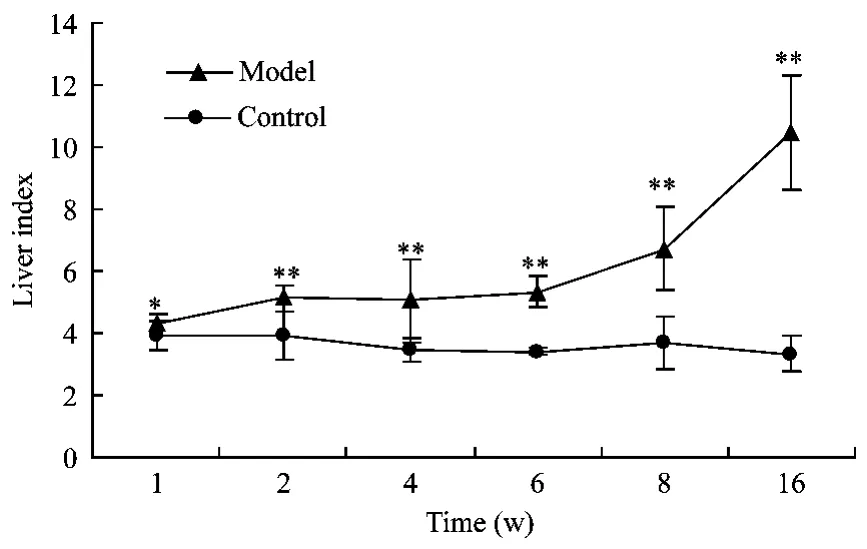
图10 沙鼠肝指数的变化(n=10)Fig.10 Changes of liver index of the gerbils(n=10)
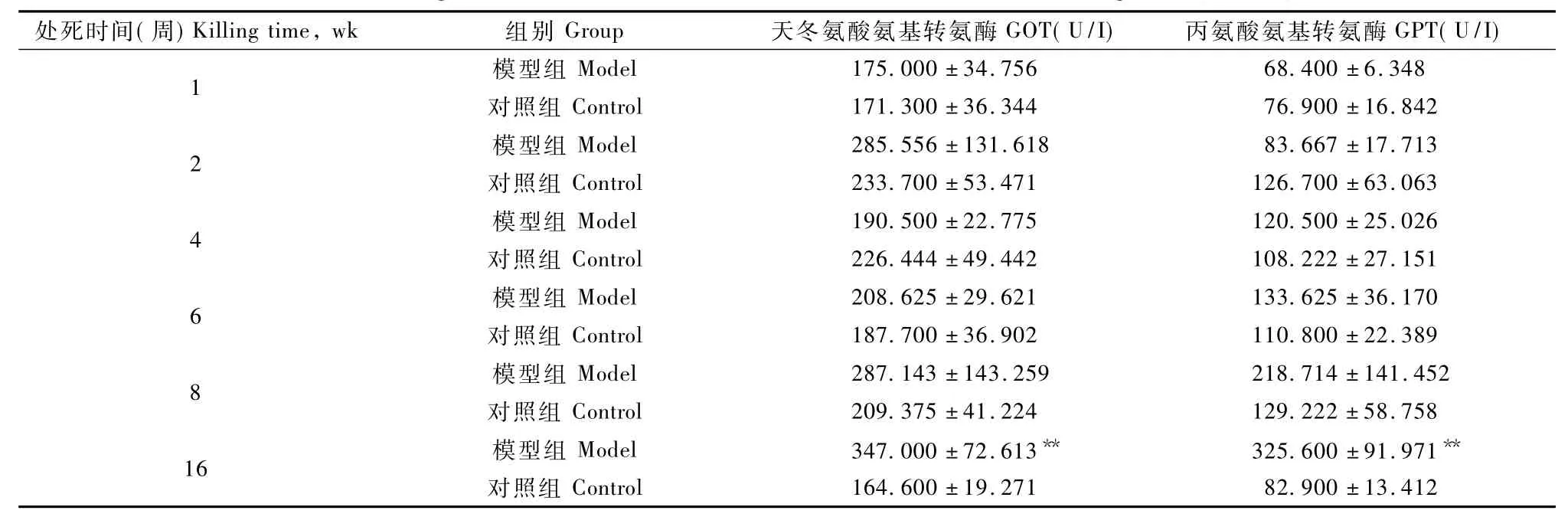
表1 沙鼠血清GOP及GTP肝指数的变化Tab.1 Changes of serum GOT and GPT levels and liver indexes of the gerbils(n=10)

表2 沙鼠血清CHO、TG、LDL-C和HDL-C的变化Tab.2 Changes of serum CHO,TG,LDL-C,HDL-C levels of the gerbils(n=10)
2.3 血脂分析(CHO、TG、LDL-C、HDL-C)
由表2可知,与同期对照组相比,模型组沙鼠1周末血清CHO、TG、LDL-C、HDL-C均已有显著性升高(P<0.05,P<0.01),6周时血脂水平有所回落;除TG外,其余三项在8周时均有所回升,持续升高到16周末。此数据表明沙鼠在不同阶段出现了不同程度的血脂紊乱。模型组沙鼠HDL-C虽有显著性升高,但各阶段HDL-C/CHO比值均低于对照组,表明沙鼠血浆中的胆固醇转运与人类相同,即更多的依赖于低密度脂蛋白。
2.4 肝游离脂肪酸含量分析
由表3可知,与同期对照组相比,模型组1周后肝组织FFA含量即出现了显著升高(P<0.01),6周时有所回落,8周时回升持续升高到16周末。表明了沙鼠在高脂饮食1周后肝内即有过量的FFA堆积。
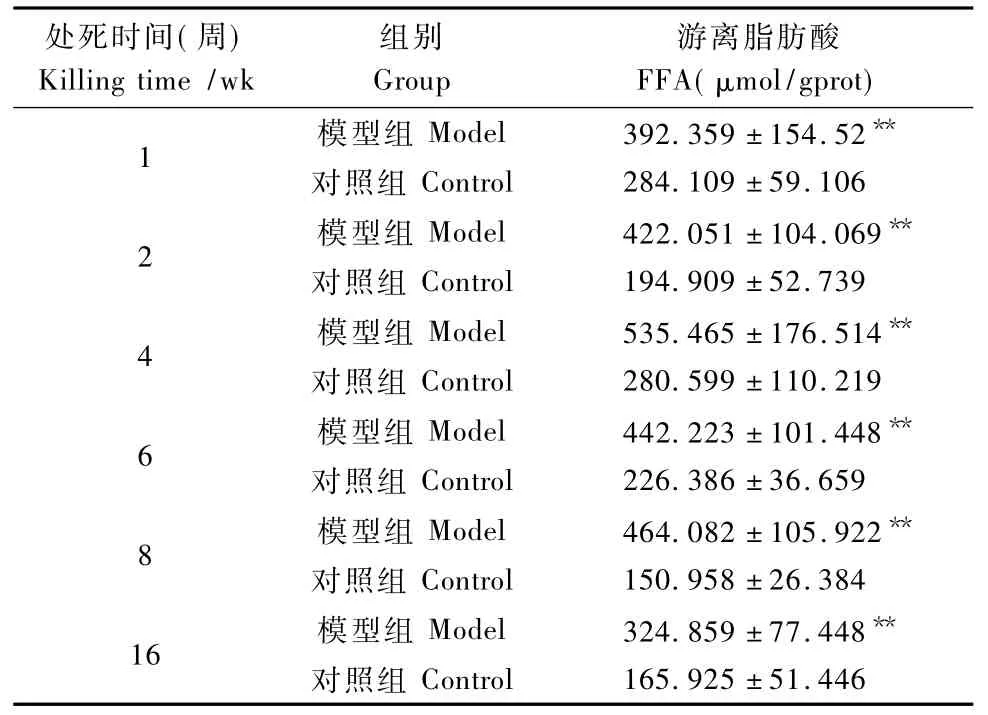
表3 沙鼠肝组织FFA含量的变化Tab.3 Changes of FFA content in liver tissue of the gerbils(n=10)
2.5 抗氧化相关酶类活性分析
由表4可知,1-4周末模型组CAT活性有显著性降低(P<0.01);8-16周末GSH-px活性有显著性降低(P<0.01);4、16周末SOD活性有降低(P<0.01),但未出现持续性的变化。16周末,抗氧化酶活性(SOD、GHS-PX、CAT)活性都显著性降低(P<0.01),GSH-px、CAT活性为对照组酶活性的1/2。不同抗氧化酶在不同时期表现出的显著性降低可能与沙鼠NAFLD模型病情的发展相关。
3 讨论
人类疾病动物模型是医学研究中建立的具有人类疾病表现的动物模型。人类疾病的发生发展是十分复杂的,应用人类疾病动物模型,可克服复杂因素,并增加方法学上的可比性,有利于更全面地认识疾病的本质。人类疾病动物模型的设计应遵循相似性、重复性、可靠性、适用性和可控性、易行性和经济性等原则,已有的NAFLD动物模型尚无法满足上述的设计原则。目前,NAFLD模型可以分为先天性/诱导遗传突变遗传性脂肪肝和通过理化因素处理而产生的获得性脂肪肝两大类。相比而言,高脂饮食法可克服其他方法存在的或费用昂贵,或材料耗费多、稳定性差、成功率欠高、对动物损伤过重或死亡率过高等弊端,最重要的是高脂饮食法更符合人类膳食习惯与自然发病规律。高脂饮食法NAFLD动物模型最常用的实验动物为大鼠,但该模型造模时间较长,TG血症难以出现或不稳定。临床上NAFLD随病情的进展可表现为单纯性脂肪肝病、非酒精性脂肪肝炎、脂肪性肝纤维化和脂肪性肝硬化4个阶段,而大鼠NAFLD模型停滞在脂肪性肝炎模型阶段,进一步发展为肝纤维化模型则需要辅以酒精[13,14],与人类NAFLD病程不符。目前尚缺乏满足人类疾病动物模型设计原则的NAFLD动物模型。本研究以长爪沙鼠为实验动物复制人类NAFLD模型。该模型除满足重复性、可靠性、适用性和可控性、易行性和经济性等人类疾病动物模型的设计原则外,最大的优点在于该模型发病条件及病程进展表现出与人类NAFLD的相似性,在以符合人类膳食习惯与自然发病规律相似的单纯性高质饮食条件的诱导下,2周后形成稳定的脂肪肝模型,随着饲喂时间的延长,脂质蓄积不断加剧,中期出现炎症灶,中后期发展为脂肪性肝纤维化(部分动物肝脏出现硬化),弥补了其他实验动物无法以单纯的高脂饮食法复制肝纤维化模型的缺陷。
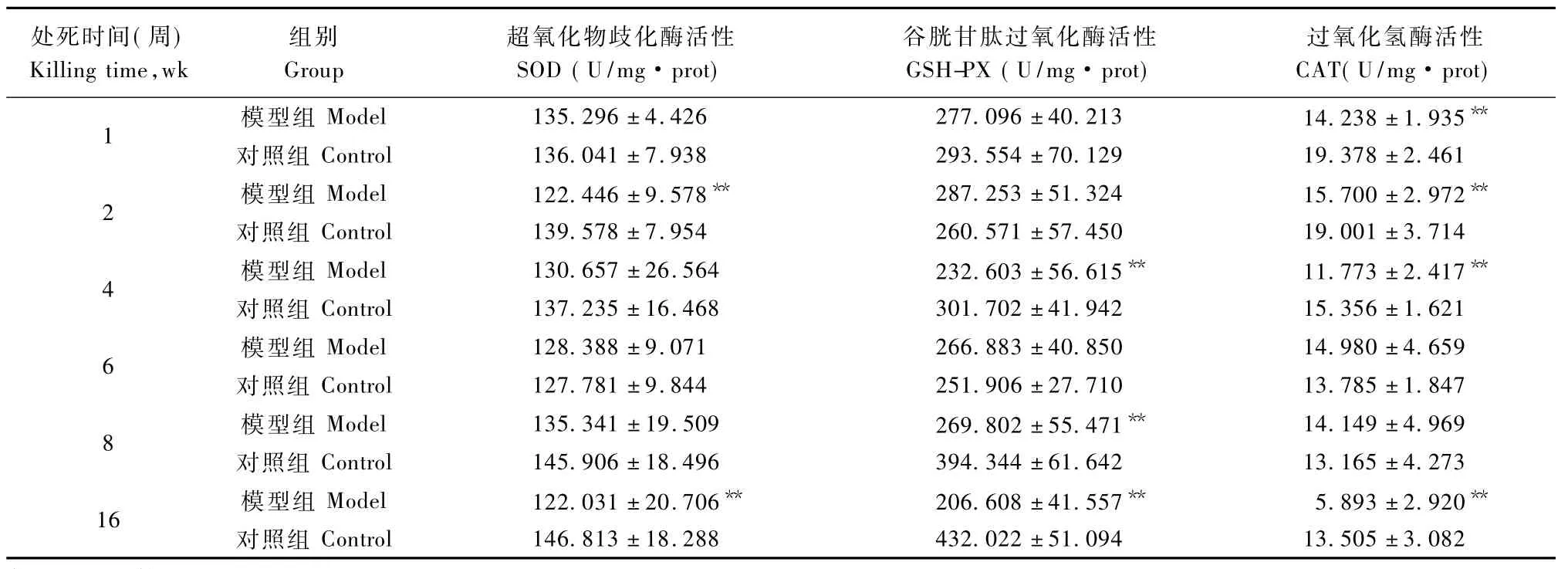
表4 沙鼠肝组织SOD,GSH-PX,CAT活性的变化Tab.4 Changes of SOD,GSH-PX and CAT enzyme activity in liver tissue of the gerbils(n=10)
综合沙鼠NAFLD模型在不同的造模时间所处的肝脏病理变化及肝组织游离脂肪酸含量、脂质代谢、肝功能、抗氧化等指标的结果分析,我们发现脂质代谢紊乱与氧化应激在沙鼠NAFLD模型病程进展中的发挥了不同的作用。流行病学显示,高脂血症为脂肪肝的重要危险因素,关系最为密切的为高TG血症。而过量的游离脂肪酸(外源性或内源性),特别是不饱和FFA,在肝内积聚是NASH的发病激发因素[15]。饲喂高脂饲料1周后,沙鼠出现了持续的血脂升高,肝组织FFA含量显著性增加,推测这些变化都与肝内脂质蓄积的发生发展紧密相关。另一方面,肝内FFA水平的升高为也为活性氧的大量产生提供了来源。现代研究表明,活性氧增多和活性氧清除剂减少是NASH的重要发病机制[16]。机体活性氧清除剂主要包括超氧化物歧化酶(SOD)等酶类和谷胱甘肽(GSH)等非酶类活性氧清除剂。活性氧增多和活性氧清除剂减少引起氧化应激,而氧化应激是引起单纯的脂肪变性向脂肪性肝炎和肝硬化进展的主要原因[17]。推测由于模型组沙鼠肝内FFA水平持续升高导致大量活性氧的生成,CAT、SOD、GSH-PX酶活性在不同阶段内的显著性降低,致使机体发生氧化应激,从而使得模型组沙鼠6周时肝脏出现了炎症灶,8周时肝细胞破损,至16周末,在脂质代谢紊乱与氧化应激持续综合作用下,动物形成中度脂肪性肝纤维化。
实验还发现,在脂质代谢方面,6周时模型的血脂与FFA同时有所回落,除TG外,在8周时都再次升高,推测6周沙鼠对高脂饮食做出了应激性调整。沙鼠在实验前期1~4周内有稳定的高TG血症,且沙鼠血浆中的胆固醇转运与人类相同,即更多的依赖于低密度脂蛋白。因此,在高脂血症模型动物的选择中沙鼠也有很大的优势。
[1]Marchesini G,Bugianesi E,Forlani G,et al.Nonalcoholic fatty liver,steatohepatitis,and the metabolic syndrome[J].Hepatology,2003,37(4):917-923.
[2]Angulo P,Lindor KD.Treatment of nonalcoholic fatty liver:present and emerging therapies.Semin Liver Dis,2001,21(1):81-88.
[3]Homan R,Hanselman JC,Bak-mueller S,et al.Atherosclerosis in Octodon degus(degu)as a model for human disease[J].Atherosclerosis,2010,212(1):48-54
[4]Mühlhausler BS.Nutritional models of type 2 diabetes mellitus[J].Methods Mol Biol,2009,560:19-36.
[5]Rees DA,Alcolado JC.Animal models of diabetes mellitus[J].Diabet Med,2005,22(4):359-370.
[6]Scherneck S,Vogel H,Nestler M,et al.Role of zinc finger transcription factorzfp69 in body fatstorage and diabetes susceptibility of mice[J].Results Probl Cell Differ.2010,52:57-68
[7]Moleroa JC,Leea S,Leizermanb I,et al,Effects of rosiglitazone on intramyocellular lipid accumulation in Psammomys obesus[J].Biochim Biophys Acta,2010,1802(2):235-239
[8]Adeli K,Lewis GF.Intestinal lipoprotein overproduction in insulin-resistant states[J].Curr Opin Lipidol,2008,19(3):221-228.
[9]石巧娟,刘月环,楼琦,等.非酒精性脂肪肝大鼠PPARα基因表达及脂代谢和胰岛素水平的变化[J].中国比较医学杂志,2009,19(8):26-30.
[10]钟民涛,黄敏,卢静,等.长爪沙鼠速发型高脂血症模型的初步建立[J].中国实验动物学报,2006,14(3):217-221.
[11]王芃芃,黄磊,伍晓雄,等.高脂饮食对小鼠脂质代谢和leptin基因表达水平的影响[J].中国实验动物学报,2008,16(1):40-44.
[12]Koteish A,Mae Diehl A.Animal models of steatohepatitis.Best Pract Res Clin Gastroenterol,2002,16(5):679-690.
[13]范建高,曾民德,李继强,等.肝内脂肪和脂质过氧化与肝纤维化关系的实验研究[J].中华内科杂志,1997,36(12):808-811.
[14]丁霞,蒙一纯,偾长恩,等.酒精性肝纤维化动物模型的建立[J].中国中医基础医学杂志,1999,5(7):47-48.
[15]Chitturi S,Farrell GC.Etiopathogenesis of nonalcoholic steatohepatitis.Semin Liver Dis,2001,21(1):27-41.
[16]Wanless IR,Shiota K.The pathogenesis of nonalcoholic steatohepatitis and other fatty liver diseases:a four-step model including the role of lipid release and hepatic venular obstruction in the progression to cirrhosis[J].Semin Liver Dis,2004,24(1):99-106.
[17]Caldwell SH,Crespo DM.The spectrum expended:cryptogenic cirrhosis and the natural history of non-alcoholic fatty liver disease[J].J Hepatol,2004,40(4):578-584.

