雪貂感染流感病毒H3N2动物模型的建立
鲍琳琳,占玲俊,邓 巍,许黎黎,朱 华,吕 琦,李枫棣,秦 川
(中国医学科学院实验动物研究所,卫生部人类疾病比较医学重点实验室,国家中医药管理局人类疾病动物模型三级实验室,北京 100021)
流感病毒具高传染性,且每年在很多国家都会造成区域性的流行。20世纪曾发生过4~5次世界大流行(pandemics),每次间隔9~39年;其中以1918~1919年期间,H1N1流感病毒造成4 500万人的死亡最为严重[1]。自1933年以来甲型病毒已经历了4次抗原转变:1933~1946年为H0N1(原甲型,A0),1946~1957年为H1N1(亚甲型,A1),1957~1968年为H2N2(亚洲甲型,A2),1968年以后为H3N2(香港型,A3)。2009年8月,根据香港最近的流感病毒分析,甲型H1N1流感占49%,H3占43%,显示两种病毒已成主流。甲型H3病毒在香港相当普遍,2008年主要是Brisbane型,2009年出现的甲型H3流感病毒与Brisbane型不同,出现基因漂移情况,但应是源自Brisbane型的变种。2009年8月,据报道,香港已出现3宗因H3流感的死亡个案。所以,在系统研究流感,预防和治疗流感任重而道远。
研究流感过程中重要环节就是动物试验,因此流感病毒感染动物模型的合理建立显得尤为重要。雪貂是目前为止最为敏感的流感病毒感染动物模型,本研究应用雪貂建立H3流感动物模型,从临床症状到实验室检测多个方面系统的评价雪貂感染后的变化,为研究H3流感病毒发病机制评价药物和疫苗奠定基础[2,5]。
1 材料和方法
1.1 材料
1.1.1 毒株:H3N2病毒株为A/Brisbane/10/07,其HA效价都为1:256,107TCID50/mL,由香港大学陈鸿霖教授惠赠。
1.1.2 动物:由美国引进去势雪貂(Mustela Pulourius Furo)6只,4~10月龄,500~1 200g。实验前进行血清学检查,HI方法检测H1N1,H3N2抗体,抗体阴性为合格雪貂方可入组实验。
1.1.3 试剂:RNA提取试剂盒RNeasy Mini Kit购自Qiagen公司,逆转录试剂盒SuperScriptⅢ First-Strand Synthesis System购自Invitrogen公司,荧光染料Power SYBR green PCR master mix,48孔0.2ml PCR反应管fast optical 48-well RXN plate,及光学反应盖膜48-well optical adhesive film 25PK均购自ABI公司,实时荧光定量PCR仪为ABI公司StepOne系列产品。
1.2 方法
1.2.1 雪貂的感染性:实验在本所的BSL-2实验室中进行。将6只雪貂随机分为2个组,每个滴度3只,每笼1只。将雪貂采用兽用氯胺酮轻度麻醉,将流感A/Brisbane/10/07病毒株分别以106TCID50和107TCID50滴鼻感染,每只雪貂鼻孔内均匀滴入500μL病毒液。独立送风隔离笼具中正常饲养。实验的观察期为5d。
1.2.2 皮下芯片植入:实验开始前2周,雪貂采用兽用氯胺酮轻度麻醉后,皮下植入芯片,通过芯片录入实验动物编号,每日读取动物体温数值。
1.2.3 临床观察和取样:实验开始前1周每日记录雪貂体温及体重变化作为感染前背景资料。感染后每天记录体温、体重变化、观察并记录有无咳嗽、流涕、呕吐、腹泻、气促、呼吸困难、明显食欲缺乏等临床表现。感染前0天,感染后第1~5天取鼻甲骨活检物测定病毒载量和病毒滴度。感染后第5天安乐处死动物,取动物肺、肝、脾、肺、小肠、脑组织测定病毒滴度,做病理检查。
1.2.4 病毒滴度的测定:雪貂取肺、肝、脾、小肠、脑组织放入1mL DMEM(青霉素、链霉素各1 000IU/mL)液中,用匀浆器将组织研磨成乳剂,3 000r/min离心10min,取上清液。组织上清液10×连续稀释至10-8,接种于单层培养MDCK细胞的96孔细胞培养板上,每个稀释度接种4个重复孔,CO2培养箱中35℃静止培养,观察记录各孔细胞病变(CPE)情况,连续观察3d,用1%火鸡血球复检,出现凝集反应的结果为阳性[3]。按照Reed-Muench方法计算感染雪貂脏器病毒的TCID50。
1.2.5 病理学检查:大体观察,处死动物后,详细观察肺、肠组织的形态变化;病理切片制备,取处死动物的肺、肠组织,10%甲醛液固定,石蜡包埋,常规病理组织切片处理后,HE方法染色,镜检观察。
1.2.6 PCR检测:鼻甲骨活检物可以直接应用试剂盒RNeasymini kit(Qiagen)提取RNA。鼻甲骨活检物溶于1mL DMEM培养基中,RNA最终浓度溶入无RNA酶的水中,20mg肺组织总RNA提取物定容于30 μL无RNA酶的水中。总RNA中取8μL RNA应用SuperScriptⅢ reverse transcriptase(Invitrogen)逆转录。取cDNA2μL应用Power SYBR green PCR master mix(ABI)作定量PCR。引物:BR-10F 5’-gagaatccagcacacaagag-3’,BR-10R 5’-ttctcagttcaagagtgctc-3’。程序:①94℃,3min;②94℃,30s,③61℃,30s,④72℃,30s(②-④运行35个循环),⑤95℃,15s;⑥60℃,1min;此后运行溶解曲线程序,95℃,15s,60℃,1min;95℃,15s。荧光定量PCR仪可直接读取病毒载量结果。
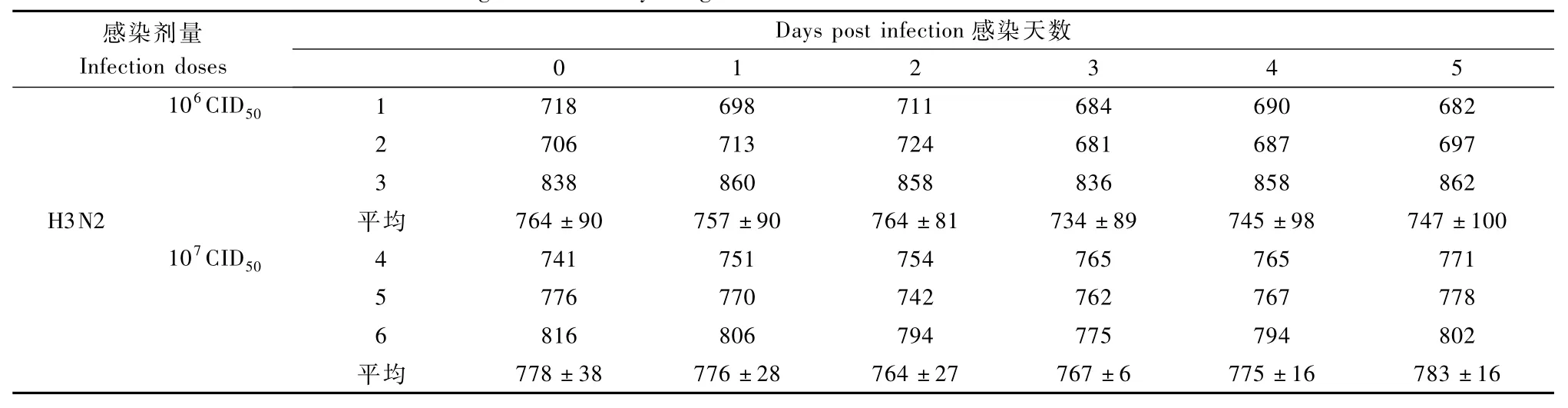
表1 雪貂感染H3N2后体重变化Tab.1 Changes of the body weight of ferrets infected with H3N2 influenza virus
2 结果
2.1 雪貂感染后体重变化
雪貂感染后出现体重下降,106TCID50组由感染后第1天一直持续到实验结束,107TCID50组在感染后第1天呈现体重下降,在感染后第4天到实验结束体重开始回升,体重变化见表1。雪貂感染后体重变化率见图1。
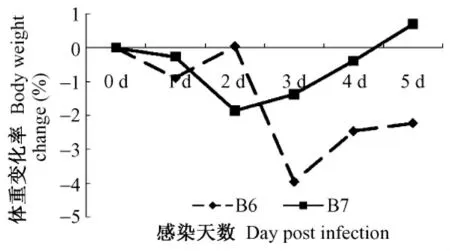
图1 雪貂感染H3N2后体重变化率(%)Fig.1 Changes of the body weight of ferrets infected with H3N2 influenza virus(%)
2.2 雪貂感染H3N2后体温变化
雪貂感染H3N2后出现体温升高,106TCID50组在感染后第2天、第3天出现体温升高,107TCID50组在感染后第2天出现体温一过性升高,体温变化见图2。
2.3 雪貂感染后临床表现
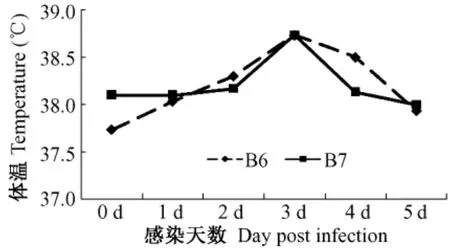
图2 雪貂感染H3N2后体温变化℃Fig.2 Changes of the temperature of ferrets infected with H3N2 influenza virus
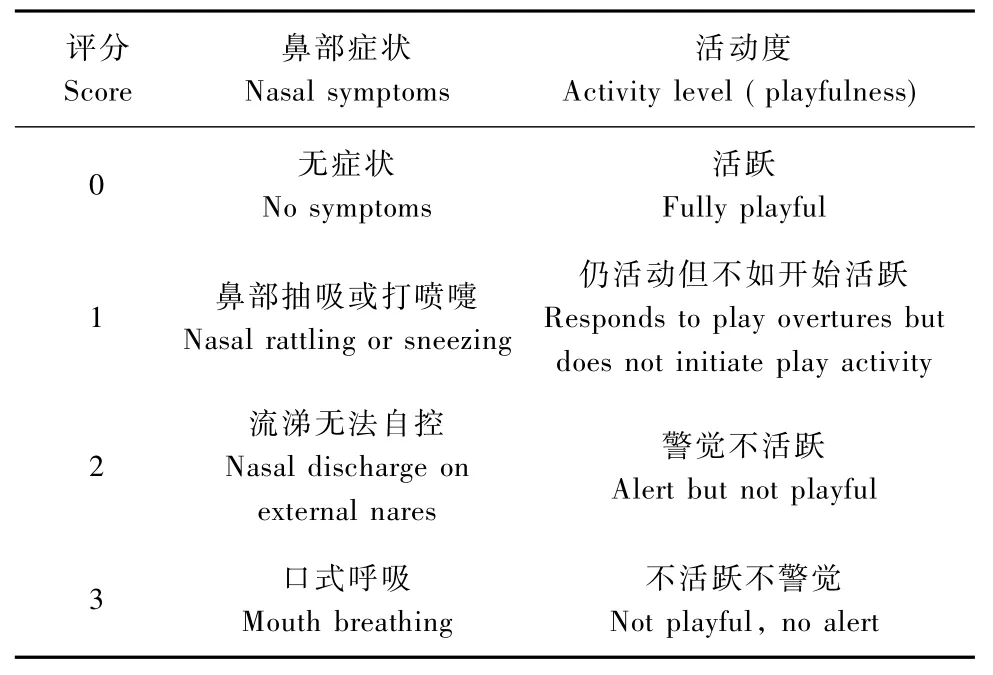
表2 雪貂感染H3N2后临床评分标准:Tab.2 Criteria for clinical sign scores in the ferrets after H3N2 influenza virus infection
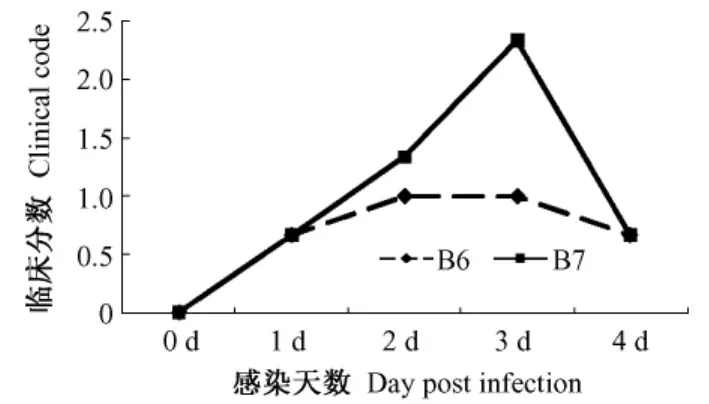
图3 雪貂感染后临床表现评分(分)Fig.3 Scores of clinical signs of the ferrets infected with H3N2 influenza virus
雪貂感染H3N2后的表现临床评分标准:NIH提供的雪貂感染实验观察指标分为鼻部症状和活动度两个部分,具体指标见表2。2组感染的雪貂临床变化相似,雪貂在感染后1d出现症状,主要表现为流涕、打喷嚏等上呼吸道感染的表现,伴有一定程度的活动度下降。雪貂感染后临床变化情况见图3。
2.4 感染雪貂病理变化结果
感染5d后,雪貂安乐死解剖,大体观察到肺组织背侧面和腹侧面有散在点状出血灶,其他组织未见异常。镜下观察发现以肺组织轻度间质性肺炎为主要表现,肺组织肺静脉及肺泡壁毛细血管明显扩张充血,部分肺静脉壁及周围组织明显水肿,局部支气管及肺泡上皮细胞坏死、脱落,肺泡腔内可见渗出和漏出的红细胞、水肿液、炎细胞及坏死脱落的上皮细胞碎屑。其他组织未见明显异常(图4,见封二)。106TCID50组与107TCID50组肺组织病变差异没有显著性。
2.5 感染雪貂病毒的复制及释放
雪貂感染后,每天取鼻甲骨活检物做病毒滴度测定,结果显示106TCID50组雪貂在感染后第2天就可以检测到病毒,滴度为102.1TCID50,一直到感染后第4天可以检测到病毒,而且观察到鼻甲骨活检物的病毒检测呈现下降的趋势。107TCID50组雪貂在感染后鼻甲骨活检物没有检测到病毒,结果见表3。以上的结果说明H3N2病毒感染雪貂后,出现上呼吸道排毒的现象,而且病毒的复制和释放随着感染的天数呈现下降的趋势。从另外一方面来看,2个滴度的病毒感染雪貂后,上呼吸道排毒的现象结果不一致在一定程度上显示106TCID50是一个感染雪貂比较合适的剂量。
雪貂在感染后第5天安乐处死,取雪貂肝、脾、肺、小肠、脑组织做病毒滴度测定。结果显示肝、脾、肺、脑组织都未分到病毒,106TCID50组雪貂小肠组织的病毒在101.8~102.3TCID50之间,106TCID50组在101.8TCID50(表4)。以上的结果反映了H3N2病毒感染雪貂是主要以上呼吸道受到病毒感染为主,肺组织受到病毒感染的程度比较低。肠道组织的高病毒滴度从一定程度可以说明H3N2病毒株可以感染呼吸道以外的组织脏器,并在其中复制释放。
雪貂感染后,每天取鼻甲骨活检物做病毒载量测定,结果显示2个滴度组雪貂在感染后第1天至感染后第5天,上呼吸道排毒都呈下降趋势,见图5。从106TCID50组和107TCID50组雪貂鼻甲骨的病毒载量测定结果来看没有差异。
3 讨论
利用小鼠模型能够进行流感病毒感染、免疫和抗流感病毒药物作用等方面的研究。小鼠作为流感的动物模型会表现为较重的下呼吸道感染的症状(间质性肺炎),有一些人际感染的流感病毒在小鼠身上并不能复制,需要经过多代的适应建立相应的鼠肺适应株才能够感染小鼠。雪貂是目前比较公认的流感适合的动物模型,A型和B型流感病毒都可在雪貂上直接感染不需要经过传代适应。雪貂的解剖结构分为上下气室,有利于研究流感病毒对不同气室的感染。

表3 雪貂感染后鼻甲骨活检物病毒培养滴度情况(log10TCID50)Tab.3 Virus detection and titration in samples from nasal cavity(virus titer was expressed in log10TCID50)
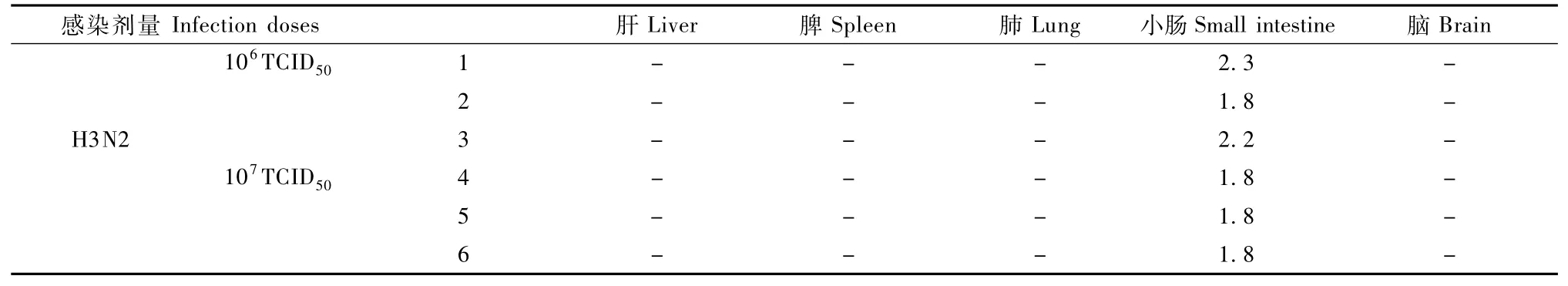
表4 雪貂感染后组织病毒培养滴度情况(log10TCID50)Tab.4 Virus culture from tissues of ferrets(log10 TCID50)
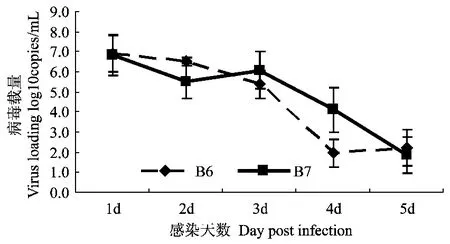
图5 雪貂鼻中病毒载量变化Fig.5 Virus loading from nose of infected ferrets
本次实验中雪貂感染H3N2病毒后出现明显的上呼吸道感染的症状,例如体重下降,体温升高,活动度下降,流涕,打喷嚏等,这与人感染季节性流感病毒后的症状是相似的,雪貂感染后肺部病理改变是散在的点状病灶[4,6]。本试验应用的病毒株是A/Brisbane/10/07,病毒感染雪貂后,病毒分离结果显示,106TCID50组雪貂鼻甲骨活检物在第1天至第4天都可以分离到活病毒,这个结果反映了雪貂感染后出现了持续的上呼吸道排毒,并且病毒的排出呈现下降趋势,鼻甲骨活检物病毒载量的结果也与这一结果相吻合。107TCID50的A/Brisbane/10/07病毒株感染雪貂后,病毒分离的结果没有显示出上呼吸道排毒现象,病毒载量的结果与A/HK/43358/09感染的结果相似,呈现出病毒载量逐天下降的趋势(结果未显示)。这表明A/HK/43358/09病毒株的感染力较弱,相比较而言A/Brisbane/10/07更适于建立雪貂感染H3N2动物模型。A/Brisbane/10/07病毒株感染雪貂后,解剖大体检查发现肺组织上、中、下肺叶背侧面和腹侧面有散在点状暗红色出血灶,镜下可见肺毛细血管明显扩张充血,周围有水肿,局部支气管及肺泡上皮细胞坏死、脱落,肺泡腔内可见大量渗出和漏出的红细胞、水肿液、炎细胞及坏死脱落的上皮细胞碎屑[7]。总结几方面的结果发现106TCID50组雪貂的临床症状和病毒分离结果较107TCID50组更明显,106TCID50的病毒滴度更适用于建立感染雪貂模型。
季节性流感H3N2病毒是A型流感病毒中比较温和的病毒株,难以感染小鼠,建立小鼠感染动物模型通常需要建立鼠肺适应株[8]。对于H3N2病毒感染机制的研究,药物、疫苗评价需要合适的动物模型,本次试验的结果说明雪貂感染的动物模型在临床表现、病毒复制情况以及实验室检查结果几方面都与人感染流感后结果相似,为H3N2流感病毒研究提供了一个研究平台。
[1]Capua I,and Alexander D J.Avian influenza:recent developments[J].Avian Pathol,2004,33:393-404.
[2]Belser,Lu XH,Taronna R.et al.Pathogenesis of avian influenza(H7)virus infection in mice and ferrets:enhanced virulence of Eurasian H7N7 viruses isolated from humans[J].J Virol,2007,81:11139-11147.
[3]Banks J,SpeidelEC,McCauleyJW,etal.Phylogenetic analysis of H7 haemagglutinin subtype influenza A viruses[J].Arch Virol,2000,145:1047-1058.
[4]Bitko V,Musiyenko A,Barik S.Viral infection of the lungs through the eye[J].J Virol,2007,81:783-790.
[5]杨松涛,高玉伟,夏咸柱,等.虎源H5N1亚型禽流感病毒感染小鼠模型的建立[J].中国病毒学,2006,21(4):253-357.
[6]Dybing J K,Stacey SC,Swayne DE,et al.Distinct pathogenesis of Hong Kong-origin H5N1 viruses in mice compared to that of other highly pathogenic H5 avian influenza viruses.[J].J Virol,2000,74:1443-1450.
[7]Fouchier RA,Schneeberger PM,Rozendaal FW,et al.Avian influenza A virus(H7N7)associated with human conjunctivitis and a fatal case of acute respiratory distress syndrome[J].Proc Natl Acad Sci U S A,2004,101:1356-1361.
[8]殷震,刘景华.动物病毒学[M].北京:科学出版社,1997:156-158.

