热带土壤中米曲霉菌株中β-葡萄糖苷酶的性质研究
卓先勤,林 怡,邵东旭
(琼州学院理工学院,海南三亚572022)
前言
β-葡萄糖苷酶 (EC3,2,1,21),英文名是:beta glucosidase,属于水解酶类,又称纤维二糖酶。它的特性是可水解结合于末端、非还原性的β-D-糖苷键,同时释放β-D-葡萄糖和相应的配基[1]。β-葡萄糖苷酶在自然界广泛分布,几乎在所有的生物体中都存在,因其来源不同而β-葡萄糖苷酶的性质各异,在人类的糖原降解和动植物、微生物的糖类代谢方面具有重要的生理功能。
β-葡萄糖苷酶具有高度的耐热稳定性而对纤维质糖化工业,尤其是固定化酶催化反应极为有利;在有机介质中酶法合成具有生理活性的烷基糖苷类化合物,产率比水相反应大大提高;加入金属离子会对酶活性有不同程度的激活或抑制作用;不同的pH对酶的活性也有不同程度的影响;酶活测定以及酶催化反应也存在最佳反应时间。此外,由于β-葡萄糖苷酶因其来源不同而性质各异。鉴于上述这些因素,研究了温度、pH、有机溶剂、金属离子和反应时间对实验室筛选的菌株所产β-葡萄糖苷酶活性的影响,对今后β-葡萄糖苷酶的催化机理及糖基化修饰方面的研究具有重要的意义。
1 材料与方法
1.1 材料、试剂与仪器米曲霉(Aspergillus oryzae)为实验室保藏.
培养基:斜面培养基(马铃薯200 g,蔗糖20 g,琼脂15 g,水1000mL,pH 自然.)、种子培养基[2](可溶性淀粉2%,葡萄糖1%,KH2PO4 0.1%,MgSO4 0.1%,酵母膏0.5%,NaNo3 0.2%,PH 自然)、产酶培养基(麸皮 4%,KH2PO4 0.2%,(NH4)2SO4 0.2%,醋酸钠 0.1%,抗坏血酸 0.1%,MgSO4 0.1%,尿素 0.2%%)。
试剂:水杨苷购于中国药品生物制品检定所;二氧六环、已腈、叔丁醇等均为分析纯.
仪器:净化工作台,THZ-82恒温振荡培养箱,752型紫外分光光度计,真空冷冻干燥仪等。
1.2 β-葡萄糖苷酶粗酶的制备将所需菌种米曲霉在无菌条件下接入斜面培养基(PDA),30℃培养72 h.斜面菌种接人种子培养基,30℃摇床培养42 h.将培养好的菌体按l0%接种量接人到发酵培养基,30℃,150 r/min摇床培养88 h,取出发酵液,4000 r/min离心10 min,收集上清液,测酶活力[2]。
1.3 β-葡萄糖苷酶的性质研究1mL β-葡萄糖苷酶粗酶液溶于2 mL 0.1 mol/L pH 4.8醋酸-醋酸钠缓冲液,研究在不同温度、pH、时间、有机溶剂和不同的金属离子条件下β-葡萄糖苷酶的活性.水杨苷法测酶活[3]。
2 结果与讨论
2.1 温度对酶活力的影响在一定条件下,每一种酶只有在某一温度时表现最大活性,即最适温度。在pH为4.8的粗酶缓冲液,加入水杨苷,分别在30℃、40℃、50℃、60℃、70℃和80℃保温20min后 ,立即冷却,适当稀释,以加热失活的酶液作空白,按水杨苷法测定其酶活[3]。
结果如图1所示,随着温度的升高,酶活力逐渐增大,但是当温度升高到50℃时 ,酶活力开始下降。由此可见,该酶作用的最适温度为50℃。
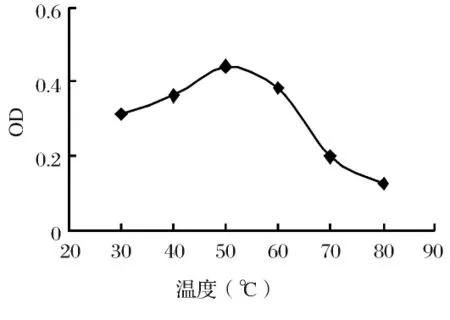
图1 温度对酶活力的影响
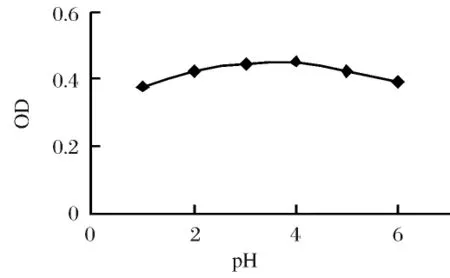
图2 pH对酶活力的影响
2.2 pH对酶活力的影响将粗酶缓冲液分别调至不同pH值,于50℃保温20min,适当稀释后测其酶活力,结果如图2所示,该酶作用的最适 pH为5.0。
2.3 反应时间对酶活力的影响将pH 5的粗酶缓冲液,于50℃分别保温5、10、15、20、25、30、35、40、45、50、55、60min,适当稀释后测其酶活力,结果如图3所示,保温20min是最佳反应时间。
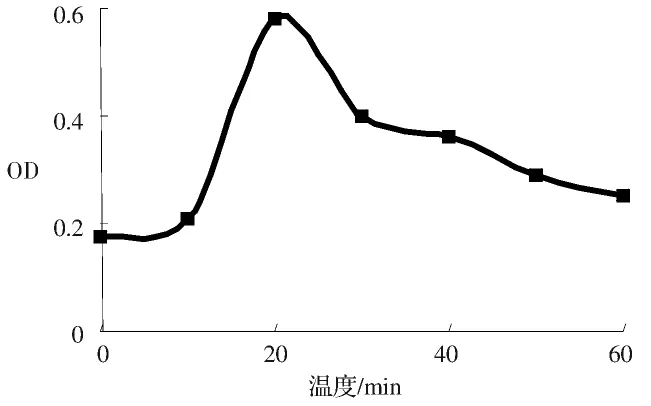
图3 保温时间对酶活力的影响
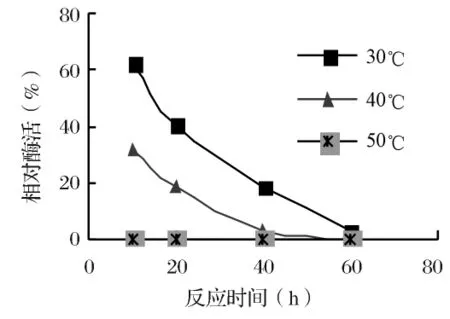
图4 温度对酶稳定性的影响
2.4 β-葡萄糖苷酶的稳定性在pH为5.0的粗酶缓冲液中,加入水杨苷,30、40、50℃分别保温10、20、40、60h,测剩余酶活力,结果见图 4。
结果表明,随着反应时间的延长,酶活力越来越小,到60h后酶活力几乎都为0.为了提高酶催化反应的效率,反应的时间不宜太短,温度应低于酶活最适温度.因此,酶催化水解反应及逆水解合成反应的温度以45℃为宜,反应时间最好不超过40h。
2.5 β-葡萄糖苷酶对有机溶剂的耐受性将β-葡萄糖苷酶冷冻干燥制成酶粉,将酶粉置于不同溶剂含量的不同有机溶剂中,在40℃恒温水浴中保温20min,立即冷却,适当稀释,测定有机溶剂对β-葡萄糖苷酶活性的影响.所选溶剂为合成烷基糖苷常用的三种有机溶剂[4],结果见表1。
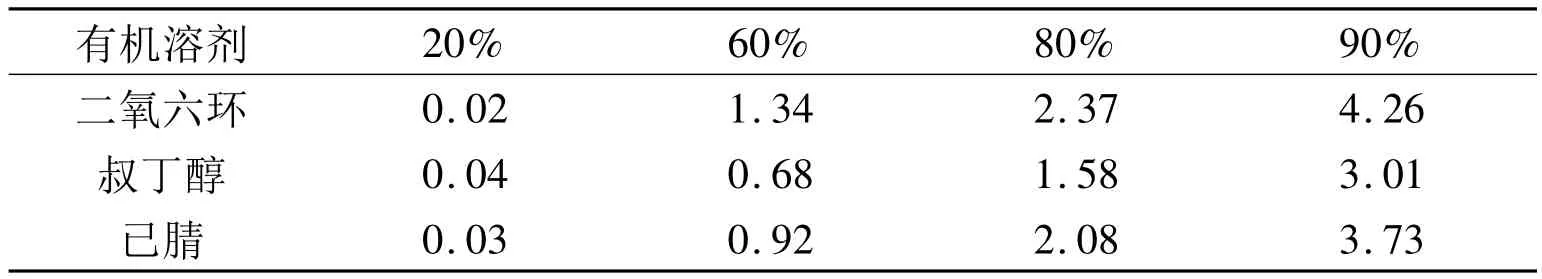
表1 β-葡萄糖苷酶在不同浓度有机溶剂中的活性(OD值表示)
结果表明,对于三种有机溶剂来说,20%有机溶剂浓度条件下,β-葡萄糖苷酶很容易失活,说明低浓度的有机溶剂是酶的失活剂.80%和90%浓度条件下β-葡萄糖苷酶的活力较高,其中酶活力最高的是90%的二氧六环.因而后续的催化合成反应以90%的二氧六环(10%的缓冲液)作为反应介质.
2.6 金属离子对酶活力的影响在pH5的粗酶缓冲液中,加入水杨苷,加入不同的金属离子,50℃保温20min后,测定其相对酶活 (不添加金属离子的酶活为100%),结果见表2.
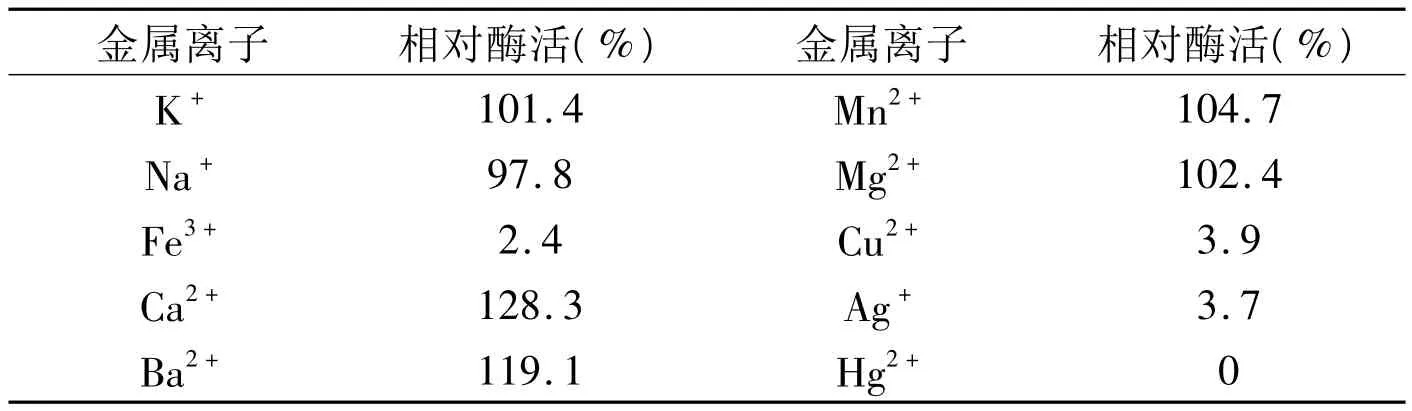
表2 金属离子对β-葡萄糖苷酶活性的影响(相对酶活表示)
结果表明,Ca2+、Ba2+对酶有激活作用,与文献[5]的结果相一致;Hg2+、Fe3+、Cu2+、Ag+对酶有显著的抑制作用 ;K+、Na+、Mn2+、Mg2+对酶活的影响不大,与文献[6]的研究结果相一致。
3 结论
β-葡萄糖苷酶酶活测定的最适条件为:pH 5,50℃水浴中反应20min;酶催化反应:90%的二氧六环(10%缓冲液)作为反应介质,pH 5,45℃,反应 40小时;Ca2+、Ba2+对酶有激活作用,Hg2+、Fe3+、Cu2+、Ag+对酶有显著的抑制作用.该研究对后续实验中β-葡萄糖苷酶的分离纯化,酶活测定,糖基化修饰,以及糖基化合物改性都具有重要的意义。
[1]王华夫,游小青.茶叶中β-葡萄糖苷酶活性的测定[J].中国茶叶,2003(3):16-17.
[2]顾卫民,郭海风,沈爱光.β-葡萄糖苷酶产生菌、发酵条件的优化、粗分离及其特性研究[J].江苏食品与发酵,2007(4):12-16.
[3]杨挺.β-葡萄糖苷酶产生菌及发酵培养基的优化[J].贵阳金筑大学学报,2008,2.
[4]Gabin V,Jacques B,Dominique L B,Jean-Marc M,Daniel T.The novel disaccharides by a newly isolated fructosyl transferase from Bacillus subtilis[J]..Enzyme and Microbial Technology,2009(11):212 -218.
[5]王冬梅,李多川,孟军.嗜热子囊菌光孢变种 Thermoascus aurantiacus var.1evisporus β-葡萄糖苷酶的分离纯化及特性研究[J].农业环境科学学报,2005,24(5):1007 -1012.
[6]李平,宛晓春,丁霄霖,陶文沂.黑曲霉β-葡萄糖苷酶的活力测定和酶学性质[J].安徽农业大学学报,1998,25(3):304-309.

