肝移植术后管腔重建相关并发症的介入治疗
邵海波,徐 克,张曦彤,苏洪英,吴 刚,李 宏,刘永锋
(中国医科大学附属第一医院,辽宁 沈阳 110001)
肝移植需要对肝动脉、门静脉、腔静脉、胆道等管腔结构进行各种方式的重建,由于创伤、吻合、排异反应、解剖生理结构和流体动力学的改变等原因可引起相应的并发症,是影响疗效和导致病人死亡的主要原因之一。我们应用介入放射学的方法对我院肝移植术后16例肝动脉、门静脉及胆管管腔重建相关性并发症进行了介入治疗,取得了良好的效果,报道如下。
1 材料与方法
1.1 病例资料
16例患者均为男性。年龄35~62岁,中位年龄51岁。均采用背驮式原位肝移植术,术后并发肝动脉狭窄4例,肝动脉血栓形成2例,门静脉狭窄并血栓形成1例,胆管吻合口狭窄9例,其中1例并胆汁漏。
1.2 治疗方法
1.2.1 肝动脉并发症
①对于肝动脉狭窄者先行球囊扩张(PTA)治疗,根据动脉管径不同,采用外周或冠脉球囊行PTA,治疗无效或估计难以有效者采用血管内支架治疗。②对于肝动脉血栓形成者采用溶栓导管进行溶栓治疗,给药剂量为尿激酶25万U日两次经导管泵入。溶栓后仍有动脉狭窄者按上述方法处理。
1.2.2 门静脉并发症
本组仅1例门静脉狭窄并血栓形成者,首先经右季肋部穿刺门静脉,经血管造影证实门脉内血栓形成,植入溶栓导管进行溶栓治疗。2天后发现吻合口狭窄,进行PTA及支架置入治疗。治疗后血管造影显示严重的脾肾静脉分流,门脉灌注不足,应用钢圈对脾肾静脉分流进行栓塞治疗。
1.2.3 胆管并发症
①经皮肝穿刺胆道引流术:根据CT及MRCP选择右季肋部或剑突下穿刺入路,穿刺扩张的肝内胆管,成功后注入造影剂行胆管造影,明确狭窄部位及狭窄段长度。胆管明显扩张、胆汁淤积者先作引流,胆管扩张不明显或不全梗阻者直接行PTA及支架置入术。②PTA及支架置入术。球囊导管对狭窄段进行3~5次充分扩张,每次持续20~30s。将PTA的成功标准定义为残余狭窄小于50%。如果PTA后残余狭窄大于50%,则作为内支架置入的指征。置入内支架后继续保留入路3~5天,胆道造影证实胆道通畅,临床症状明显缓解,胆红素降至或接近正常者,则拔除导管,治疗结束。
1.3 观察指标
①血管并发症:术后血管残余狭窄小于50%,血流恢复通畅为有效,否则为无效;置管溶栓术后血栓全部或大部分消失,血流恢复通畅者为有效,血流不能恢复通畅者为无效。②胆管并发症:术后胆管狭窄明显改善,狭窄率<50%,胆汁顺利排泄者为有效,否则为无效。③术后每日监测肝功能(T-Bil,ALT)变化。④随访:出院后每3~6个月进行肝脏超声或CT检查,观察管腔通畅情况,记录患者的生存情况。⑤因例数较少,未做统计学分析。
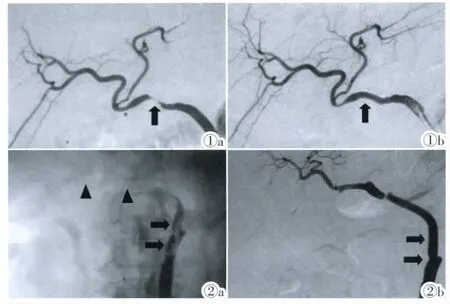
图1 肝动脉狭窄的内支架治疗。图1a:肝动脉造影显示肝动脉重度狭窄(黑箭);图1b:置入支架后造影显示狭窄消失,肝动脉管径恢复正常。图2 肝动脉血栓形成的治疗(髂血管替代重建)。图2a:肝动脉造影可见替代髂血管内条状充盈缺损(黑箭),远端肝动脉不显影(黑箭头)。图2b:溶栓治疗3天后血栓完全消失,管腔通畅(黑箭)。Figure 1.Stent placement for hepatic artery stenosis.Figure 1a: Angiography showed severe stenosis in hepatic artery(black arrow).Figure 1b:Hepatic artery recovered to normal lumen after stent placement.Figure2.Treatment for hepatic artery thrombosis(ilio-vessels replaced reconstruction).Figure 2a:Angiography showed filling defect in replaced ilio-vessel(black arrow)and nonvisulization of distal vessel(black arrow head).Figure 2b:Thrombosis disappeared and vessel lumen smoothed 3 days after thrombolysis(black arrow).
2 结果
2.1 肝动脉并发症
4例肝动脉狭窄均先行PTA治疗,其中1例狭窄完全消失,另3例狭窄程度仍>50%,行肝动脉支架置入术,均获技术成功,支架定位准确,展开良好(图1)。支架置入后残余狭窄均<30%,总有效率为100%。无介入治疗相关并发症发生。2例肝动脉血栓形成行经溶栓3~5天,血栓全部溶解,肝动脉血流恢复通畅,有效率100%(图2)。
2.2 门静脉并发症
间接门脉造影表现为门脉主干截断,远端分支不显影。经皮肝穿门静脉直接造影显示门脉主干吻合口周围节段性狭窄,同时伴有巨大脾肾静脉分流(脾切除术后)。8mm球囊扩张后置入8mm×6cm金属支架1枚,再以8mm钢圈4枚、5mm钢圈4枚栓塞脾静脉,术后造影门静脉狭窄明显改善,残余狭窄不足50%,巨大脾肾静脉分流消失,门静脉血供改善(图 3)。
2.3 胆管并发症
4例胆管明显扩张、胆汁淤积者先作引流,全部置入内外引流管,关闭外引流,作内引流,引流时间9~15天,平均12.5天。2例单纯行PTA术后残余狭窄小于50%,治疗有效。7例反复PTA后残余狭窄大于50%者行胆道支架置入术,共置入7枚金属内支架,直径8~10mm,长度4~7cm。所有病例均获早期技术成功,未出现与介入治疗相关的并发症。术后临床症状均有明显好转。胆红素由术前的(265±126)mmol/l降至术后 1 周的(68±31)mmol/l。 伴有胆汁瘘患者在支架置入术后1个月后造影显示胆汁瘘消失。
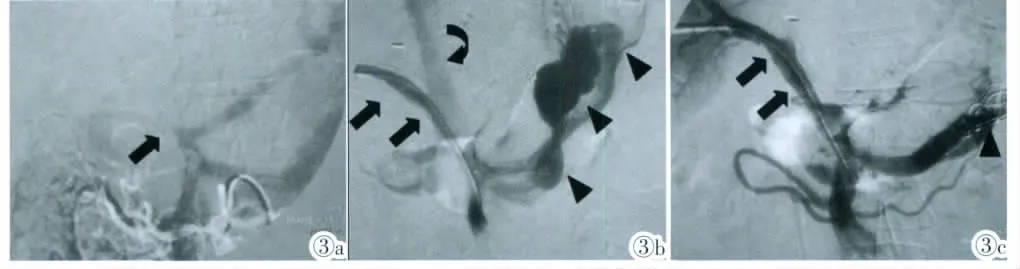
图3 门静脉狭窄、血栓形成及脾静脉分流的治疗。图3a:间接门脉造影显示门静脉起始段闭塞(黑箭),脾静脉及胃冠状静脉粗大。图3b:经皮穿刺门脉成功后进行导管溶栓,PTA及支架置入治疗后门静脉(黑箭)通畅,但血流灌注不足,同时可见巨大的脾肾分流静脉团(箭头),下腔静脉早期显影(弯箭)。图3c:用钢圈(箭头)行分流静脉栓塞后,门静脉(黑箭)血流灌注显著改善。Figure 3.Treatment for portal vein stenosis,thrombosis and splenic shunt.Figure 3a:Angiography showed portal vein occlusion at initial segment(black arrow)and huge splenic vein.Figure 3b:Portal vein turned smooth after thrombolysis,PTA and stent placement but the vein was hypoperfused and splenic kidney shunt appeared(black arrow head).IVC appeared earlier(curved arrow).Figure 3c:Perfusion improved significantly(black arrow)after coil embolization(black arrow head).

图4 胆管吻合口狭窄的介入治疗。图4a:经剑突下穿刺左肝胆管行胆道造影显示肝内胆管扩张,梗阻于胆总管中上段。图4b:导丝开通梗阻段成功后造影显示,吻合口处重度狭窄(箭头)。图4c:支架置入术后狭窄消失,造影剂通过顺利。Figure 4.Treatment for bile duct stenosis.Figure 4a:PTC showed enlarged bile duct and occlusion at middle common bile duct.Figure 4b:Heavy stenosis at stoma was showed after catheter went through(black arrow head).Figure 4c:Bile duct stenosis disappeared after stent placement.
2.4 随访
随访0.5~17个月,平均11.3个月,死亡5例,1例肝动脉狭窄和2例胆管吻合口狭窄患者分别于介入术后9、13、14个月死于肝癌复发,1例胆管吻合口狭窄患者于介入术后2个月死于急性心肌梗死,门静脉并发症患者于介入术后0.5个月死于多脏器功能衰竭。其余患者至今存活,所有病例均未出现介入治疗相关并发症。随访期间影像学检查显示管腔正常,支架通畅。
3 讨论
肝移植已经成为各种终末期肝病的首选治疗方法,随着各种技术如免疫抑制、器官保存及外科操作技术的飞速发展,越来越多的病人接受肝移植治疗[1]。肝移植术后的各种并发症是导致治疗失败的主要原因之一,其中80%以上与肝动脉、门静脉、腔静脉、胆管等管腔结构的重建相关,肝移植术后患者再手术或再移植的风险极大、成功率低,介入治疗因其微创、有效而逐渐成为治疗该并发症的首选方法。
肝动脉并发症的发生率约为4%~16%[2],主要包括肝动脉狭窄、闭塞、血栓形成、岀血、动脉瘤以及盗血综合症等,其形成原因多与手术操作和创伤有关,因此多发生在吻合口附近,少数由排斥反应引起可发生在肝内动脉。肝动脉并发症的出现多见于围手术期,本组6例肝动脉并发症中5例发生在移植术后1周左右,仅有1例肝动脉闭塞发生在术后8个月。考虑到肝移植患者的特殊性,围手术期患者排斥反应较重,另外吻合口附近的PTA易造成肝动脉破裂,我们在选择球囊时直径应偏小,原则上是周围正常动脉直径的80%左右,对于肝动脉较细或肝内分支受累者采用冠脉球囊,尽量降低操作风险。本组有3例患者使用冠脉支架,输送器纤细柔顺性好,从而最大限度的减少了对肝动脉的刺激。肝动脉血栓形成的原因多与术中肝动脉内膜损伤、肝动脉重建后过长、迂曲而造成的血流状态改变有关[3]。肝移植术中肝动脉的重建方式有2种:肝动脉对端吻合和髂血管替代肝动脉,对于供体肝动脉较短或与受体肝动脉管径不匹配者多采用后者,髂血管替代的问题在于改变了肝动脉正常生理解剖位置,而髂血管作为移植物一方面增加了肝动脉的长度和迂曲性,另一方面其本身即刻造成血栓形成,因此肝动脉血栓形成多发生在这种吻合方式中,本组2例肝动脉血栓形成均为髂血管替代重建。对于肝动脉血栓形成的治疗强调及时发现、早期治疗,我们在超声多普勒提示异常后立即进行肝动脉造影检查,对2例肝动脉血栓形成均做到了早期发现和早期治疗,因而达到了较好的临床疗效,如果进行3D CTA检查在等待结果过程中易延误治疗。溶栓过程中我们应用尿激酶25万U日两次经导管给药,取得了良好的临床效果,而没有出现岀血性并发症。
门静脉并发症可直接导致门静脉血流中断,造成肝功能衰竭,因此尽快开通门静脉,恢复血流比较关键。对于门静脉血栓形成,不建议经肠系膜上动脉溶栓,经皮穿刺难度不大,门脉内直接接触性溶栓可取得立竿见影的效果,本组1例患者在溶栓后1小时血流即恢复,对于防止出现移植肝坏死和肝功能衰竭非常重要。门静脉狭窄的部位一般位于吻合口,支架置入治疗是较为常用的方法,直接PTA一般效果较差。门静脉分流也比较常见,可导致血流灌注不足,分流道栓塞可以起到很好的效果,对于巨大的分流道可以采用封堵器进行封堵。腔静脉并发症是经典肝移植常见的并发症,本组未发生腔静脉并发症可能与我院肝移植均采用背驮式肝移植有关。
肝移植术后胆管狭窄的治疗方法包括外科手术治疗、内镜介入治疗、经皮管腔内介入治疗等,目前各移植中心对每种治疗方法倾向不一,尚无统一的定论。与Dorico的观点相同[4],我们认为经皮治疗是多数病例的最佳选择,内镜治疗可以作为另外一种选择[5],但其操作的技术难度相对较大,与经皮治疗相比,其成功与否更多的依赖于操作者的技术水平。我们对9例并发胆管狭窄的患者进行了经皮管腔内治疗,技术成功率达100%,其中3例是内镜治疗失败的病人。其次内镜操作过程中胆道出血、胆管炎、胰腺炎、胆瘘、胆管穿孔和肠道穿孔等并发症较经皮治疗高得多[4]。Sherman[6]报道了4%与内镜操作技术相关的并发症和2%的死亡率(因Oddis括约肌切开),与多数文献相符,本组未出现与操作相关的并发症。再次,内镜治疗不适合胆总管空肠Roux-Y吻合术后的胆管狭窄。但是,对于肝内胆管扩张尚不明显的早期狭窄或不完全梗阻,经皮穿刺较困难,此时内镜治疗应作为首选,对其进行早期治疗是有意义的。肝移植后再次手术的创伤和风险较大,死亡率高,自从微创介入治疗技术应用以来,已经不作为首选,但是对于严重广泛的胆管狭窄、移植物功能丧失,再次手术或二次移植是必需的。经皮介入治疗技术包括经皮胆管引流术、PTA和胆管内支架置入术。PTA为多数学者所推崇[4],但是由于弹性回缩和撕裂后的增生反应,常常有较高的再狭窄率,而且由于需要反复扩张,需常时间留置穿刺道或引流管,有的甚至长达数月或超过1年,增加了并发症出现的几率。我们治疗的9例病人中,反复球囊扩张后,7例狭窄仍大于50%,认为球囊扩张失败,均在1个月内进行了内支架置入术。金属内支架的应用尚存在争议,有人认为内支架置入会使以后的手术变得复杂[4]。Diamond和Culp[7-8]应用金属内支架治疗了一组肝移植术后胆管狭窄的病人,包括球囊扩张治疗失败的,金属内支架被用于肝内胆管狭窄,特别是广泛狭窄,取得了良好的临床疗效。本组7例在3~17个月的随访期内未发生与支架置入相关的并发症,全部保持通畅。
总之,通过对我院肝移植术后肝动脉并发症诊治过程的回顾,我们认为介入治疗技术是治疗肝移植管腔重建相关并发症的有效治疗方法,成功率高,并发症少,应在外科手术前首先考虑。
[1]Jain A,Reyes J,Kashyap R,et al.Long-term survival after liver transplantation in 4000 consecutive patients at a single center[J].Ann Surg,2000,232(4):490-500.
[2]Khalaf H.Vascular complications after deceased and living donor liver transplantation:a single-center experience[J].Transplant Proc,2010,42:865-870.
[3]Cotroneo AR,Stasi C,Cina A,et al.Stent placement in four patients with hepatic artery stenosis or thrombosis after liver transplantation[J].J Vasc Interv Radiol,2002,13:619-623.
[4]Dorico R,Federico C,Emanuele M,et al.Role of Interventional Radiology in the Treatment of Biliary Strictures Following Orthotopic Liver Transplantation[J].CVIR,2002,25:30-35.
[5]Hintze RE,Adler A,Veltzke W,et al.Endoscopic management of biliary complications after orthotopic liver transplantation[J].Hepatogastroenterology,1997,44:258-262.
[6]Sherman S,Jadimar P,Shaked A,et al.Biliary tract complicationsafter orthotopic liver transplantation [J].Transplantation,1995,60:467-470.
[7]Diamond NG,Lee SP,Niblett RL,et al.Metallic stents for treatment of intrahepatic biliary strictures after liver transplantation[J].J Vasc Interv Radiol,1995,199:755-761.
[8]Culp WC,McCowan TC,Lieberman RP,et al.Biliary strictures in liver transplant recipients:Treatment with metal stents[J].Radiology,1996,199:339-346.

